拟果蝇钠离子通道基因克隆及其生物信息学分析
邓登辉,段文波,王 颢,李 芬,吴少英1,**
(1.河南农业大学植物保护学院,郑州 450000;2.海南大学植物保护学院,海口 570228)
拟果蝇Drosophilasimulans是双翅目Diptera果蝇科Drosophilidae果蝇属Drosophila一种世界性害虫,主要为害杨梅、葡萄、香蕉等经济水果[1]。拟果蝇也是一种入侵生物,与黑腹果蝇Drosophilamelanogaster同源性很高,具有繁殖能力强、生活周期短和世代重叠等特点。拟果蝇这些特征容易造成暴发性危害,在我国云南等水果产区在收获时就深受其害[2]。拟果蝇在东亚地区的首次报道是 20世纪初期日本的小笠原岛,1972年在日本境内迅速扩张造成暴发,甚至在其数量上迅速超过黑腹果蝇[3,4]。我国武汉最早于1993年报道拟果蝇[5],1996年于北京地区有发现,近30年的时间里就已经扩散至我国各个省市,并逐渐适应新环境,形成具有稳定特性的群体,这些群体以遗传距离和地理位置大致分为南北两大支系[6]。拟果蝇的扩散与人类贸易活动和迁移有密切关系。在生产上对于拟果蝇以化学防治为主,国内主要使用的是拟除虫菊酯类农药、印楝素农药和多杀菌素类农药等[7,8]。虽然国内暂时未收到拟果蝇对各类农药产生抗性的报道,但在我国其近源昆虫橘小实蝇Bactroceradorsalis和家蝇Muscadomestica已经对拟除虫菊酯类杀虫剂产生了严重的抗药性[9,10]。
拟除虫菊酯杀虫剂的作用靶标是钠离子通道,菊酯药剂会引起昆虫神经性中毒反应,毒杀害虫。钠离子通道是糖基化大分子蛋白,它是由一个大分子α亚基和几个小分子β亚基组成[11]。在哺乳动物中发现的α亚基有9种,种类不同存在的动物组织区域也不同。昆虫绝大部分只有一种α亚基基因,包含Ⅰ~Ⅳ共4个同源跨膜结构域和DEKA模块,DEKA模块指每个结构域P环上分别有D、E、K、A四个氨基酸残基,此模块决定了钠离子通道的离子选择性。钠离子通道位于结构域ⅢS6和ⅣS1之间,存在一个疏水性氨基酸碱基构成的失活阀门,哺乳动物为异亮氨酸-苯丙氨酸-甲硫氨酸(Ilt-Phe-Met),简称IFM;而昆虫中则是甲硫氨酸-苯丙氨酸-甲硫氨酸(Met-Phe-Met),简称MFM,其保守性在不同物种之间极高[12]。DEKA与MFM为昆虫钠离子通道的关键氨基酸位点。第一个被鉴定出昆虫钠离子通道的昆虫是黑腹果蝇,随后家蝇、德国小蠊Blattellagermanica、冈比亚按蚊Anophelesgambiae、烟蚜夜蛾Heliothisvirescens等也被相继获得[13-16]。钠离子通道是神经系统与毒素作用的重要结构,许多种神经毒素可以与之发生作用,如河豚毒素、蛤蚌毒素、藜芦碱、箭毒蛙毒素、多肽毒素、拟除虫菊酯、DDT和阻断剂茚虫威(indoxacard)等[17]。拟除虫菊酯杀虫剂作用于昆虫神经钠离子通道后,钠离子通道可以有选择地改变与杀虫剂结合部位的结构从而引起 kdr(knock-down resistent)抗性,降低了昆虫对拟除虫菊酯杀虫剂的敏感性[18]。在昆虫体内钠离子通道蛋白的多样性是通过选择性剪接和RNA编辑实现的,其方式是在mRNA中进行不同方式的剪接来产生剪接异构体[19]以及mRNA的遗传信息通过核苷酸的变化发生改变[20],这些受体蛋白不仅会因为选择性剪接的不同而产生不同的转录结果,也会由于氨基酸编码序列缺失、替换或者删除导致蛋白氨基酸组成发生改变,二者的存在均对通道的控制性和药理学特性产生影响。
随着拟除虫菊酯药剂施用,拟果蝇对其也可能产生抗药性,研究拟果蝇钠离子通道基因刻不容缓。本文根据NCBI和拟果蝇转录组测序获得的数据设计引物,从拟果蝇中克隆钠离子通道基因序列,对克隆得到的拟果蝇钠离子通道基因进行序列对比分析,鉴定拟果蝇钠离子通道的典型特征,构建系统发育树,明确拟果蝇在进化上是否保守以及与其他昆虫种类钠离子通道的进化关系。
1 材料与方法
1.1 供试昆虫和地点
试验于2017年9月至2018年10月在河南农业大学植物保护学院昆虫神经毒理实验室完成。供试昆虫由本课题组长期人工饲养,室内饲养条件:温度约25 ℃,相对湿度75%~80%,光周期16L:8D。饲料配方:玉米面17 g,蔗糖16 g,香蕉泥15 g,苹果泥15 g,可食用琼脂1 g,水500 mL,酵母粉3 g,丙酸0.5 mL。
1.2 主要试剂
Trizol-RNA抽提试剂盒(天根),DL10000 DNA Marker(TaKaRa)、PrimeScriptTM 1st Strand cDNA Synthesis Kit(TaKaRa),Phanta Max Super-Fidelity DNA Polymerase(南京Vazyme)、Clone Express®ⅡOne Step Cloning Kit(南京Vazyme),Cycle Pure Kit(美国OMEGA),StarGreen核酸染料(北京康润),大肠杆菌XL-10(北京博迈德),Tris饱和酚、琼脂糖、氨苄青霉素(北京索莱宝)。
1.3 拟果蝇总RNA的提取和反转录合成cDNA
提取羽化2~3 d的成虫30头,用Trizol法进行总RNA的粗提,然后对其粗提产物进行凝胶电泳,检测其完整性。选取部分产物,检测其OD值,选260/280值在1.8~2.0区间的样品立即进行后续试验。按照PrimeScriptTM 1st Strand cDNA Synthesis Kit试剂盒要求合成cDNA,并放于-20 ℃或-80 ℃保存。
1.4 引物合成及基因序列克隆和测序
根据NCBI和转录组的序列数据,利用Primer 5.0 软件设计特异性引物,设计一对拟果蝇钠离子通道全长特异性引物(表1),进行PCR 扩增,获得PCR产物。PCR反应在50 μL体系中进行,每个反应包含2×Phanta Max Buffer(Mg2+plus)25 μL、cDNA 模板2 μL、ddH2O 17 μL、Phanta Max Super-Fidelity DNA Polymerase 1 μL、dNTPs(10 mmol/L)1 μL 和上下游引物各 2 μL。扩增条件:95 ℃预变性 3 min,95 ℃变性15 s,58.5 ℃复性15 s,72 ℃延伸5 min,共30 个循环,最后72 ℃延伸8 min。
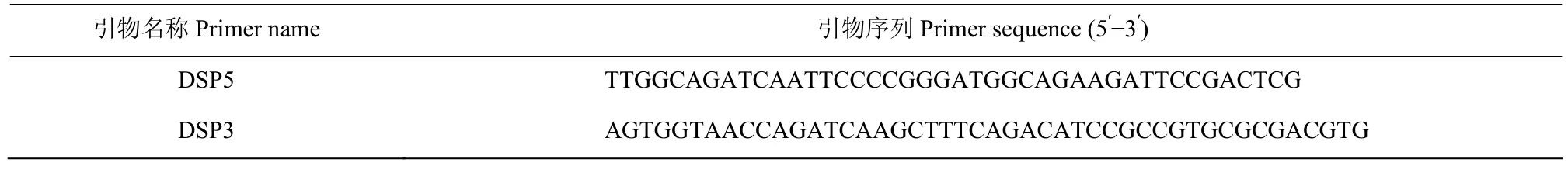
表1 拟果蝇钠离子通道基因克隆所用引物Table 1 Primers used for the cloning of Drosophila simulans sodium channel
取出部分PCR产物,用1%的琼脂糖凝胶电泳检测并回收目的条带,用PCR纯化回收试剂盒Cycle Pure Kit,回收目的产物,将目的产物与载体PGH19连接,再转化到XL-10感受态细胞中。经抗氨苄培养基筛选,鉴定阳性克隆子进行测序,利用DNASTAR.Lasergene 7软件进行拼接。
1.5 钠离子通道核苷酸序列编码的氨基酸序列分析和系统进化树构建
钠离子通道核苷酸序列利用在线网站NCBI进行Blast比对,使用DNASTAR.Lasergene 7和Gene.doc软件进行同源比对分析,通过Protparam 软件分析编码蛋白的氨基酸序列组成、相对分子质量等理化性质。
采用28种昆虫的钠离子通道氨基酸序列,通过Mega 7.0[21]对昆虫氨基酸数据集进行进化模型的选择,应用邻接法构建分子系统发育树,并进行2000次的检验评估。
2 结果与分析
2.1 拟果蝇钠离子通道基因序列分析
克隆获得拟果蝇完整钠离子通道基因,命名为Drosophilasimulans-soudium channel(DsNav1)(图1),其GenBank登录号为MT113357。该基因编码区长为6270 bp,共编码2090个氨基酸,蛋白分子量为235 kD,等电点4.73(图2)。拟果蝇钠离子通道与黑腹果蝇和家蝇的钠离子通道基因相似度分别为96.86%和88.75%。对DsNav1的跨膜结构进行分析发现,该基因包含钠离子通道的典型结构特征含有4个同源跨膜结构域I、II、III和IV,每个结构域都含有6个跨膜疏水性螺旋体S1~S6,其中,S1~S4为电压感受模块,感受电压变化,S5、S6以及连接他们的LOOP组成孔模块,电压模块和孔模块之间是通过短肽连接的,由于其结构域上LOOP的氨基酸残基不同,形成其独特的离子选择性,这4个氨基酸残基分别是D、E、K、A且具有高度保守性。在结构域IIIS6和IVS1间的多肽链是昆虫钠离子通道快速失活所必须的MFM模块,具有昆虫钠离子通道的典型特征,鉴定为拟果蝇钠离子通道(图3)。
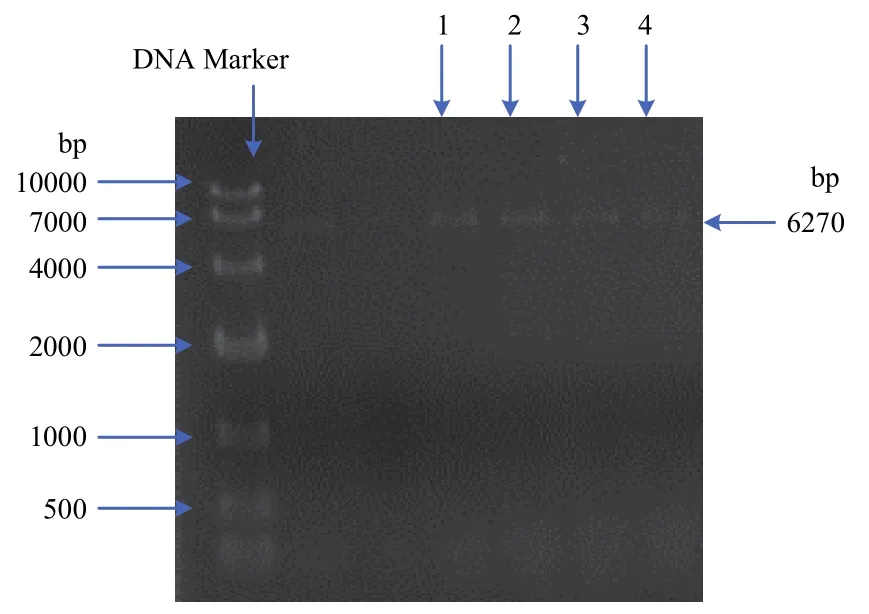
图1 拟果蝇钠离子通道全长基因电泳图(1,2,3,4为钠离子通道全长基因电泳图)Fig.1 Electrophoresis map of full-length gene of sodium channel of Drosophila simulans (1,2,3,4 are full-length electrophoresis maps of sodium ion channels)

图2 拟果蝇钠离子通道氨基酸序列图Fig.2 Sodium channel amino acid sequences of Drosophila simulans
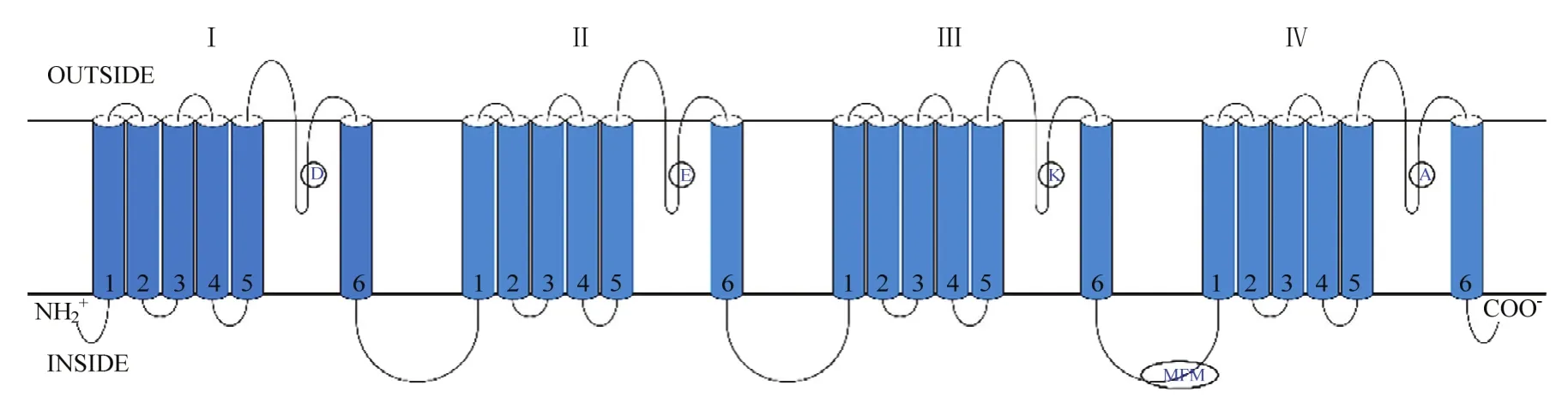
图3 拟果蝇钠离子通道拓扑图Fig.3 Topological diagram of Drosophila simulans sodium channel
2.2 分子系统进化分析
用邻接法(Neighbor-Joining,NJ)构建DsNav1与其他昆虫种群电压门控钠离子通道基因的氨基酸序列进化树(图4),从结果上可以看出,拟果蝇钠离子通道基因与黑腹果蝇钠离子通道遗传距离最近,与瓜实蝇Bactroceracucurbitae和橘小实蝇钠离子通道基因遗传距离稍远,且双翅目昆虫钠离子通道基因聚为一支,其次鳞翅目昆虫钠离子遗传通道与其比较接近。该系统进化树分支与昆虫分类学上物种分类十分吻合,昆虫钠离子通道基因具有高度保守的特性。
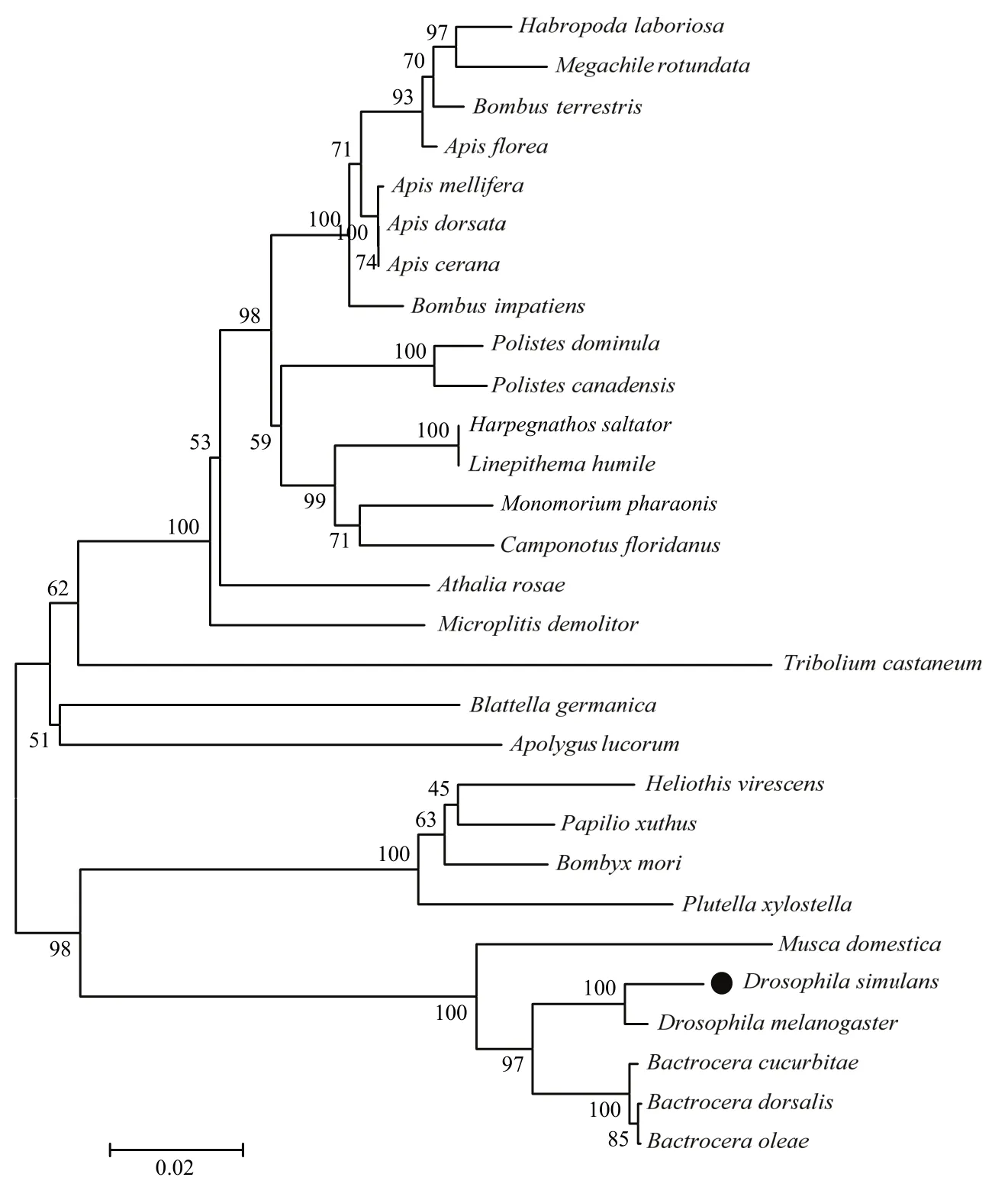
图4 部分昆虫钠离子通道构建系统发生树Fig.4 Partial insect sodium channel builds phylogenetic tree
2.3 选择性剪切
在拟果蝇钠离子克隆的结果中,发现了3个选择性剪接分别是exon i、exon a和exon b,这三个选择性剪接均位于结构域I~II的连接肽区域,其氨基酸及核苷酸序列如图5。exon b单独存在,exon i和exon a相邻,但不同时缺失。

图5 拟果蝇钠离子通道3个选择性剪接氨基酸及其核苷酸序列Fig.5 Three alternative splicing amino acids and nucleotide sequences of Drosophila simulans sodium channel
2.4 RNA编辑
分析拟果蝇钠离子通道基因序列,鉴定出17个核苷酸变化(表2),其中10个引起氨基酸改变,这10个氨基酸变化中有8个是由A至I的RNA编辑导致的,另外两种则是由U至C的RNA编辑引起。大部分的编辑位点在于各结构域之间和结构域模块的短肽链上。
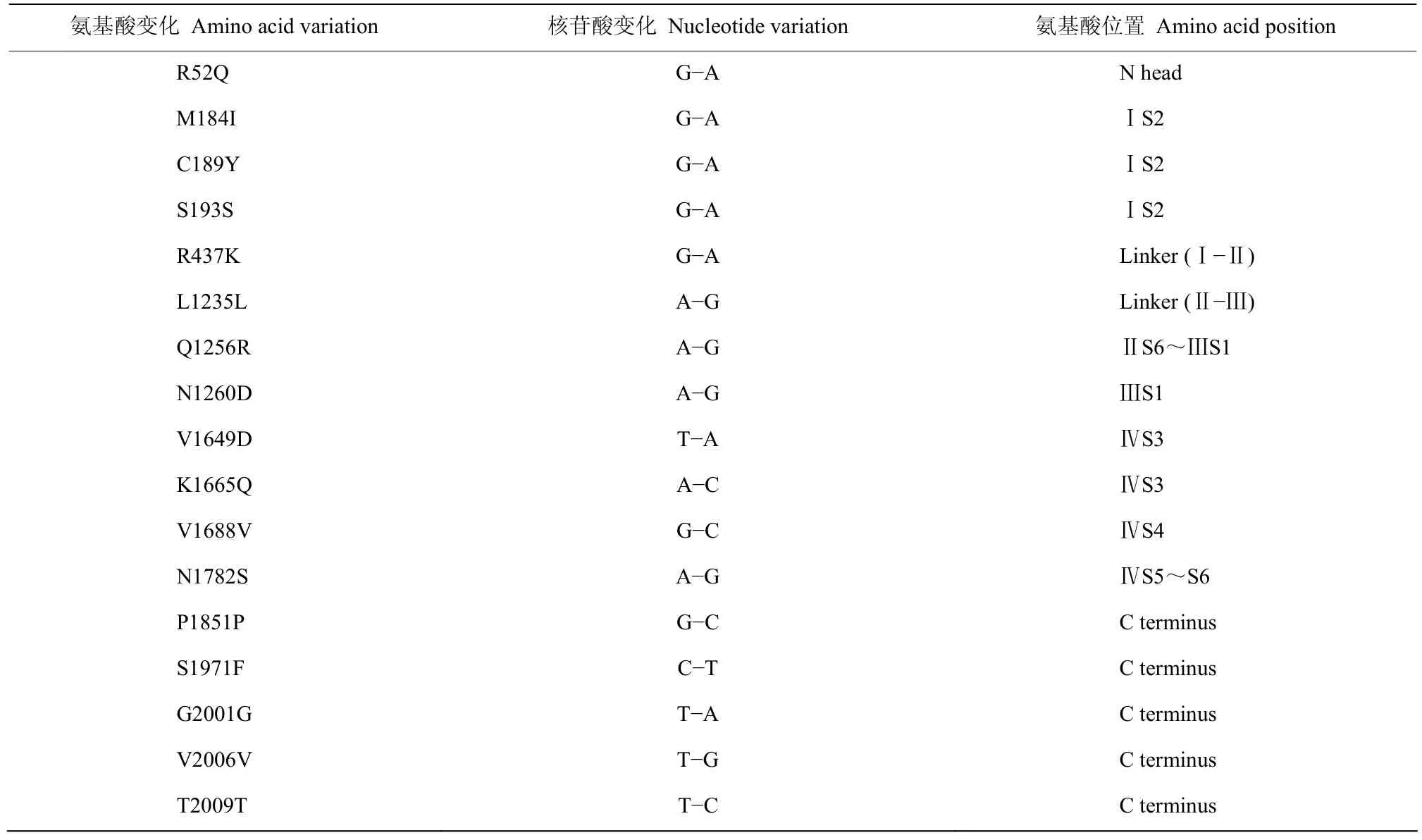
表2 拟果蝇钠离子通道RNA编辑的氨基酸位点及核苷酸变化Table 2 Amino acid sites and nucleotide changes in RNA editing of Drosophila simulans sodium channel
3 讨论
世界上首次分离的昆虫钠离子通道基因是黑腹果蝇的para基因,它与脊椎动物钠离子通道有极高的同源性。虽然在此之前也克隆获得与哺乳动物同源性很高的DSC1基因[22],但随后研究证明其编码为钙离子家族阳离子通道。para基因的辅助亚基tipE对para基因表达有帮助,比para基因单独表达电位上升和失活速率都快[23]。目前为止,在哺乳动物中发现9种钠通道蛋白亚型,而且存在时空和组织部位上的表达差异性[24],使哺乳动物钠离子通道具有不同的蛋白亚型,并具有不同生理和药理的功能特性。而昆虫绝大部分只有一种钠离子通道基因,蚜虫如麦长管蚜[25]等是利用两个离子钠通道基因行使钠通道功能。
昆虫钠离子通道通过选择性剪接和RNA编辑两种形式增加蛋白多样性。目前为止,钠离子通道的选择性剪接已在家蝇、黑腹果蝇、绿盲蝽Apolyguslucorμm[26]等多种昆虫物种中被发现。双翅目昆虫黑腹果蝇的钠离子通道基因有9个可剪接的外显子,有7个在细胞内连接肽上的选择性外显子a、b、e、f、h、i、j,有2个在结构域II、III的跨膜区的互斥外显子c/d、l/k[27]。其近似种拟果蝇中也存在选择性剪接,发现3种选择性外显子i、a、b,其中exon i 和exon a 相邻,并出现连锁现象,此现象在半翅目昆虫绿盲蝽的钠离子通道中也有呈现。绿盲蝽钠通道发现外显子n、o、a和p有7种选择性剪接类型。四外显子连锁频率较低(2.08%),三外显子连锁仅发生在外显子o、a、p,有三种类型的双外显子连锁(外显子a和p,o和p,o和a),外显子a和p单独存在,外显子p的频率(40.63%)高于其他外显子。这对于外显子s和q一起出现或单独出现,缺失外显子q和s的选择性剪接类型的频率(63.55%)高于其他类型[26]。关于外显子的剪接情况,在不同物种中剪接结果是不同的,如exon i在直翅目、半翅目、膜翅目、鳞翅目等常见昆虫中均有发现,在较低级物种类群尚未发现,如哲水蚤目[28]。各类型外显子会对钠通道造成不同的影响,如外显子f会促进离子通道向超极化方向偏移,外显子j和e则会导致钠离子通道活化向去极化移动,外显子h会使钠离子通道失活去极化偏移,外显子b则会影响钠离子通道的表达程度,不存在外显子b的钠离子通道表达量会比存在外显子 b的通道类型显著增加[29,30]。互斥外显子 k/l存在差异,含有外显子 l的钠通道电流持续大一些[31]。两对互斥外显子在很多物种中都具有保守性,但是在德国小蠊中只存在外显子c,并没有外显子d[29]。德国小蠊中存在的三个外显子,分别是G1、G2、G3,且G1、G2对应于果蝇外显子l和k,外显子G3包含一个终止密码子,产生只有前两个结构域的蛋白[32]。在哺乳动物中也有类似的G3外显子,也具有终止密码子,并产生类似的截短蛋白。在已报道的文献中黑腹果蝇存在的选择性剪接在绿盲蝽AlNav基因[26]、家蝇Vssc1基因[33]、德国小蠊BgNav基因[32]、埃及伊蚊AedesaegyptiAaNav基因[34]等中具有一定保守性,但即使同一种选择性外显子,其利用率在不同种群中也有差别,如黑腹果蝇和家蝇中外显子b的利用率有60%[33],德国小蠊钠离子通道中的外显子b的使用率却低于20%,在绿盲蝽中外显子b占有50%以上的使用频率[26]。随着测序技术不断提高,昆虫选择性剪切信息越来越多的呈现,对于其在昆虫钠通道中发挥的作用会越来越清晰。
RNA编辑是扩大生物遗传信息的另一种方式[35]。由于核苷酸的缺失、插入和置换,基因转录序列与编码不符,使产生的蛋白质氨基酸组成发生变化。对RNA进行编辑的酶称为RNA编辑酶,研究最多的是ADAR1(RNA依赖性腺嘌呤脱氨酶),该酶可以将特殊位点的腺苷(A)去氨基转化为次黄嘌呤(I),导致核苷酸序列发生变化,甚至蛋白质也产生改变,这类编辑称为A至I编辑。在拟果蝇钠离子通道的分析中发现,由A至I的RNA编辑的位点有三个位点Q52R、C189Y和N1260D,这三个位点在黑腹果蝇[36-39]也曾被报道。然而这些编辑位点是否会带来电压门控以及药剂的结合程度的变化仍需确定[12]。在德国小蠊的钠离子通道中的K184R位点,会使钠离子通道激活向去极化方向偏移,与其相似的C189Y位点是否会有类似的作用还有待证明。RNA编辑也会改变钠离子通道门控性质,在其表达上会有微小差别,也可引起巨大的行为反差,如棉铃虫钠离子通道的A-I编辑引起I951V位点的突变,降低了与拟除虫菊酯类药剂结合的敏感性[40]。
拟除虫菊酯类杀虫剂作用于钠离子通道会引起兴奋、抽搐、运动失调甚至死亡等症状。击倒抗性是钠离子通道敏感度降低引起对DDT和拟除虫菊酯抗性的重要机制。已报道的抗性相关位点在4个结构域均有分布,常见的kdr突变位点如结构域IIS6的L1014F,该突变在不同昆虫种类中会突变为不同的氨基酸,如苯丙氨酸、色氨酸、丝氨酸等[41],这些突变引起IIS6构象发生变化,使钠通道与拟除虫菊酯类药剂的结合能力减弱。突变位置在IS6的V410M,该突变点在抗性烟蚜夜蛾和果蝇中被发现,会极大地降低通道的敏感程度[42]。同一个突变位点对于不同类型的拟除虫菊酯类药剂造成的结果也是不同的,如F1534C位点,极大降低了与I型拟除虫菊酯类药剂的结合,可对于II型拟除虫菊酯药剂无效[43]。由此可见钠通道氨基酸突变能影响与药剂结合,药剂构型的不同也会影响与钠通道的结合。
本研究成功克隆拟果蝇钠离子通道基因,并发现的3个选择性剪接外显子和17个RNA编辑。后续研究中抗性突变位点的确定是重要方向,及时发现拟果蝇钠离子通道kdr抗性突变,研究其与药剂的结合能力及筛选合适药剂,对拟除虫菊酯杀虫剂使用寿命的延长具有重要意义,也可以极大程度上延缓抗性品种的产生。

