出芽短梗霉菌PA-2侵染对藜叶片代谢的影响
高汉峰,杨 莹,陈红雨,程 亮,郭青云
(青海大学农林科学院/青海省农业有害生物综合治理重点实验室/农业农村部西宁作物有害生物科学观测实验站,西宁 810016)
杂草是影响农业生产的重要生物因子之一。藜Chenopodiumalbum在全世界分布有250个种和亚种[1],危害世界不同地区25种农作物[2]。藜干扰目的作物生长,恶化环境,污染农产品,传播病虫害,阻碍机械播种和收获,是影响作物产量和品质的主要生物逆境之一[3]。化学除草剂是目前防治藜最有效、最经济的方法之一,但随着使用量和使用年数的增加,化学除草剂面临诸如抗药性、环境污染等问题[4],而生物防治由于对人畜和非目标生物安全,环境兼容性良好,产生抗性几率低,易于保护生物多样性,来源广等优点,从而为病虫草害防控提供了一条新的途径。出芽短梗霉菌PA-2是课题组从感病杨树叶片上分离到的一株真菌,前期对该菌株的致病性、寄主专一性和培养条件进行了测试,发现该菌对藜的防除效果较好,达到 78.46%,显示出该菌有潜力发展成为防治藜的生物除草剂[5]。据文献报道,植物病原真菌Ascochyta caulina对藜具有很好的除草效果[6,7],从该真菌中提取的天冬毒素和反式-4-氨基-D-脯氨酸在温室条件下均显示出对藜的高效除草活性,造成藜叶片和茎杆严重坏死,从而导致藜死亡。Evidente等[8]研究发现Phomachenopodiicola产生的藜芦皂苷、呋喃和异香豆素均对藜叶片有明显的致萎作用。出芽短梗霉菌是一类和酵母菌相关的真菌,应用于多个研究领域,其中包括生物防治[7,8]。对于其生物防治方面大多集中在对病原菌的抑菌效果方面,其抑菌机制大多是与病原菌争夺空间和养分的结果[9-11]。关于出芽短梗霉菌在侵染藜方面的报道主要集中在植物受侵染后植株形态变化及体内防御酶变化[12,13]。但这些研究尚未涉及藜在受到PA-2侵染时机体内哪些代谢通路被改变,而代谢组学的研究介于基因、蛋白和细胞、组织之间,植物代谢产物的分析更能反应植物的生理状态,有助于探究在侵染时代谢通路的变化情况。但是,关于藜受病原菌侵染代谢组学的研究却鲜见报道。本研究选择阔叶杂草藜为研究对象,利用色谱-质谱联用技术(LC-MS)进行代谢组学分析,以期揭示PA-2侵染藜的代谢机制,为PA-2生物除草制剂商品化奠定理论参考。
1 材料与方法
1.1 试验材料
本试验在青海省农林科学院植物保护研究所培养室中进行。发酵液的制备参照文献[14]进行,即首先将本实验室保存的出芽短梗霉菌PA-2接种于PDA培养基中,于28 ℃恒温培养5 d,然后用打孔器(Φ=8 mm)在菌落边缘取菌饼接种于装有50 mL种子液(葡萄糖20.0 g/L、蛋白胨20.0 g/L、酵母浸粉10.0 g/L)的250 mL的锥形瓶内,每个锥形瓶接种1个菌饼,然后于25 ℃、180 r/min的摇床上培养3 d后制成发酵液。
在温室中,放置10个内径20 cm的盆钵。每盆移入3~4叶期的藜幼苗5株,待移入的幼苗长至8片叶时,将PA-2发酵液稀释至孢子浓度为 106~108孢子/mL,接种量为每盆20 mL,接种5盆作为试验组,另外5盆每盆接种20 mL无菌水作为对照,保持相对湿度在60%左右,温度为20 ℃。接种24 h后发现试验组藜叶片明显萎焉,采集处理组和对照组的藜叶片,将采集的叶片立即放入液氮中冷冻并放入-80 ℃超低温冰箱中保存备用。
1.2 试验仪器与试剂
超高效液相(美国Agilent公司UHPLC1290型)、质谱仪(美国Thermo Fisher Scientific公司Q Exactive Focus型)、微量离心机(美国Thermo Fisher Scientific公司Heraeus Fresco17型)、电子天平(德国Sartorius公司BSA124S-CW型)、研磨机(上海净信公司JXFSTPRP-24)、超纯水机(德国Merck Millipore公司Ming che D24 UV型)、色谱柱(美国Warers公司ACQUITY UPLC HSS T3型;2.1×100 mm,1.8 m)。甲醇、乙腈、乙酸铵、甲酸均购自德国CNW公司,2-氯-L-苯丙氨酸(上海恒柏生物科技公司)。
1.3 试验方法
1.3.1 样品处理 将50 mg样品放入EP管中。加入1000 μL萃取溶剂后(乙腈-甲醇-水,2:2:1,含内标),将样品涡旋30 s,以45 Hz条件匀化4 min,然后在冰水浴中超声提取5 min。匀浆重复超声提取3次,然后在-20 ℃ 孵育1 h后,在4 ℃、12000 r/min离心15 min。取100 μL上清液于2 mL进样小瓶中,进行UHPLC-QE Orbitrap/MS分析。
1.3.2 液质联用条件 采用液相色谱-质谱仪联用对代谢产物进行分离检测。色谱条件:流动相:A=0.1%甲酸+5 mmol/L乙酸铵的水,B=乙腈。洗脱梯度设置为:0 min,1% B;1 min,1% B;8 min,99% B;10 min,99% B;10.1 min,1% B;12 min,1% B。流速为0.5 mL/min。进样量2 μL。质谱条件:使用电喷雾离子源(ESI),鞘气压力为310 kPa,辅助气体流速为5 L/min,毛细管温度为320 ℃,全质谱仪(MS)分辨率为70000 FWHM,MS/MS分辨率为17500 FWHM,碰撞能量梯度为20、40、60 eV,喷雾电压为分别为3.8 kV(阳离子模式)及-3.1 kV(阴离子模式)。
1.4 数据统计与分析
1.4.1 数据处理与注释 使用ProteoWizard软件将来自于MS原始数据(.raw)文件转换为mzML格式,并通过R软件XCMS(3.2版)处理数据,处理过程包括保留时间对齐,峰检测和峰匹配。然后按照以下标准过滤数据:样本编号包含一个代谢物少于一个组中所有样本数量的50%(质控也被视为一个组)。随后将每个样品标准化为内标[15]。默认情况下,将值替换为数据集中找到的最小值的一半[16]。预处理结果生成了一个数据矩阵,其中包括保留时间(RT),质荷比(m/z)值和峰强度。使用 OSI-SMMS(1.0版,大连化工数据解决方案信息技术有限公司)进行峰注释后利用基迪奥生物科技有限公司自建数据库MS/MS进行处理。差异代谢产物分析采用主成分分析法和正交偏最小二乘判别分析法。
1.4.2 多元统计分析 主成分分析 PCA是一种统计过程,可将成千上万个相关代谢物变量转换为一组线性不相关变量的值,这些变量称为主成分,采用R软件包(http://www.r-project.org/)对两组样本进行无监督降维方法主成分分析,可对样本进行初步的可视化分析。
由于 PCA是一种缺乏监督的分组方法。用该方法分组时,当组内样品间的差异大于组间的差异时,该方法就显得不够清晰[17]。OPLS-DA是PLS-DA的扩展,它在PLS中包含了正交信号校正(OSC)滤波器模型。OPLS的基本概念是将X的系统变化分为两部分,一是与Y相关,另一种与Y不相关(正交)。仅Y预测变化用于对数据建模。同样使用 R软件包(http://www.r-project.org/)对两组样本比较。OPLS-DA模型已通过200次排列检验[18]。一般以Q2作为预测模型是否可接受的参数;当Q2>0.4时,认为预测模型可接受;当Q2>0.9时,则认为是好的预测模型。
OPLS-DA模型的投影(VIP)得分被用于区分两组的代谢物。VIP的阈值设置为1。此外,T检验还用作筛选差异代谢物的单变量分析。那些t检验的P<0.05且VIP≥1被认为是两处理之间的差异代谢产物组。
KEGG(Kyoto Encyclopedia of Genes and Genomes,京都基因和基因组百科全书)是一个重要的与代谢通路相关的数据库。它是将代谢物映射到KEGG代谢途径以进行途径分析和富集分析[19]。其计算公式如下:
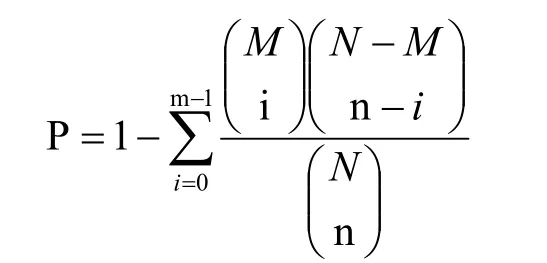
其中N是在KEGG可以注释的所有代谢物数量,n是N中不同代谢物数量,M是能够注释到特定途径的全部代谢物数量,m是M中不同代谢物的数量。P值通过错误发现率FDR矫正,以FDR≤0.05为阈值,满足该条件的途径被定义为差异代谢物中显著富集的通路。
2 结果与分析
2.1 质谱的稳定性
质量控制(QC)样品为混合来自所有样品的等份上清液制备获得。阴、阳离子条件下质控样本的峰强度以及保留时间基本重叠在一起,这表明试验过程误差较小,仪器的可靠性较高。
2.2 主成分分析(PCA)
为判别PA-2侵染后对藜叶片代谢物累积差异,首先选择主成分的方法进行分析。PCA分析表明(图1),在阳离子模式下(图1A),PC1(第一成分)为75.1%,PC2(第二成分)为7.4%,两个主要成分共解释了原始数据的82.5%;在阴离子的模式下(图1B),PC1(第一成分)为53%,PC2(第二成分)13.7%,两个主要成分共解释了原始数据的 66.7%。两种模式下,各点的分布表明对照组和处理组之间差异明显(P<0.01)。由图1可知,对照样品均位于PC1负半轴,处理组均位于PC1正半轴,二者被明显分开,说明两个藜叶片在代谢物组成上有明显不同。
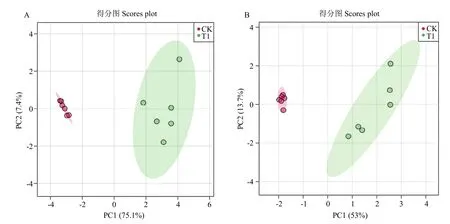
图1 PA-2侵染下差异代谢产物的PCA分析Fig.1 Score plots of two-dimensional PCA analysis of different metabolites under PA-2 infection
2.3 正交偏最小二乘法分析(OPLS-DA)模型的分析结果
2.3.1 OPLS-DA分析 在阳离子条件下R2X=0.597,R2Y=0.99,Q2=0.869,这些数据表明用59.7%变量可以解释99.0%的组间差异,具有86.9%的预测能力;在阴离子条件下R2X=0.516,R2Y=0.979,Q2=0.887,表明用51.6%变量可以解释97.9%的组间差异,具有88.7%的预测能力,无论阳、阴离子均具有较高的解释率以及预测能力,说明本研究中所建立的OPLS-DA模型预测能力较强[20],能够有效解释两个样品间的代谢差异(图2)。
2.3.2 OPLS-DA模型的置换验证 对OPLS-DA模型的置换检验结果如图2所示,Q2Y以及R2Y都没有超过所对应的临界线,说明OPLS-DA模型不存在过拟合现象,模型稳定性较好,达到了优秀的模型标准,可以较好地解释两组样本之间的差异。
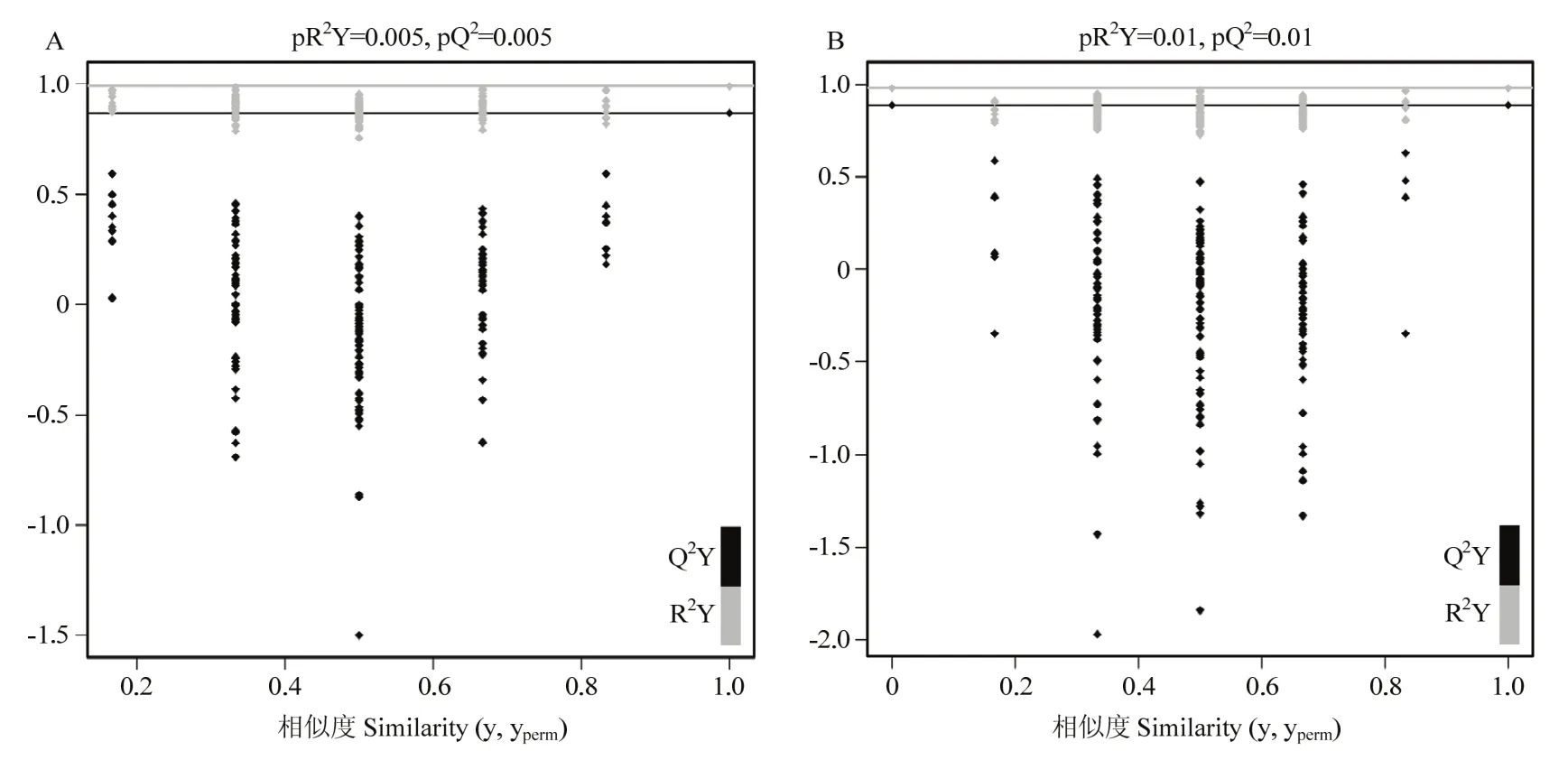
图2 阳、阴离子条件下的OPLS-DA模型置换检验结果Fig.2 The result of OPLS-DA model permutation test under cation and anion conditions
2.4 两组样本间差异代谢物的确定
Loading-plot图中距离中心点越远的点显示了造成对照组和处理组的最大差异代谢产物。图3所示,在阳离子条件下总共有9个差异化合物,其中5个未得到注释,其余4个分别为奈替米星(Netilmicin,POS00403)、腺苷(Adenosine,POS00030)、腺嘌呤(Adenine,POS00001)、甜菜碱(Betaine,POS00005);而在阴离子条件下总共有 12个差异化合物,其中 7个未得到注释,其余5个分别为甘露醇(Mannitol,NEG00028)、焦谷氨酸(Pyroglutamic acid,NEG00008)、葡萄糖内酯(Gluconolactone,NEG00118)、异尿苷(Idoxuridine,NEG08115)、腺嘌呤(Adenine,NEG00009)。
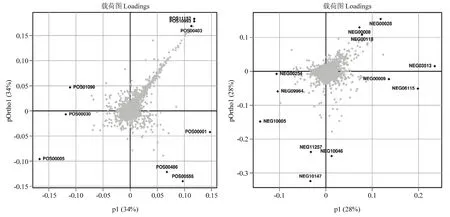
图3 阳、阴离子条件下Loading-plot图Fig.3 Loading-plot graph under cation and anion conditions
以OPLS-DA模型的VIP得分(VIP≥1),并结合t检验(t-test)的结果P值(P<0.05)来寻找两组样本间的差异性代谢物。在阳、阴离子条件下差异代谢物分别为998和894个,其中在阳离子条件下上调代谢物有800个,而下调代谢物有198个;在阴离子条件下上调代谢物有669个,下调的代谢物有225个。两组样品共筛选出185种差异代谢产物,其中明确的代谢物有30种(阳离子模式下有13种,阴离子模式下有21种,其中4种为二者共有)(表1)。由表1可以看出,与对照组相比,处理组的大部分差异代谢物都上调(Log2>0),其中Log2变化倍数大于5.0的有利比妥(Ribitol)、橙皮素(Hesperetin)、次黄嘌呤(Hypoxanthine)、牛磺脱氧胆酸(Taurodeoxycholic acid)、L-酪氨酸(L-Tyrosine),其中次黄嘌呤(Hypoxanthine)和L-酪氨酸(L-Tyrosine)的Log2变化倍数达到24.59和24.99;只有2种代谢物出现下调(Log2<0),分别为 D-谷氨酰胺(D-Glutamine)和 L-谷氨酰胺(L-Glutamine),下调倍数不大。
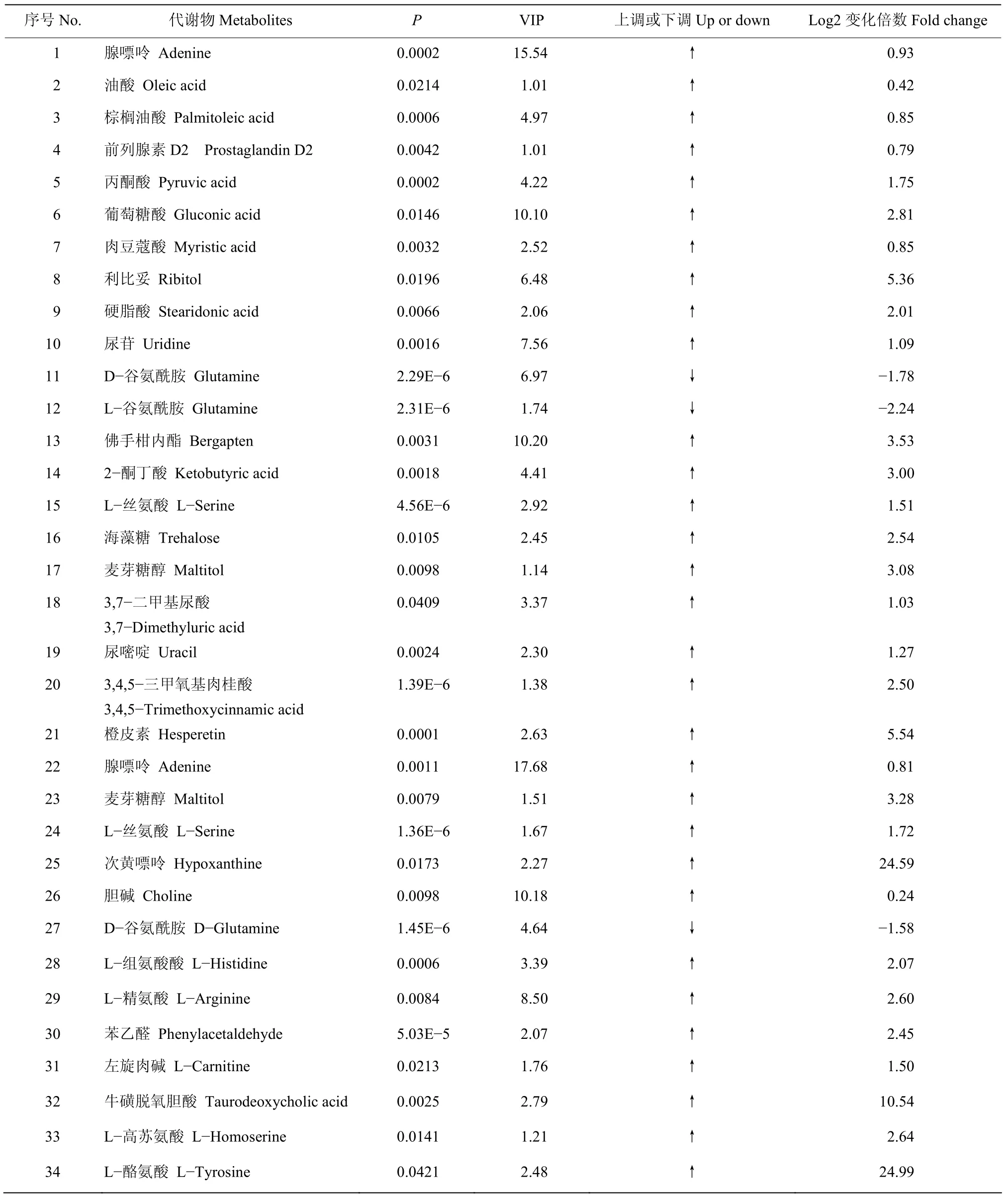
表1 在阳离子和阴离子条件下识别代谢物的倍数变化Table 1 Fold changes of metabolites recognized under cationic and anionic conditions
2.5 差异性代谢产物通路分析
对出芽短梗霉菌PA-2侵染的藜叶片和对照组所鉴定到的差异代谢物进行KEGG代谢通路的富集分析结果如图4所示。差异代谢产物共注释到5条主要的通路,分别为代谢过程、遗传信息过程、环境信息过程、细胞过程、人类疾病;其中代谢过程为差异代谢产物注释的主要通路,它里面富集前三的代谢过程分别为全局和概述地图、氨基酸代谢、碳水化合物代谢,能够注释到这3个差异代谢物分别为126(33.5%)、35(9.3%)和34(9.0%)种。如表2所示,全局和概述地图内以嘌呤代谢、次生代谢产物的生物合成及代谢途径为主要的差异代谢物注释途径;氨基酸代谢途径内变化倍数较大的氨基酸分别为 L-酪氨酸、琥珀酸半醛、酮亮氨酸;碳水化合物代谢途径内变化倍数较大物质有甘露醇、利比妥、myo-肌醇。
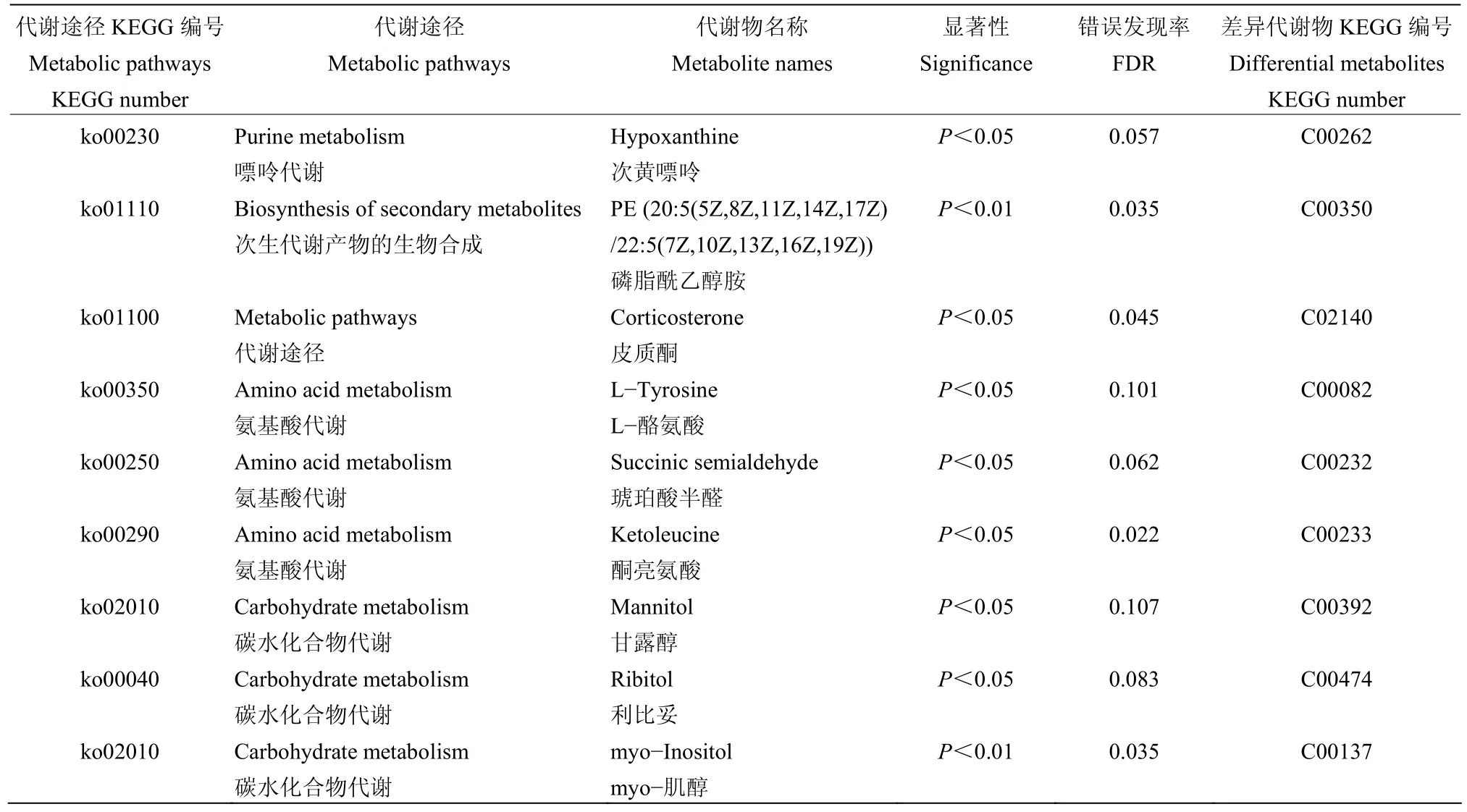
表2 差异代谢物参与的代谢途径明细Table 2 List of metabolic pathways involved in different metabolites
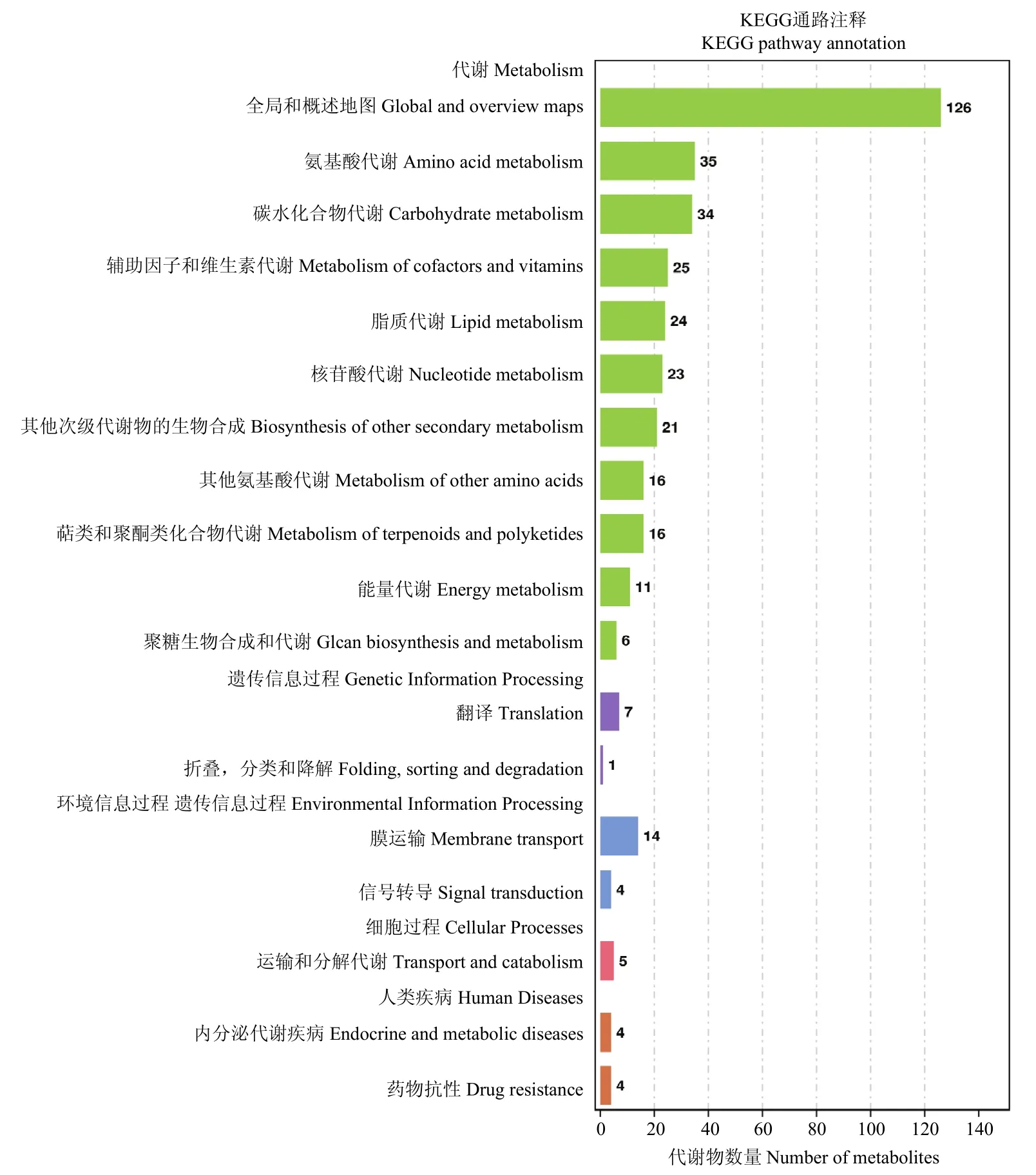
图4 差异代谢物KEGG注释通路图Fig.4 Differential metabolite KEGG annotation pathway diagram
2.6 不同代谢通路两组样本的代谢差异
2.6.1 两组样本全局和概述地图内的代谢产物变化 如表3所示,PA-2侵染下两组样本在全局和概述地图内以嘌呤代谢中的次黄嘌呤(Hypoxanthine)、次生代谢产物中的PE [20:5(5Z,8Z,11Z,14Z,17Z)/22:5(7Z,10Z,13Z,16Z,19Z)]、代谢途径中的皮质酮(Corticosterone)等物质的Log2差异倍数变化最大,分别达到了24.6、5.78和5.35倍,且三者与对照相比差异显著(P<0.05)。大部分差异代谢物上调,只有少部分下调。这些下调的差异代谢物多与细胞内的膜结构相关,如PC [18:3(6Z,9Z,12Z)/18:1(11Z)]下调1.23倍,PC [20:2(11Z,14Z)/14:0]下调1.49倍,PC [20:3(8Z,11Z,14Z)/14:0]下调0.66倍,PE [16:0/18:2(9Z,12Z)]下调0.56倍。这些结果说明,PA-2侵染后可能干扰嘌呤代谢和生物膜结构。
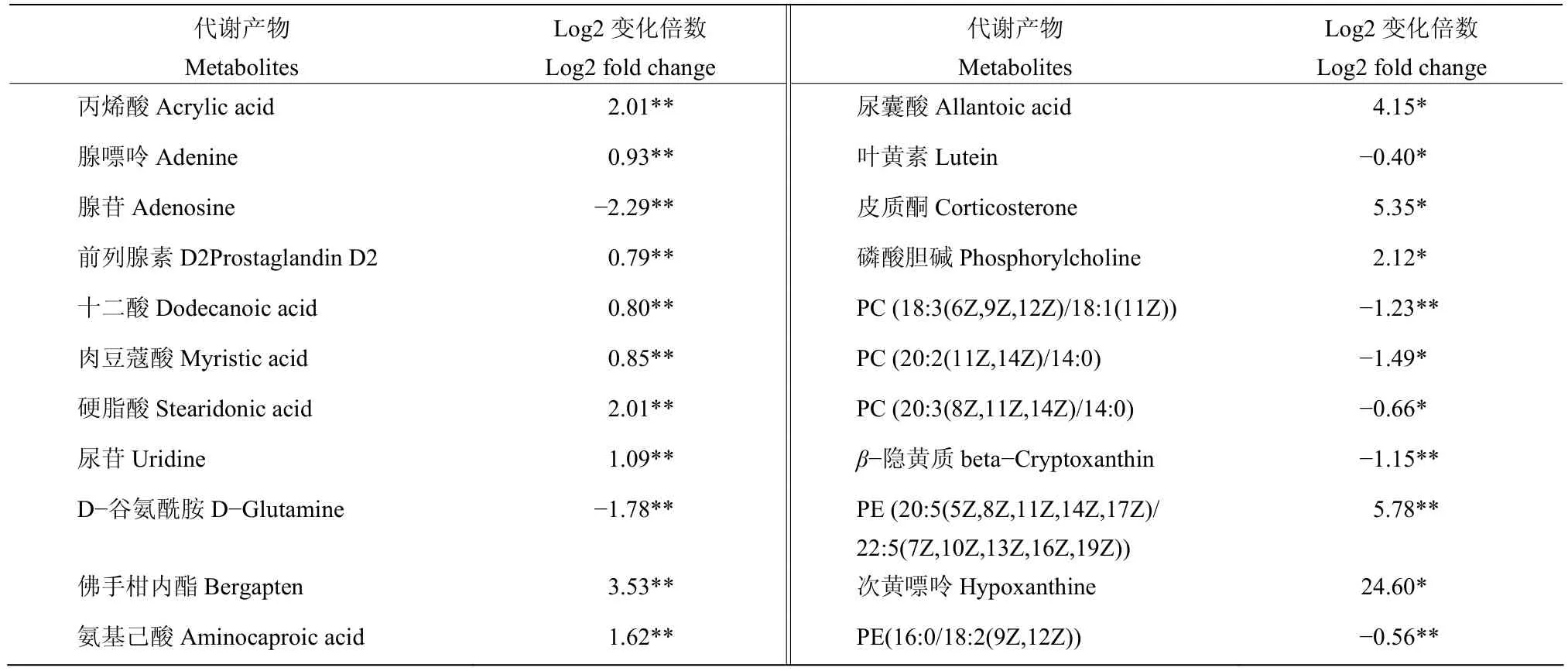
表3 两组样本全局和概述地图产物变化倍数Table 3 The fold change of global and overview maps of the two samples
2.6.2 两组样本氨基酸代谢产物变化 由表4可知,在PA-2侵染下,藜叶片在阴、阳离子模式下共检测出29种差异的氨基酸代谢产物,其中4种氨基酸及其衍生物极显著下调,分别是谷氨酰胺、L-天冬氨酸、2-氨基丙烯酸、甜菜碱;大部分氨基酸都是显著上调,其中以L-酪氨酸、琥珀酸半醛、酮亮氨酸Log2变化倍数最大。这些结果说明,PA-2侵染后可能影响藜叶片内的氨基酸代谢。
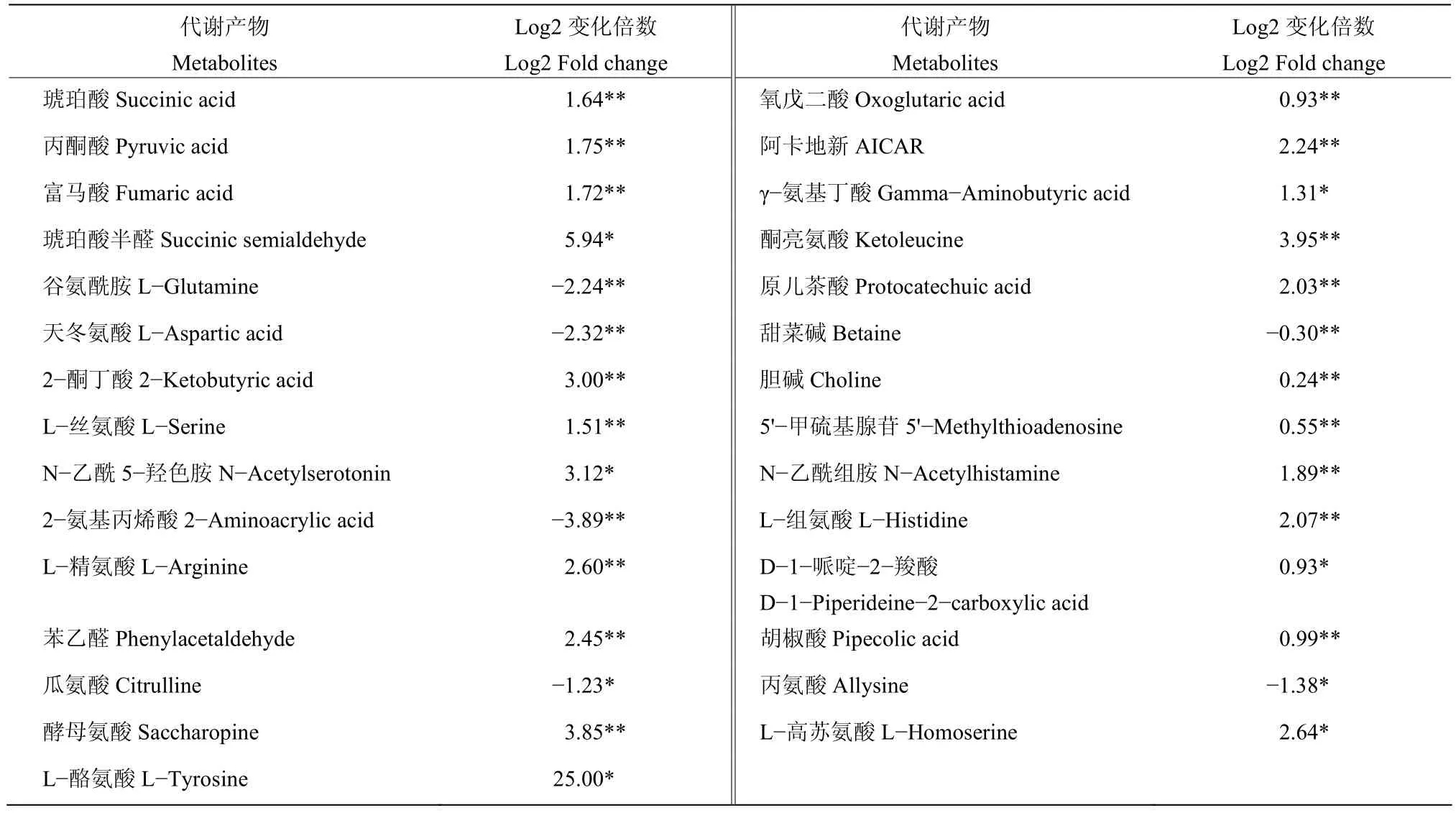
表4 两组样本氨基酸代谢产物的变化倍数Table 4 The fold change of amino acid metabolites of the two samples
2.6.3 两组样本碳水化合物代谢产物变化 由表5可知,PA-2侵染下,藜叶片大部分参与碳水化合物的产物都上调了,只有一种 L-谷氨酰胺极显著下调。这些显著上调的碳水化合物代谢产物中以甘露醇、利比妥、琥珀酸半醛3种Log2变化倍数大于5倍。这些结果表明,PA-2可能通过影响植物细胞的结构和能量代谢而使藜死亡。
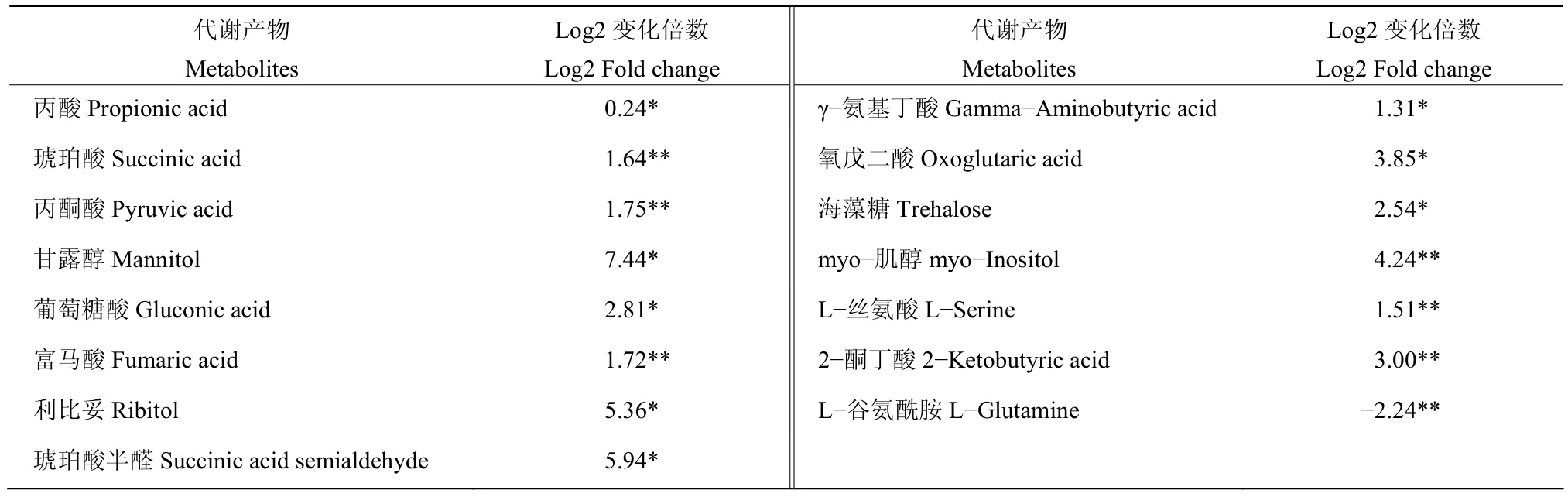
表5 两组样本碳水化合物代谢产物变化倍数Table 5 The fold change of carbohydrate metabolites of the two samples
3 讨论
代谢组学是一个连接基因、蛋白与表型的方法,这几年在医学领域的应用较为成功,这为其在农业各领域的研究提供了理论依据[21]。曾秘等[22]发现大部分真菌除草剂的有效成分为繁殖体,其代谢产物可以降低杂草生化和物理防御能力。嘌呤代谢是植物体内一个重要的中间代谢过程,它可以连接很多过程,像核苷酸代谢、能量代谢、叶酸合成、氨基酸代谢等。嘌呤代谢失衡会引起核酸合成受阻细胞分裂减慢、直接能源ATP供应不足、各种蛋白质合成受阻,这些因素都会引起细胞启动程序性死亡信号。本研究发现细胞膜的组成成分磷脂酰类物质在PA-2处理后急剧下调,这可能与该真菌破坏了藜细胞膜结构有关。这与罗淑芬等[23]通过对腺嘌呤衍生物——6-苄基腺嘌呤使莲蓬保持较高的 ATP能荷状态、防治活性氧积累,保护细胞膜结构的结论一致。研究表明叶酸参与植物叶绿素合成[24]。嘌呤代谢紊乱则会影响叶酸合成,进而影响叶绿素的生物合成,因此推测PA-2有些代谢物可能作用于叶绿体抑制光合色素合成和阻断能量传递过程。植物次级代谢产物包括萜类、酚类、含氮化合物等,它不是植物生长发育所必需的物质,但对植物的生长发育必不可少,它们具有保护生物膜、抗氧化、组成核酸及酶等重要的生理作用[25,26]。本试验发现PA-2侵染后,藜叶片次级代谢产物合成受到影响,可能使生物膜稳定性下降、氧毒性、核酸代谢及生化反应过程受阻等。
氨基酸是生物体内所有蛋白质的基本组成单位,自然界的氨基酸一般以L型存在,氨基酸代谢正常是植物完成其生命活动的保障[28]。本试验发现PA-2侵染下,藜叶片内多达29种的氨基酸代谢产物变化,这与李光锦在褐腐菌Moniliniafructicola侵染下中华寿桃Prunuspersica内差异蛋白质变化较多的结果一致[29]、也与肖龙等[30]研究轮纹病病原菌Botryosphaeriadothidea胁迫下苹果Malusdomestica差异蛋白达21个的结果相似。在植物中,酪氨酸通过莽草酸途径从头合成,同时也产生其他两个芳香族氨基酸-苯丙氨酸和色氨酸[31]。研究表明苯丙氨酸是植物苯丙烷类代谢途径的关键物质,与植物抗病具有重要相关性[32]。色氨酸代谢途径的下游次生代谢物不仅具有抗菌作用,而且与植物的防御反应密切相关[33]。本研究酪氨酸在处理组Log2显著上调25倍,可能引起苯丙氨酸和色氨酸减少,更利于PA-2侵染有关。最后,氨基酸代谢涉及植物体内多种代谢,它的紊乱又影响其他代谢,这些可能共同参与PA-2的侵染。
碳水化合物是植物经过光合作用产生的,它分为结构性碳水化合物(Structural carbohydrates)和非结构性碳水化合物(Non-structural carbohydrates),前者与植物能量供应有关,后者参与植物生存策略[34]。本试验中与能量代谢有关的碳水化合物都显著变化,这与张彩霞等[35]研究苹果在轮纹病侵入过程中,筛选的差异蛋白中有很多参与能量代谢的结果一致。综合上述,藜叶片内能量供应可能受到影响。而这些研究结果与赵丽娟等[27]在研究霜霉病菌对藜同科植物藜麦叶片代谢影响的研究结果一致,即霜霉病菌Peronosporafarinosaf.sp.chenopodii侵染引起藜科植物藜麦Chenopodiumquinoa叶片内糖代谢、核酸代谢、氨基酸代谢、三羧酸循环等代谢途径中的相关代谢物异常变化,进而影响藜麦生长。
甜菜碱(Betaine)属于生物碱类,它作为渗透保护物质与脯氨酸以及可溶性糖共同调节植物渗透[36,37]。甘露醇是由植物内甘露醇脱氢酶(MTD)限制的,而甘露醇也是一种抗逆物质,它在植物抗致病微生物发挥作用,同样它也和甜菜碱参与渗透调节。这两种物质作为标志性差异化合物都参与渗透调节。出芽短梗霉菌作为杀菌剂通过与病原菌竞争空间与养分达到杀菌作用[9-11]。甜菜碱和甘露醇在出芽短梗霉菌侵染下极显著上调可作为生物标志物,而这与赵丽娟等[27]研究霜霉病菌侵染下藜科植物藜麦叶片极显著上调物质为琥珀酸半醛、异亮氨酸、丝氨酸等结果相悖,推测可能因为二者研究选用筛选差异化合物的标准和模型不同。本研究中甜菜碱和甘露醇的标志性出现,推测PA-2也可能与植物细胞争夺养分而使藜过度失水而死亡。细胞生长无非与碳水化合物代谢、能量代谢、核苷酸代谢等行为相关,这3条途径是细胞生长的核心代谢途径[38]。本研究发现在PA-2侵染下,藜叶片内这3条代谢途径均被影响。尽管代谢组分析能够使我们全面了解出芽短梗霉菌侵染下藜叶片代谢物变化,但其也具有不少缺点,如生物标志物验证困难、对代谢物定性能力有限以及缺乏完整的解析代谢物生物学功能的数据库[21]。为了更好地了解出芽短梗霉菌PA-2对藜的生防机制,通过不同组学结果的联合分析,多组学间验证互补,将是下一步研究的重点。

