贝莱斯芽胞杆菌BP-1筛选、鉴定及其对花生网斑病的田间防效评价
臧超群,赵 颖,谢瑾卉,林 英,裴 雪,刘晓舟,梁春浩*
(1.辽宁省农业科学院植物保护研究所,沈阳 110161;2.辽宁省农业科学院植物营养与环境资源研究所,沈阳 110161)
花生ArachishypogaeaL.作为我国农业生产中最主要的经济作物和油料作物之一,具有悠久的栽培历史,在我国对外贸易中所占比重呈上升趋势[1]。辽宁花生向来以口感好、品质佳、且无黄曲霉毒素等诸多优点著称,在国内外市场上均有很高盛誉[2]。近年来,随着花生价格提高和供给侧结构调整,辽宁省花生种植面积逐年加大,成为继玉米和水稻之后的辽宁省第三大主栽作物[3]。花生网斑病是花生生产中最重要的叶部病害之一,可导致花生大量落叶,一般可造成减产10%~20%,重茬严重地块可达30%以上,不仅影响花生产量,而且对其品质也产生很大影响[4]。目前,在各花生主产区,主要依靠化学药剂防治该病害。长期使用化学农药引起的“3R”问题日益突出,利用生防菌制成的生防制剂,不仅能够防治植物病害,减少产量损失,还可减少化学农药的使用量及使用次数,对保护环境和食品安全意义重大。
目前,关于花生网斑病生物防治的相关报道较少,且研究不够深入。丛枝菌根(Arbuscular mycorrhiza,AM)真菌对花生网斑病具有一定的防控效果,而且能够促进花生生长,在盆栽条件下对花生接种AM真菌摩西球囊霉Glomusmosseae,对网斑病防治效果为10.2%[5]。丁子香酚、申嗪霉素对花生褐斑、黑斑、网斑病菌菌丝生长均有明显的抑制作用,其EC50值均小于1 mg/L,明显低于生产上常用化学药剂多菌灵的EC50值,具有防治花生叶斑病的潜力[6]。
本文采用稀释涂布平板法从健康的花生叶片上分离细菌、真菌、放线菌,利用平板对峙法筛选对花生网斑病菌具有较强抑制效果的菌株,并明确其抑菌谱;根据形态特征、生理生化反应以及16S rDNA序列分析,明确其分类地位;根据农药田间药效试验准则设计试验,评价其田间防治效果,研究结果为花生网斑病生防制剂的研制奠定理论基础。
1 材料与方法
1.1 试验材料
供试花生叶片:从阜新、沈阳、锦州等辽宁花生主产区采集到健康叶片60份。
供试菌株:辣椒疫霉Phytophthoracapsici、致病疫霉Phytophthorainfestans、灰葡萄孢Botrytiscinerea、尖孢镰刀菌Fusariumoxysporum、圆刺盘孢Colletotrichumorbiculare、粉红单端孢Trichotheciumroseurn、贝林格葡萄座腔菌Botryosphaeriaberengeriana、高粱弯孢菌Curvulariacaryopsida、禾谷镰孢菌Fusarium graminearum、大斑突脐蠕孢Exserohilumturcicum和落花生尾孢Cercosporaarachidicola均由辽宁省农业科学院植物保护研究所提供。
营养琼脂培养基(NA):蛋白胨10 g/L,牛肉膏3 g/L,氯化钠5 g/L,琼脂15 g/L,pH 7.2;孟加拉红培养基:蛋白胨5.0 g/L,葡萄糖10.0 g/L,磷酸二氢钾1.0 g/L,硫酸镁0.5 g/L,孟加拉红0.033 g/L,氯霉素0.1 g/L,琼脂15.0 g/L;高氏Ⅰ号培养基:K2HPO40.5 g/L,MgSO4·7H2O 0.5 g/L,KNO31.0 g/L,NaCl 0.5 g/L,FeSO4·7H2O 0.01 g/L,可溶性淀粉20.0 g/L,琼脂粉15.0 g/L,pH 7.2~7.4;马铃薯葡萄糖琼脂培养基(PDA):马铃薯200 g/L,葡萄糖20 g/L,琼脂粉 15 g/L。
供试药剂:430 g/L戊唑醇悬浮剂,拜耳作物科学(中国)有限公司生产。
1.2 花生叶片微生物的分离与纯化
微生物分离方法[7,8]:将采集的花生健康叶片用无菌水洗净后,剪成2~3 cm 的小块,无菌水漂洗3 次,置于烧杯中,分别加入200 mL 生理盐水和0.25 mL吐温-80,130 r/min振荡培养30 min。取冲洗液1 mL,均匀涂布于NA 培养基、孟加拉红培养基、高氏Ⅰ号培养基上,于27 ℃培养箱中倒置培养,待长出菌落后,挑取单菌落分离纯化保存。
1.3 花生网斑病生防菌筛选
采用对峙培养法[9]进行花生网斑病生防菌的筛选。将筛选获得的微生物菌株与花生网斑病菌进行对峙培养试验,先将病原菌转接到PDA培养基平板上,27 ℃培养6 d,用打孔器(Φ=6 mm)在病原菌边缘打取菌饼,用镊子夹取菌饼接在PDA培养基平板一侧,在距离菌饼3 cm处接种供试微生物菌株(细菌、放线菌划线接种;真菌放置菌饼),27 ℃培养5~7 d,测量微生物与网斑病菌之间抑菌带宽度,评价微生物对网斑病菌的抑制强弱,每个处理3次重复。
1.4 菌株BP-1鉴定
1.4.1 菌株BP-1形态及生理生化鉴定 将菌株BP-1在培养基NA上划线,27 ℃培养24 h,观察菌落形态,革兰氏染色、生理生化鉴定方法均参照文献[10]。
1.4.2 菌株BP-1 16S rDNA序列测定 参照文献方法[11]提取菌株BP-1基因组DNA,用细菌通用引物扩增 16S rDNA 序列。引物 27f(5′-AGAGTTTGATCMTGGCTCAG-3′)和 1492R(5′-TACGGCTACCTTA TCGTT ACGACTT-3′)。PCR 反应体系 25 μL:基因组 DNA 1 μL,引物 27f 0.5 μL,1492R 0.5 μL,10×PCR Buffer(Mg2+)2.5 μL,dNTP 1 μL,Taq酶 0.5 μL,ddH2O 19 μL。反应条件:95 ℃预变性 5 min;95 ℃变性30 s,57 ℃退火45 s,72 ℃延伸90 s,35个循环;72 ℃延伸5 min。PCR 反应产物由生工生物工程(上海)股份有限公司测序。
1.5 菌株BP-1抑菌谱测定
方法同1.3,测定菌株BP-1对其他主要植物病原真菌的抑制活性。
1.6 菌株BP-1对花生网斑病的田间防治评价
1.6.1 菌株BP-1发酵原液制备 将保存的BP-1菌种接入NA培养基平板上,28 ℃下恒温活化培养48 h。将活化培养的菌株BP-1(1×109cfu/mL)1 mL接种到装有90 mL NA培养液的250 mL三角瓶中振荡(28 ℃,180 r/min)培养96 h,得到菌株BP-1的发酵原液(浓度约1×109cfu/mL),备用。
1.6.2 菌株BP-1田间防效试验 试验选在辽宁省农业科学院花生试验田进行,花生品种为四粒红,行距0.5 m,穴距15 cm。试验按照农业部农药检定所田间试验准则设计[12],共6个处理(表 1)。每个小区20 m2,每个处理4 次重复,随机区组设计,采用喷雾法施药。7月16日(开花下针期)第一次施药,整个试验共施药3次,每次间隔7~10 d。试验期间花生只进行常规栽培管理,即正常的施肥、浇灌等,不喷施其他化学药剂。
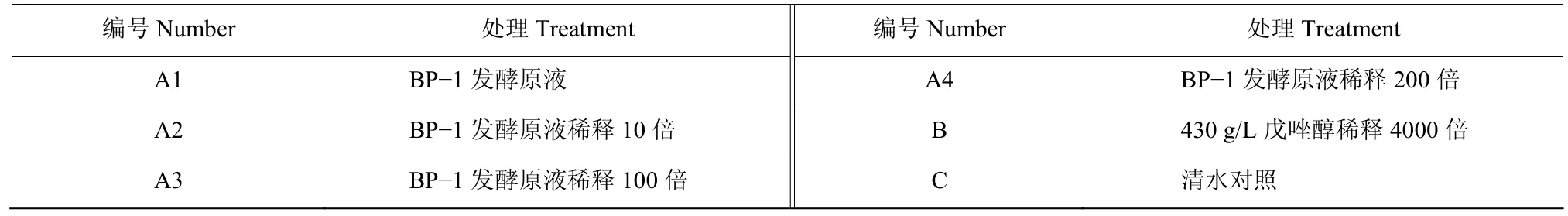
表1 试验处理Table 1 The experimental treatment
第3次施药后10 d调查各处理病情指数,采用5点取样法进行调查,每点调查5株,根据叶片分级标准记录发病情况,计算病情指数和防治效果。叶片分级方法参照吕宾等[13]:按照病斑面积占整个叶片面积的百分比分为5个等级,具体如下:0级,无病斑;1级,11 %以下的叶片发病;2级,11%~25%叶片发病;3级,26%~50%叶片发病;4级,50%以上的叶片发病。病情指数=∑(各级病叶数×相对级数值)/(调查总叶数×最高级数)×100,防治效果(%)=(对照病情指数-处理病情指数)/对照病情指数×100。
1.7 数据统计与分析
采用SPSS 24.0软件进行均值数据的One-way ANOVA差异显著性分析。
2 结果与分析
2.1 花生叶片微生物分离与拮抗菌株筛选
从花生叶片上分离得到微生物563株,其中细菌435株,真菌98株,放线菌30株。将这些微生物与花生网斑病菌进行对峙试验结果表明,26 株细菌、3株真菌,5株放线菌对花生网斑病菌具有不同程度的抑制作用。其中细菌菌株BP-1对花生网斑病菌抑制作用最强,抑菌带宽度达27.0 mm(表2、图1)。
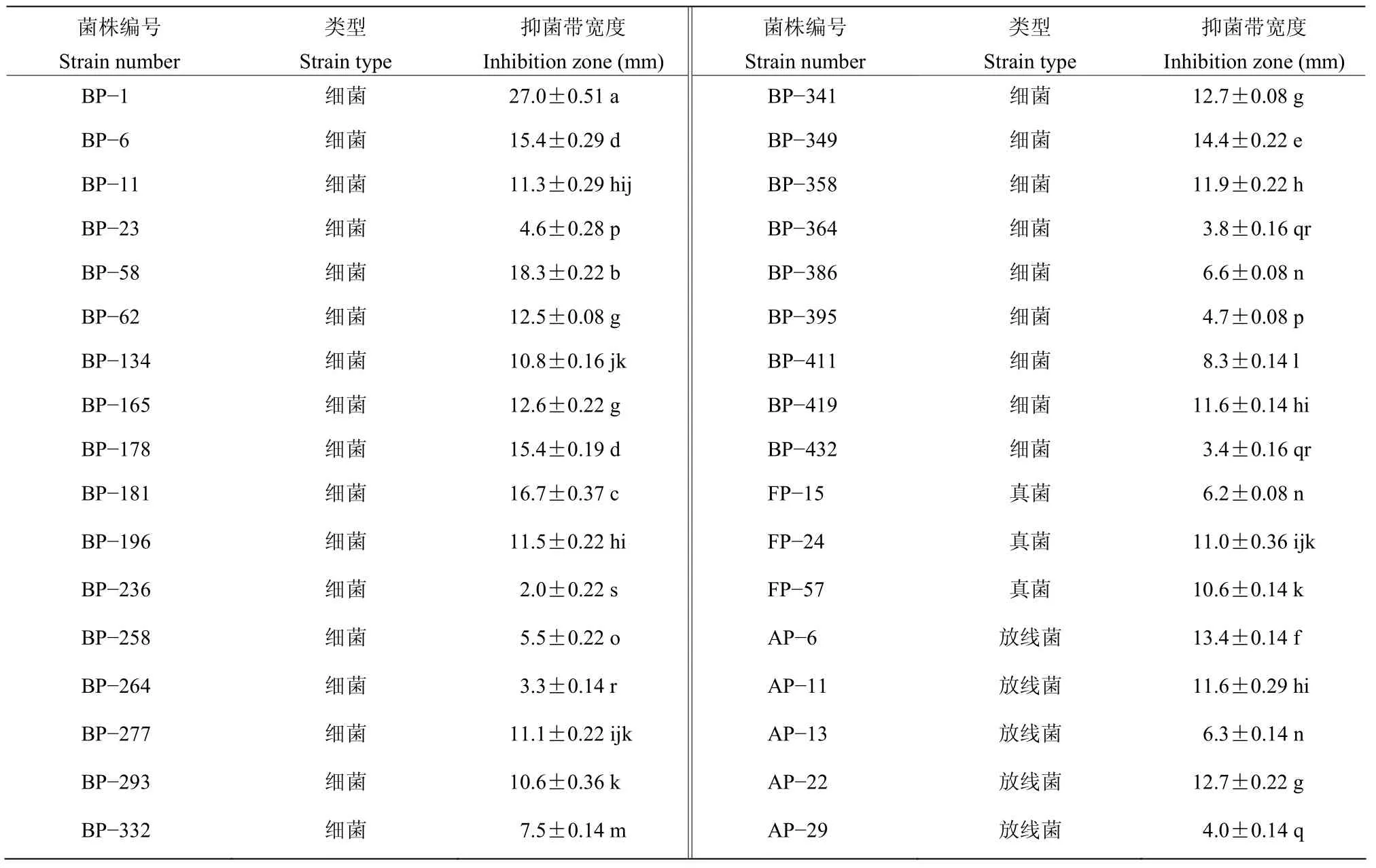
表2 不同微生物对花生网斑病菌的抑制作用Table 2 The inhibitory effect of different isolates on P.arachidicola
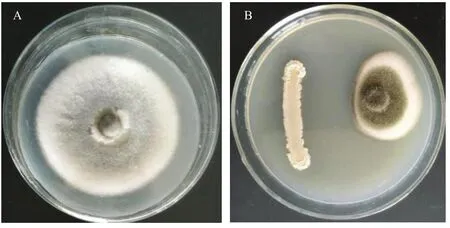
图1 菌株BP-1对花生网斑病菌的抑制作用(A:对照;B:处理)Fig.1 The control effect of strain BP-1 on P.arachidicola(A: CK; B: Treatment)
2.2 菌株BP-1抑菌谱测定
菌株BP-1对供试11种植物病原菌均有不同程度的抑制作用,抑菌带为5.6~22.8 mm,其中对辣椒疫霉病菌抑制活性最强,抑菌带宽达22.8 mm;对高粱弯孢菌的抑菌带最小,为5.6 mm(表3)。
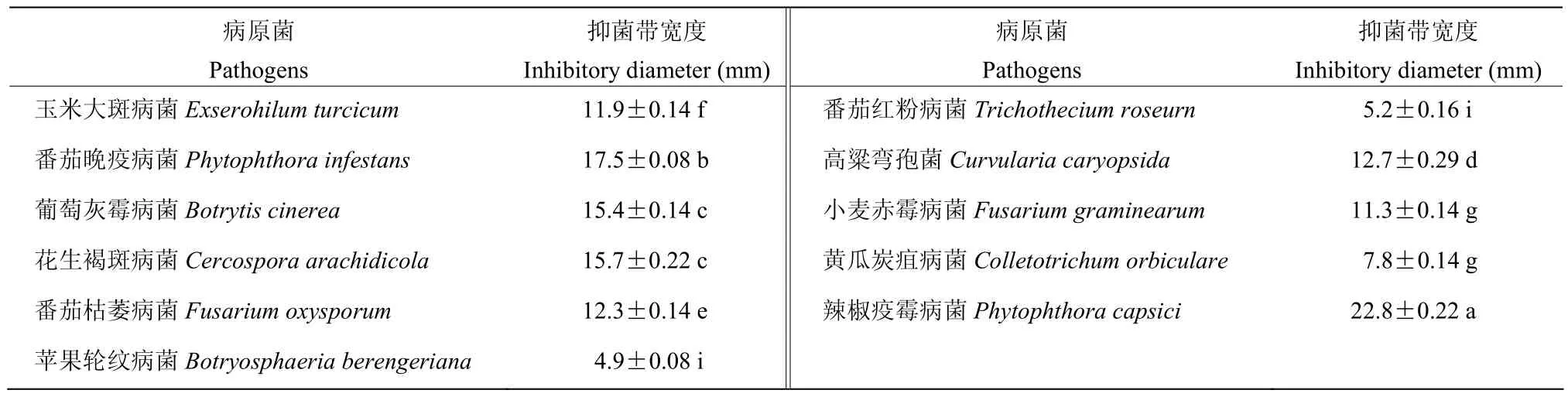
表3 菌株BP-1抑菌谱测定Table 3 Inhibitory spectrum of strain BP-1 against pathogens
2.3 菌株BP-1鉴定
2.3.1 形态和生理生化特征 菌株BP-1在NA培养基上27 ℃培养24 h,菌落扁平,表面光滑,呈杆状,无色,易挑起,不产色素,革兰氏反应阴性(图2)。生理生化特征测定结果为氧化酶反应、接触酶反应、葡萄糖氧化发酵、V-P试验、淀粉水解、明胶液化试验、七叶苷水解试验、硝酸盐还原、吲哚试验呈阳性,苯丙氨酸脱氢酶试验、甲基红(M.R.)试验、硫化氢产生试验呈阴性(表4)。
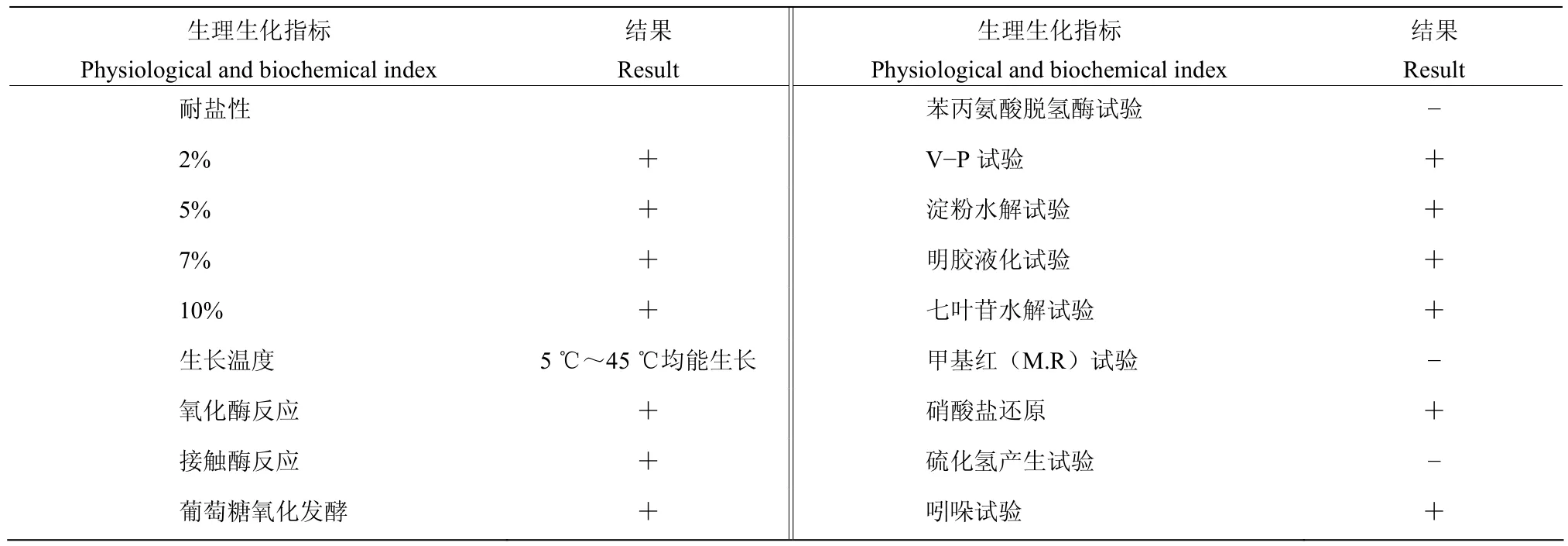
表4 菌株BP-1生理生化特征Table 4 The physiological and biochemical characteristics of strain BP-1
2.3.2 16S rDNA 序列分析 测序结果表明,菌株BP-1的16S rDNA长度为1424 bp,GenBank登录号为MW188646.1。在NCBI进行Blast同源序列分析,发现菌株BP-1与贝莱斯芽胞杆菌构成一个分支,相似度99%(图3)。综合形态和生理生化特征及16S rDNA基因序列,最终鉴定细菌BP-1为贝莱斯芽胞杆菌Bacillusvelezensis。
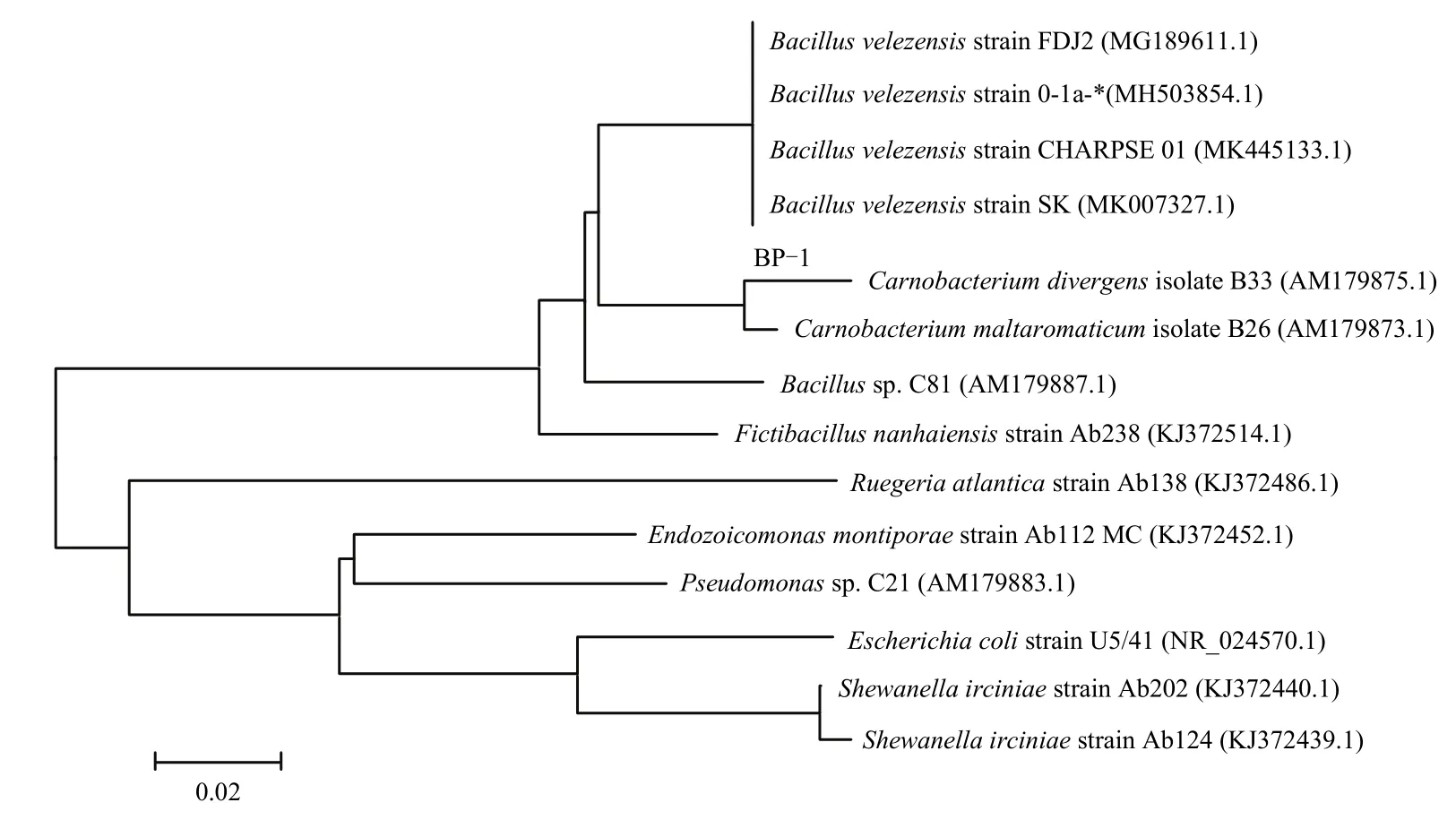
图3 菌株BP-1 16S rDNA序列系统发育树Fig.3 The phylogenetic tree of strain BP-1 16S rDNA sequence
2.4 菌株BP-1田间防效评价
菌株BP-1发酵原液对花生网斑病具有较好防治效果,其防效与430 g/L戊唑醇4000倍液差异不显著。菌株BP-1发酵原液稀释200倍后,对花生网斑病的防治效果为60.65%(表5)。
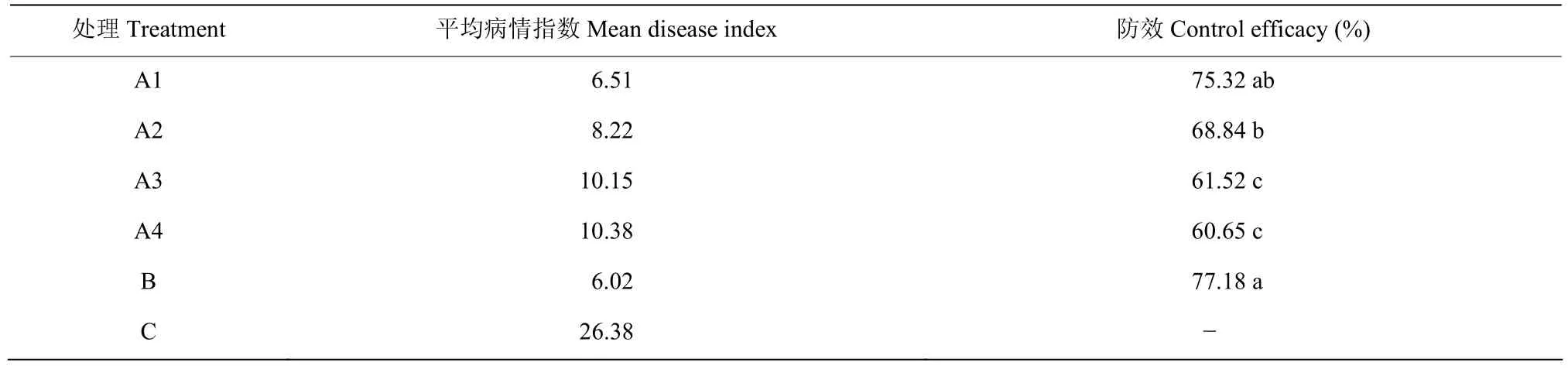
表5 菌株BP-1对花生网斑病田间防治效果Table 5 The control effect of stain BP-1 against P.arachidicola in field
3 讨论
贝莱斯芽胞杆菌为芽胞杆菌属,由Ruiz-García等[14]于2005年在西班牙南部马赫拉加首次发现,2008年 Wang等[15]确定该菌为解淀粉芽胞杆菌的后期异型体,中文名为贝莱斯芽胞杆菌[16]。本研究中的菌株BP-1是从健康花生叶片上分离、筛选获得一株对花生网斑病菌具有较强抑制活性的贝莱斯芽胞杆菌。其作为一种新型生防菌株,已开展了大量研究。
贝莱斯芽胞杆菌AH2对疫霉属Phytophthoraspp.、腐霉属Pythiumspp.、丝核菌属Rhizoctoniaspp.、黑腐菌属Thielaviopsisspp.等多种植物病原菌具有较强抑制作用[17],贝莱斯芽胞杆菌L-1对梨灰霉和青霉病菌的活体抑制率分别为92.88%和77.47%,能引起病原菌菌丝膨大、畸形,并证实其含有合成surfactin、fengycin、bacillibactin、bacillaene、macolactin、difficidin、bacilysin等多种肽聚糖和聚酮糖类抗性化合物的基因簇,以及能够降解病原菌细胞壁的β-1, 3-葡聚糖酶和几丁质酶相关的基因[18]。
贝莱斯芽胞杆菌的生防作用主要通过自身代谢产生抗生素和其他抗菌活性物质、铁离子螯合载体竞争铁离子、促生长物质以及诱导植物产生系统抗性(ISR)来控制病虫害[19]。贝莱斯芽胞杆菌在代谢过程中能够产生 iturin、fengycin、surfactin等环脂肽物质,这些活性物质可以激发植物的系统诱导抗性[20,21],Kurosawa等[22]证实,拟南芥经iturin处理后,诱导了其系统抗性基因的表达,从而增强了抗病性。贝莱斯芽胞杆菌基因组中存在合成铁离子螯合载体的基因簇,可以分泌铁离子螯合载体,从而与病原微生物竞争铁离子,引起病原物的“铁饥饿”,从而抑制病原微生物生长和发育[23-25];贝莱斯芽胞杆菌 BAC03代谢过程中能够产生吲哚-3-乙酸(IAA)和氨,且具有1-氨基环丙烷-1-羧酸脱氨酶(ACCD)活性,这些活性物质与促进植物生长密切相关[26]。
本研究中的贝莱斯芽胞杆菌BP-1不仅在对峙试验中对花生网斑病菌表现出较强抑制活性,其制成的发酵液稀释200倍后对花生网斑病的防治效果可达60.65%,可见贝莱斯芽胞杆菌BP-1对防治花生网斑病具有巨大的生防潜力,关于该菌的抑菌机制以及剂型研制还需进一步研究。

