飞蝗脂肪酸去饱和酶家族基因表达及功能分析
杨洋,张建珍,赵小明*
(1.山西大学 应用生物学研究所,山西 太原 030006;2.山西大学 生命科学学院,山西 太原 030006)
0 引言
昆虫是无脊椎动物中种类最大、数量最多的类群,其表皮具有天然屏障的功能能够使虫体适应不同的环境条件[1]。昆虫表皮脂类的结构和含量是决定其在干燥高温等逆境环境中能否生存的主要因素。此外,作为昆虫表皮重要成分之一,脂类物质在避免昆虫体内水分蒸发、防止外源物质渗入和信息素合成等方面具有重要作用。然而,目前关于昆虫表皮脂类合成机制尚不清楚。
昆虫表皮的主要化学组分是几丁质和蛋白质,此外,还有酚类和脂类等化学物质。昆虫表皮的脂类主要存在于上表皮中,是由真皮细胞、脂肪体和绛色细胞等参与合成的,合成的原料一部分来自食物中的脂肪酸。脂肪酸的合成在细胞质中发生,从线粒体运出的乙酰CoA开始,在乙酰CoA羧化酶(Acetyl-CoA-Carboxylase,ACC)的作用下,合成丙二酰CoA[2]。之后,在脂肪酸合成酶(Fatty acid sythetase,FAS)等作用下,在NADPH酶存在下催化丙二酰CoA转化为棕榈酸酯,随后在脂肪酸延长酶(Elongases,Elo)和去饱和酶(Desaturases,desat)的催化作用下,合成长链乙酰辅酶A硫酯[3]。Desat在脂肪酸合成过程中起着十分重要的作用,其几乎存在于所有生物中如藻类、真菌、植物和动物,且种类众多,能够催化脂酰辅酶A双键的形成[4]。根据desat作用底物的不同,可以将其可分为2类:可溶性的酰基-酰基载体(Acyl-ACP)蛋白和膜结合蛋白[5],然而目前在昆虫中关于desats的研究大多集中于信息素合成中的作用。
本文以飞蝗(Locusta migratoria)为研究对象,基于已报道的飞蝗转录组数据库和基因组序列,搜索获得飞蝗desat家族基因cDNA序列,并对其特征进行分析;通过荧光定量PCR技术检测Lmdesats家族基因在五龄期飞蝗的时空表达模式;最后基于RNA干扰(RNA interference,RNAi)技术分析Lmdesats家族基因的生物学功能,为基于表皮脂类合成关键基因的害虫防治靶标的筛选提供理论依据。
1 材料与方法
1.1 供试昆虫
试验虫卵保存于本实验室昆虫饲养室,在人工气候箱孵化后转移至洁净的纱笼中(30 cm×30 cm×30 cm),在光周期为14L:10D,湿度为(40±10)%,温度为(30±2)℃的条件下,以新鲜小麦幼苗和麦麸进行饲喂,待长至五龄进行不同组织、不同发育天数取材以及RNA干扰实验。
1.2 供试药品
RNA提取试剂(RNAiso Plus)、反转录试剂盒、荧光定量试剂等购于大连宝生物公司(TaKaRa);双链RNA合成试剂盒购于Promega公司;胶回收试剂盒和Taq酶等购于天根公司(TIANGEN)。
1.3 实验方法
1.3.1 飞蝗Desat家族基因cDNA序列获得
基于飞蝗转录组数据库,搜索获得3个Desats基因cDNA序列。结合飞蝗基因组数据库[6],将获得的Lmdesats基因cDNA序列与基因组序列进行比对(http://www.locustmine.org/viroblast/viroblast.php),分析Lmdesats基因的内含子和外显子序列,并将其分别命名为Lmdesat1,Lmdesat2和Lmdesat3。通过SMART网站分析Lmdesats编码蛋白结构域以及ExPASy网站进行分子量与等电点预测,利用GENEDOC软件与其它物种Desats进行氨基酸多序列比对,最后利用TMHMM软件分析其跨膜域。
1.3.2 Desats聚类分析
将Lmdesat1、Lmdesat2和Lmdesat3序列分别在NCBI网站进行BLAST分析并下载黑腹果蝇(Drosophila melanogaster)、德国小蠊(Blattella germanica)、赤拟谷盗(Tribolium castaneum)、褐飞虱(Nilaparvata lugens)等不同昆虫物种Desats氨基酸序列。利用MEGA6.0软件中邻接法(neighborjoining,NJ)将Lmdesats氨基酸序列与其同源序列构建系统进化树,独立分析1 000次,数值代表bootstrap估算值。
1.3.3 总RNA提取及Desat家族基因表达特性检测
摘取发育整齐的五龄第6天飞蝗若虫不同组织部位,包括体壁(IN)、前肠(FG)、中肠(MG)、后肠(HG)、胃盲囊(GC)、马氏管(MT)、生殖腺(GD)、脂肪体(FB)和翅芽(WP),以及5龄每天(1-8天)翅芽或胃盲囊。利用RNA提取试剂提取不同组织和时期样品总RNA并进行定量(样品稀释成0.5 μg/μL),取1 μg总RNA按照反转录试剂盒说明书进行cDNA的合成并进行10倍稀释。利用Primer5.0软件设计Lmdesats基因和RPL32内参基因的特异性表达引物(见表1,生工公司合成),利用荧光定量PCR方法检测Lmdesats基因在不同组织和不同发育时期中的表达特性,荧光定量PCR反应体系及反应条件参考课题组方法进行[7]。每个不同组织部位或发育日龄均由3头试虫组成一个重复,共计4个重复。以RPL32作为内参基因,Lmdesats基因在不同组织部位或发育日龄的相对表达量采用2-ΔΔCt法进行分析。

表1 Lmdesats研究中使用的引物Table 1 Primers ofLmdesatsused in this study
1.3.4 基于RNAi的生物学功能分析
根据Lmdesat1,Lmdesat2和Lmdesat3基因序列设计并合成含有T7启动子序列(表1中横线部分)的RNAi引物(表1,生工公司合成),以5龄飞蝗cDNA为模板进行PCR扩增,扩增产物进行凝胶电泳检测并利用胶回收试剂盒回收目的条带。以1 μg回收产物作为模板,利用dsRNA合成试剂盒分别合成Lmdesat1,Lmdesat2和Lmdesat3基因dsRNA,同时合成绿色荧光蛋白基因(GFP)dsRNA作为对照,然后将合成的dsRNA定量并稀释为2 μg/μL,电泳检测其完整度。选取4龄第2天飞蝗若虫(共28头试虫,雌雄各半)用微量注射器将LmdesatsdsRNA(dsLmdesat1,dsLmdesat2和dsLmdesat3)从飞蝗第2和3腹节连接处注入体腔,注射剂量为10 μg/头。注射等量的dsGFP作为对照(共28头试虫,雌雄各半),24 h后利用1.3.3中RNA提取和荧光定量PCR方法检测Lmdesats基因沉默效率(3头试虫组成一个生物学重复,共计4个生物学重复),余下飞蝗(对照组和处理组各16头)正常饲养用于表型观察。
1.3.5 数据分析
Lmdesats家族基因组织、时期和沉默效率的相对表达量均采用2-ΔΔCt法进行分析,采用统计学软件SPSS中Tukey’s HSD进行数据分析,P<0.05为差异显著,字母(a,b,c,d和e)代表差异显著性。采用Studentt-test方法进行差异表达分析,*P<0.05表示差异显著,**P<0.01表示差异极显著。
2 结果与分析
2.1 飞蝗Desat家族基因特性分析
基于飞蝗转录组数据库,搜索获得3条脂肪酸去饱和酶desat家族基因cDNA序列,分别命名为Lmdesat1,Lmdesat2和Lmdesat3,并上传 Genbank,其登录号分别为MN863500,MN863501和MN863502。结合基因组数据分析,Lmdesat1,Lmdesat2和Lmdesat3分别含有5个,6个和6个外显子(图1A),开放阅读框1242 bp,966 bp和1083 bp,编码413,321和361个氨基酸。预测Lmdesat1,Lmdesat2和Lmdesat3蛋白的分子量分别为46.7,37.4和40.3 kDa,等电点分别为6.34,9.03,9.22。与果蝇desat蛋白类似,Lmdesat1和Lmdesat3均含有FA_desaturase结构域,而Lmdesat2除了含有FA_desaturase结构域外,还具有一个lipid_DES结构域(图1B)。进一步分析发现,Lmdesat1,Lmdesat2和Lmdesat3蛋白与果蝇desat蛋白类似均具有4个跨膜结构域(图1C),属于膜结合蛋白类型的脂肪酸去饱和酶。
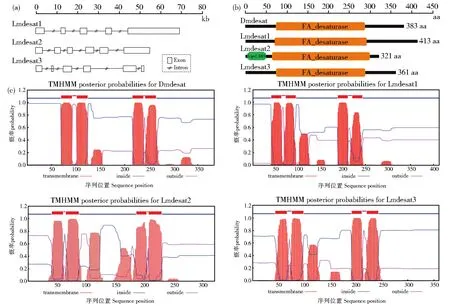
图1 飞蝗Lmdesats基因结构图、编码氨基酸结构及跨膜域分析。A.飞蝗Lmdesats基因结构图;B.飞蝗Lmdesats编码氨基酸结构;C.飞蝗Lmdesats跨膜域分析Fig.1 Genomic structure,coding amino acid structure and transmembrane domain analysis ofLmdesats A.The genomic structure ofLmdesats;B.the coding amino acid structure ofLmdesats;C.the transmembrane domain analysis ofLmdesats
2.2 飞蝗Desat家族蛋白聚类和序列比对分析
在NCBI进行BLAST分析并下载不同物种的同源desat氨基酸序列,进行聚类分析。结果显示Lmdesat1,Lmdesat2和Lmdesat3分别与delta-9,delta-4和delta-11类型的脂肪酸去饱和酶聚为一支,并且具有较高的同源性(图2)。利用Lmdesat1,Lmdesat2和Lmdesat3序列分别与果蝇、内华达古白蚁(Zootermopsis nevadensis)、德国小蠊、赤拟谷盗、褐飞虱的desat序列进行比对分析发现,Lmdesat1,Lmdesat2和Lmdesat3分别与delta-9,delta-4和delta-11类型的desat具有较高的相似性,其中Lmdesat2与 delta-4 类型的 Sphingolipid delta(4)-desaturase DES1同源性高达91%以上(图3)。
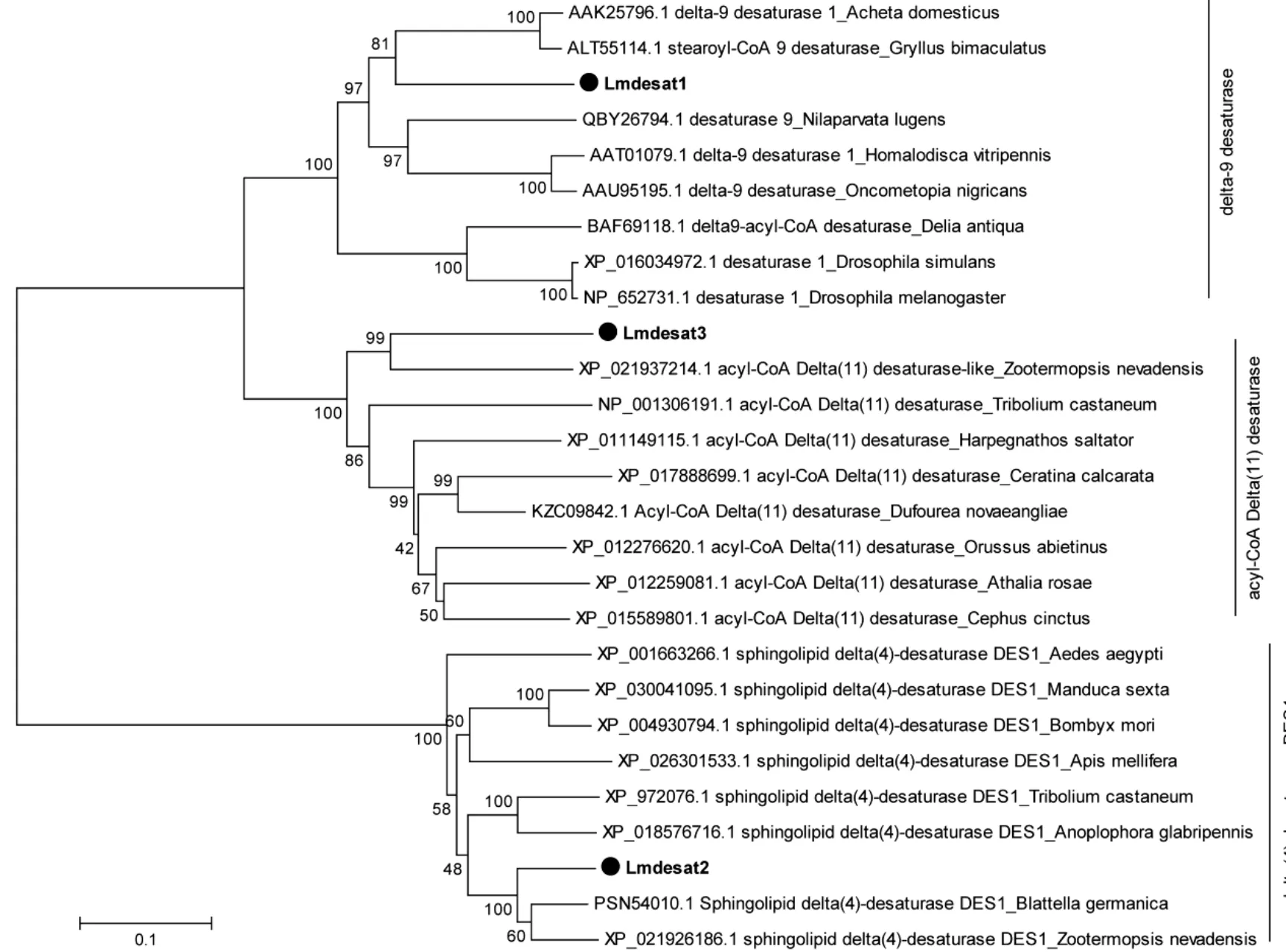
图2 Lmdesats与不同昆虫物种间desats的系统聚类分析Fig.2 Phylogenetic analysis ofLmdesatsand desats from different insect species
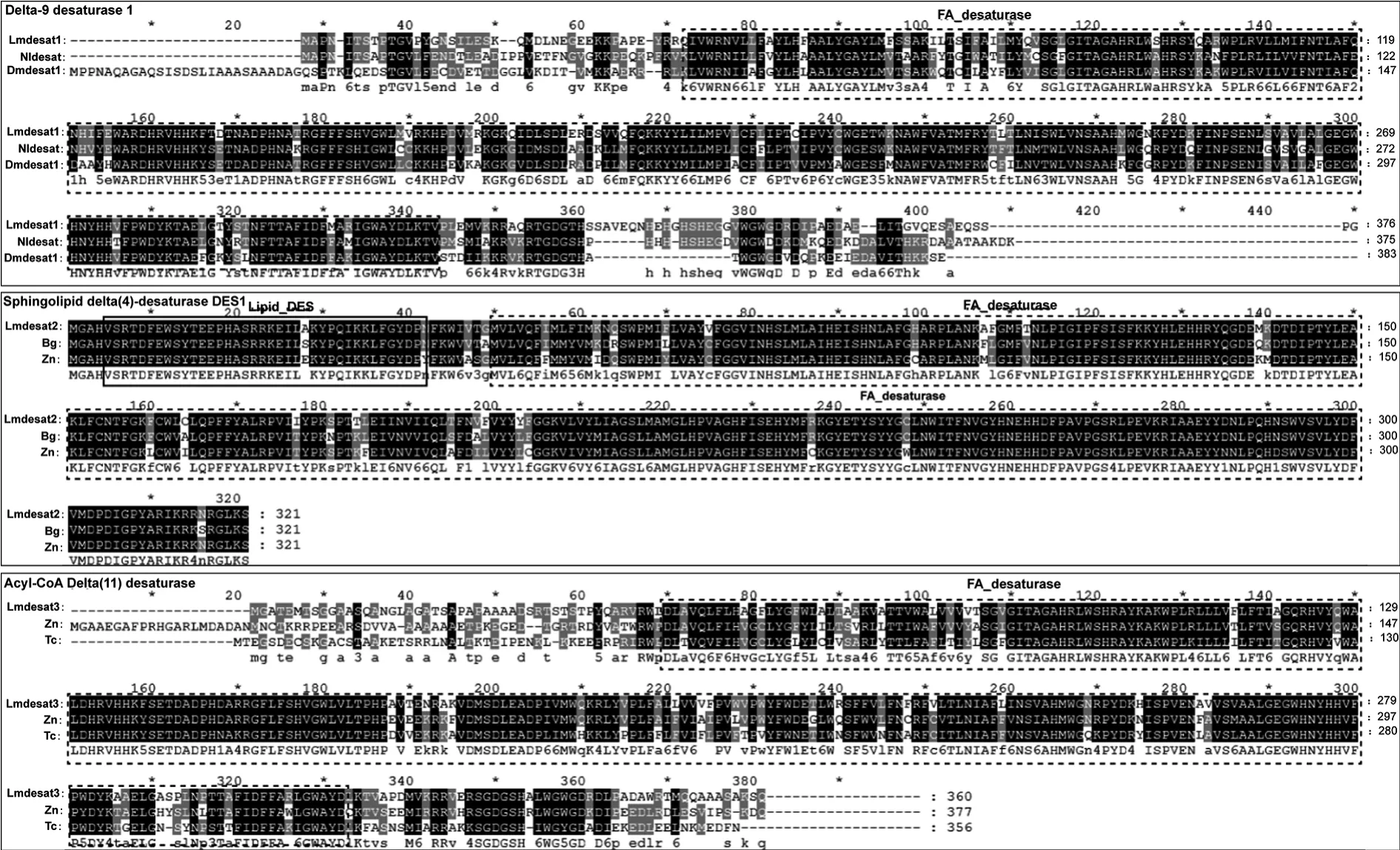
图3 Lmdesats与不同昆虫去饱和酶desats多序列比对Fig.3 Multiple sequence alignments ofLmdesatsand desats from different insect species
2.3 飞蝗Desat家族基因在5龄不同组织部位和不同发育天数的表达
为了探讨desats家族基因组织表达特性,根据已经得到的Lmdesats基因cDNA序列,合成特异性的表达引物,利用荧光定量PCR分析了Lmdesat1,Lmdesat2和Lmdesat3在5龄第6天飞蝗若虫的9个不同组织部位的表达。结果表明:Lmdesats组织表达具有多样性,在多个组织中均有表达,如体壁(IN)、中肠(MG)、后肠(HG)、脂肪体(FB)、胃盲囊(GC)、生殖腺(GD)、马氏管(MT)和翅芽(WP)(图4),其中Lmdesat1在胃盲囊、生殖腺和体壁中高表达(图4A),Lmdesat2在马氏管和翅芽中高表达(图4B),而Lmdesat3在胃盲囊、中肠、后肠和马氏管中高表达(图4C)。
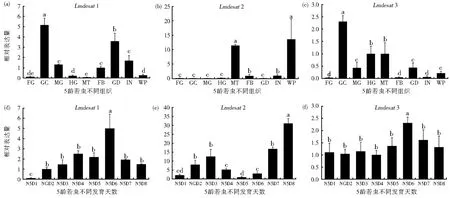
图4 荧光定量PCR检测Lmdesats基因在5龄若虫不同组织和不同发育天数的表达特性A-C.Lmdesats基因在5龄飞蝗不同组织部位的表达水平;D-F.Lmdesats基因在5龄飞蝗不同发育天数的表达水平Fig.4 Expression ofLmdesatsin different tissues and different days of the fifth instar nymphs ofL.migratoriaby qPCR analysisA-C.The mRNAlevel ofLmdesatsin different tissues of fifth instar nymphs ofL.migratoria;D-F.The mRNAlevel ofLmdesats in different days of fifth instar nymphs ofL.migratoria.
同样方法对这3个基因在5龄期若虫不同发育天数的表达进行了分析。结果显示:Lmdesat1和Lmdesat3在5龄第6天具有较高的表达而Lmdesat2在蜕皮前(第8天)高表达(图4D-F)。
2.4 飞蝗Desat家族基因的生物学功能分析
将合成的dsLmdesats注射至5龄第2天飞蝗若虫(10 μg每头虫),以注射等量的dsGFP为对照,正常饲养24 h后收集整虫提取总RNA,利用荧光定量PCR技术分别检测Lmdesat1,Lmdesat2和Lmdesat3基因的沉默效率。结果表明,与对照组相比,注射dsLmdesats组中Lmdesats的表达量显著降低,沉默效率均在50%以上(图5A,B和D)。表型观察显示,84.2%的注射dsLmdesat3的飞蝗无法蜕皮,在蜕皮前致死;42.8%的注射dsLmdesat1的飞蝗能够正常发育,但羽化为成虫后出现翅型紊乱的表型,而注射dsLmdesat2的飞蝗与对照组一样未能出现可见表型,均能正常蜕皮、羽化(图5C)。

图5 注射dsRNA后对Lmdesats基因表达及飞蝗发育的影响A:Lmdesat1沉默效率检测;B:Lmdesat2沉默效率检测;C:Lmdesat1和Lmdesat2沉默后的表型图;D:Lmdesat3沉默效率检测和沉默后的表型图Fig.5 Effects of dsLmdesatson the expression ofLmdesats and the development ofL.migratoria
3 讨论
脂类是昆虫表皮重要成分之一,其具有避免昆虫体内水分蒸发和防止外源物质渗入的作用[8]。除此之外,脂类在昆虫信息素合成、防御、生殖等方面同样具有重要作用[9]。近年来,随着分子生物学技术的发展,结合表皮形态学和蛋白分离等生物化学技术,国内外学者逐步开展了昆虫表皮脂代谢关键酶基因的鉴定和功能解析,如脂肪酸合成酶基因FAS[10-11],延伸酶基因 ELO[12-13],还原酶基因 FAR[15]以及参与碳氢化合物合成的细胞色素P450(CPY4G)等[14-18],然而昆虫脂肪酸去饱和酶desat研究报道较少。Desat根据其结构特性可分为可溶性酰基-酰基载体蛋白和膜结合蛋白,研究报道可溶性Desat蛋白大多分布于植物质体的基质中[5]。膜结合蛋白根据其作用底物不同可以分为酰基辅酶A去饱和酶、‘front-end’-酰基辅酶A去饱和酶和脂酰脂去饱和酶[4]。本文识别的3个飞蝗desat均含有脂肪酸去饱和酶结构域和4个跨膜结构域,属于膜结合蛋白类型的脂肪酸去饱和酶。
昆虫desat首先在果蝇被报道[19],随后发现该酶(Dmdesat1)具有Δ9功能特异性[20]。本文Lmdesat1与Dmdesat1聚为一支且具有较高相似性,同属于Δ9类型的脂肪酸去饱和酶,可能具有类似的功能。Bonsquet等[21]研究发现Dmdesat1主要表达于果蝇脂肪体和绛色细胞,除此之外,在前脑中部、malpighi小管、直肠乳突、生殖系统组织(包括精囊、附腺和卵巢)中具有一定量的表达,表现出组织表达多样性。Falcon等在意大利蜜蜂(Apis mellifera)表皮转录组中识别了6个在表皮中高表达的desat相关基因[22]。Badouin等在蚂蚁(Formica exsecta)转录组中发现了6个Δ9 desat,可能在蚂蚁间的信息交流中具有重要作用[23]。在家蚕(Bombyx mori)中鉴定到14个desats编码蛋白,研究发现家蚕desat1和desat5~8具有Δ11酶活性,而desat3和desat4具有Δ9活性[24]。Haritos等从赤拟谷盗基因组中鉴定出15个Tcdesats基因,其中有8个编码蛋白具有去饱和酶活性[4]。综上所述,昆虫desat家族蛋白在数量、类型和表达上均具有多样性,并且大多具有去饱和活性。本文根据飞蝗转录组数据库和基因组数据获得3个desat家族基因,分别属于Δ4,Δ9和Δ11类型的去饱和酶,可能具有不同的活性。Lmdesats组织和时期表达同样显示出多样性,暗示其可能具有不同的生物学功能。
在果蝇Dmdesat1突变体中,雌雄果蝇表皮不饱和烃含量显著降低[20],表明其在烃类合成中具有重要作用。除果蝇之外,目前关于昆虫desat的研究大多集中在信息素合成中的作用。如Albre等[25]从4种卷叶蛾(leafroller)中鉴定到6个desats去饱和酶,研究发现其中2个Δ9和1个Δ10去饱和酶参与信息素的合成。Hagstrom等[26]在斜纹卷蛾(Ctenopseustis obliquana)中鉴定出一种desat7去饱和酶,该酶仅对豆蔻酸的Δ5具有去饱和功能。此外,在鳞翅目昆虫玉米螟(Ostrinia)中,研究发现不同种间(亚洲玉米螟和欧洲玉米螟)的desat作用双键位置不同(Δ11或Δ14),使产生的信息素种类也不相同[27]。本文利用RNAi方法研究发现Lmdesat2不影响飞蝗的正常生长发育,Lmdesat1影响成虫翅的发育,而沉默Lmdesat3则影响若虫的发育且80%以上若虫致死,但其具体活性及作用机制有待于进一步研究。本文的实验结果为desats基因在昆虫脂类物种合成中的功能研究提供了基础,并为基于脂合成基因为靶标的害虫防治奠定理论依据。

