化浊解毒方对慢性萎缩性胃炎大鼠Hippo信号通路相关蛋白RASSF1A、SAV1、MST2表达的影响
郝新宇,王彦刚,田雪娇
化浊解毒方对慢性萎缩性胃炎大鼠Hippo信号通路相关蛋白RASSF1A、SAV1、MST2表达的影响
郝新宇1,王彦刚2,田雪娇2
1.河北中医学院,河北 石家庄 050200; 2.河北中医学院第一附属医院,河北 石家庄 050011
观察化浊解毒方对慢性萎缩性胃炎(CAG)大鼠Hippo信号通路哺乳动物不育系20样激酶2(MST2)、RAS相关区域家族亚型A(RASSF1A)、含WW结构域的人同源重组蛋白1(SAV1)表达的影响,探讨其可能的作用机制。采用联合造模法制备CAG大鼠模型,成模大鼠随机分为模型组、维酶素组和化浊解毒方高、中、低剂量组,每组10只,同时设正常组10只。正常组和模型组给予蒸馏水灌胃,维酶素组给予维酶素混悬液灌胃,化浊解毒方高、中、低剂量组给予相应剂量药液灌胃,连续12周。HE染色观察大鼠胃黏膜组织病理变化,RT-qPCR和Western blot分别检测大鼠胃黏膜组织RASSF1A、SAV1、MST2 mRNA和蛋白的表达。与正常组比较,模型组大鼠胃黏膜组织RASSF1A、SAV1、MST2 mRNA和蛋白表达明显降低(<0.05);与模型组比较,化浊解毒方高、中剂量组和维酶素组大鼠胃黏膜组织RASSF1A、SAV1、MST2 mRNA和蛋白表达均明显升高(<0.05),其中化浊解毒方高剂量组升高最明显。化浊解毒方具有干预CAG大鼠和延缓癌变进展的作用,其机制可能与上调模型大鼠抑癌基因RASSF1A、SAV1、MST2的表达相关。
化浊解毒方;慢性萎缩性胃炎;Hippo信号通路;RAS相关区域家族亚型A;含WW结构域的人同源重组蛋白1;哺乳动物不育系20样激酶2;大鼠
慢性萎缩性胃炎(chronic atrophic gastritis,CAG)是以胃黏膜固有腺体萎缩、数量减少、排列紊乱、黏膜层变薄为主要表现的一种慢性消化系统疾病,为胃癌前状态[1],其癌变率高,严重威胁人类健康。西医对本病尚无有效治疗方法,中医治疗本病积累了丰富的经验,疗效满意[2-4],但其作用机制尚未完全阐明。Hippo信号通路主要参与细胞在发育器官中的增殖、分化和迁移[5]。有报道,Hippo信号通路参与胃癌、食管鳞状细胞癌等多种肿瘤进展过程[6-7]。Hippo信号通路重要抑癌基因哺乳动物不育系20样激酶2(mammalian sterile 20-like kinase 2,MST2)、RAS相关区域家族亚型A(ras association domain family l A,RASSF1A)、含WW结构域的人同源重组蛋白1(salvador homolog 1,SAV1)等在癌细胞的生长增殖、转移中起着关键作用。本课题组前期研究均显示化浊解毒方是治疗CAG的有效方剂,同时发现其作用机制可能与Hippo信号通路有关[8-11]。本实验观察化浊解毒方对CAG大鼠Hippo信号通路相关蛋白RASSF1A、SAV1、MST2表达的影响,进一步探讨其可能的作用机制。
1 材料与方法
1.1 动物
70只SPF级雄性SD大鼠,体质量250~300 g,河北医科大学动物实验中心提供,动物许可证号SCXK(冀)2013-1-003。饲养于温度20~25 ℃、相对湿度40%~70%环境,光照12 h,自由摄食饮水。
1.2 药物及制备
化浊解毒方(茵陈15 g,黄芩12 g,黄连12 g,藿香9 g,佩兰9 g,白花蛇舌草15 g,半边莲15 g,半枝莲15 g,板蓝根15 g,苦参10 g,绞股蓝15 g),饮片由河北省中医院中药房提供,该院煎药室煎制,煎煮2次,各50 min,将2次煎液混匀浓缩为含原药材2.8、1.4、0.7 g/mL药液,4 ℃冰箱保存备用。甲基硝基亚硝基胍(MNNG),东京化成工业株式会社,批号NH8JH-LE;盐酸雷尼替丁胶囊,石家庄四药有限公司,批号LN16050402;维酶素胶囊,德州博成制药有限公司,批号W20151003。
1.3 主要试剂与仪器
Western LightningTMChemiluminescence Reagent,美国PerkinElmer,货号NEL103001EA;HRP标记羊抗兔IgG二抗,英国Abcam,货号ab6721;HRP标记兔抗鼠IgG二抗,英国Abcam,货号ab6728;M-MLV反转录酶,日本Takara,货号2641A;RNA酶抑制剂,日本Takara,货号D2310C;SYBR Premix Ex Taq试剂盒,日本Takara,货号DRR041A;RASSF1A 多克隆抗体,美国Santa,货号sc-58470;SAV1多克隆抗体,美国Santa,货号sc-374366;MST2多克隆抗体,美国Proteintech,货号66637-1-Ig。HQ-350XT型显影、定影设备(苏州虎丘影像设备有限公司),SuperRX感光胶片(日本FUJIFILM公司),TS-1型脱色摇床(海门市其林贝尔仪器制造有限公司),DYCZ-24DN型垂直电泳装置(北京六一仪器厂),VE-386型转移电泳槽(北京原平皓生物技术有限公司),5415D型离心机(德国Eppendorf公司),Real-Time PCR扩增仪(美国Bio-Rad公司)。
1.4 分组、造模和给药
实验大鼠适应性喂养1周,随机抽取12只大鼠作为正常组,余58只大鼠作为实验组。参照联合造模法[12-13]制备CAG大鼠模型。0.04 g/mL MNNG溶液自由饮用,结合隔日禁食法,空腹当日予0.003 g/mL雷尼替丁溶液灌胃。造模20周后,随机抽取2只行胃组织病理观察,以胃黏膜层变薄,固有腺体减少,排列紊乱,上皮细胞变性、坏死、脱落,表明造模成功。再将实验组随机分为模型组、维酶素组和化浊解毒方高、中、低剂量组,每组10只。正常组和模型组大鼠每日给予蒸馏水灌胃,维酶素组每日给予维酶素(0.06 g/kg)混悬液灌胃,化浊解毒方高、中、低剂量组(中药高、中、低剂量组)按28、14、7 g/kg分别给予化浊解毒方药液灌胃,给药体积10 mL/kg,连续12周。
1.5 病理观察
第12周末,实验大鼠麻醉处死并取材。将组织切片置于二甲苯Ⅰ5 min,二甲苯Ⅱ5 min,梯度乙醇脱水,苏木素染色10 min,PBS冲洗,10%盐酸酒精分色3~5 s,PBS冲洗,置于1%伊红染液2 min,PBS冲洗,梯度乙醇脱水,中性树脂封片。镜下观察胃黏膜组织病理变化。
1.6 RT-qPCR检测胃黏膜组织RASSF1A、SAV1、MST2 mRNA表达
按照试剂盒说明书进行总RNA提取,反转录条件:65 ℃、10 min,42 ℃、1 h,75 ℃灭活10 min。引物序列见表1。PCR扩增条件:94 ℃预变性3 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共40个循环。采用2-ΔΔCt法计算mRNA相对表达量,ΔΔCt=(Ct待测组目的基因-Ct待测组内参基因)-(Ct对照组目的基因-Ct对照组内参基因)。
表1 各基因PCR引物序列
基因名称引物序列产物长度/bp RASSF1A上游:5’- GCACGTTCTGTCACGAACAC-3’ 92 下游:5’-AGAGTGCAAACTTGCGAGGA-3’ SAV1上游:5’-CCTCGGGAATACGGCTCATC-3’ 78 下游:5’-TCGGGAACCAGAGTCTCCAT-3’ MST2上游:5’-ACAGCACCATGCTAGAGTCG-3’100 下游:5’-TGGGGTGACGTTGCATTTCT-3’ GAPDH上游:5’-TGGCCTCCAAGGAGTAAGAAAC-3’ 69 下游:5’-GGCCTCTCTCTTGCTCTCAGTATC-3’
1.7 Western blot检测胃黏膜组织RASSF1A、SAV1、MST2蛋白表达
提取并测定胃组织蛋白含量,取适量蛋白样品上样,电泳,4 ℃、350 mA转膜2 h,置于含RASSF1A(1∶500)、SAV1(1∶500)和MST2(1∶500)一抗的Blotto溶液,4 ℃孵育过夜,TBST冲洗5 min×4次,二抗孵育1.5 h,TBST洗5 min×4次,ECL化学发光显色液曝光,采用Image J软件对蛋白条带进行分析。计算每个目的蛋白条带灰度值与内参(GAPDH)条带灰度值的比值,得校正后蛋白相对表达量。
1.8 统计学方法
2 结果
2.1 胃黏膜形态变化
肉眼观察,正常组大鼠后胃胃黏膜呈暗红色,黏膜光滑、有光泽,可见规则排列黏膜皱襞(见标记1),前胃胃黏膜较薄,呈白色或淡粉色,黏膜光滑,皱襞排列整齐(见标记2);模型组大鼠后胃胃黏膜呈淡红色,局部黏膜发白,光泽度差,黏膜皱襞减少(见标记3),前胃胃黏膜增厚,呈灰白色,表面粗糙,存在颗粒状隆起,黏膜皱襞消失(见标记4);各给药组大鼠胃黏膜颜色、光泽度、皱襞排列均有所改善,中药高剂量组胃黏膜改善最明显。见图1。

图1 各组大鼠胃黏膜形态
2.2 病理观察结果
正常组大鼠胃黏膜厚度正常,上皮细胞完整,腺体排列整齐,数量适中,无充血、水肿,无炎性细胞浸润;模型组大鼠胃黏膜变薄,上皮细胞坏死、脱落,固有腺体减少,排列紊乱,胃小凹延长,大量炎性细胞浸润;中药高剂量组大鼠胃黏膜病理改善最明显,表现为黏膜厚度适中,上皮细胞较完整,腺体排列较整齐,数量适中,充血、水肿减轻;中药中剂量组和维酶素组大鼠胃黏膜部分改善,中药低剂量组大鼠胃黏膜改善不明显。见图2。
2.3 化浊解毒方对模型大鼠胃黏膜RASSF1A、SAV1、MST2 mRNA和蛋白表达的影响
与正常组比较,模型组大鼠胃黏膜RASSF1A、SAV1、MST2 mRNA和蛋白表达明显降低(<0.05);与模型组比较,化浊解毒方高、中剂量组和维酶素组大鼠胃黏膜RASSF1A、SAV1、MST2 mRNA和蛋白表达均明显升高(<0.05),中药高剂量组升高最明显。结果见表2、图3。
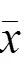
表2 各组大鼠胃黏膜组织RASSF1A、SAV1、MST2 mRNA和蛋白表达比较(±s)
注:与正常组比较,*<0.05;与模型组比较,#<0.05

注:A.正常组;B.模型组;C.中药高剂量组;D.中药中剂量组;E.中药低剂量组;F.维酶素组
3 讨论
CAG是正常胃黏膜向胃癌转化过程中的重要阶段,属中医学“胃脘痛”范畴。研究表明,本病发病机制可能与细胞凋亡、炎症因子、基因的异常表达及幽门螺杆菌感染等有关[14]。CAG多因湿热浊毒损伤胃络,以致清阳不升,浊气不降,脾胃运化失职,津液输布失司,腺体失于濡养,终而萎缩。本研究所用化浊解毒方为王彦刚教授治疗CAG经验方,该方清热利湿、化浊解毒,以清热利湿之茵陈、黄连、黄芩为君药,芳香化湿和胃之藿香、佩兰为臣药,佐以清热燥湿解毒之白花蛇舌草、半边莲、半枝莲、绞股蓝、板蓝根、苦参,诸药合用,可明显缓解CAG引起的不适症状,改善胃黏膜病理变化,阻止病情进一步发展。
中药具有多成分、多靶点的综合调节作用,化浊解毒方中一些重要成分可能在CAG的治疗方面起协同作用。如茵陈、黄连、藿香、苦参、白花蛇舌草、半边莲、半枝莲、绞股蓝中均含有黄酮类化合物槲皮素。研究表明,槲皮素可显著降低中性粒细胞浸润、幽门螺杆菌定植和幽门窦内脂质过氧化物浓度[15]。此外,黄芩、半边莲、板蓝根还含有黄酮类化合物金合欢素。研究表明,金合欢素具有较强的抗菌活性,能明显抑制幽门螺杆菌[16],以及诱导人胃癌细胞凋亡[17]。粗毛豚草素为天然黄酮类化合物,存在于板蓝根和半枝莲中,可抑制人胃腺癌细胞生长[18]。提示黄酮类化合物可能在治疗CAG方面起关键作用,这些成分作为化浊解毒方治疗CAG可能的药效物质基础,有待后续进一步研究与验证。
继Wnt/β-Catenin、PI3K/AKT、NF-κB等经典信号通路之后,Hippo信号通路自发现以来,被认为是哺乳动物细胞的中心信号网络,通过Hippo途径的信号涉及多种生理病理过程,由于其在调节细胞增殖,以及控制器官生长和再生中起着核心作用,故Hippo信号通路与肿瘤的发生、发展关系密切。MST是体内普遍表达的一种丝/苏氨酸蛋白激酶,作为上游激酶及抑癌基因,当细胞无限增殖时,可通过多位点进行自身磷酸化或通过激活相关信号通路直接或间接诱导细胞凋亡[19]。因此,MST缺失可导致细胞过度增殖,在肿瘤的发生发展过程中起着重要作用。研究显示,同时敲除小鼠肝脏MST1与MST2,可导致小鼠肝脏增大和肝癌的发生[20]。Xu等[21]研究发现,MST2在腺瘤及正常胃黏膜中的表达明显高于胃癌组织。
RASSF1A位于3p21.3染色体区域,参与细胞凋亡、微管动态、细胞运动和周期调控等生理病理过程,其主要作为接头蛋白发挥抑癌作用[22]。作为Hippo信号通路重要的抑癌基因,RASSF1A能促进肿瘤细胞凋亡,破坏RAF1-MST2复合物,同时可增强MST2与LATS1/2的结合,激活的MST2可调节LATS激酶活性,进而使YAP1磷酸化,抑制YAP1的促癌作用[23]。由于RASSF1A基因是近年来在肿瘤中发现的甲基化程度最高、最普遍的基因之一,故RASSFlA基因甲基化在肿瘤中的作用受到广泛关注。研究表明,原发性胃癌组织RASSF1A表达明显缺失或低下,且与肿瘤分化程度及分期相关[24]。也有研究显示,RASSF1A甲基化是胃癌非侵入性诊断指标[25-26]。本实验结果显示,CAG大鼠胃黏膜组织RASSF1A表达显著低于正常胃黏膜组织,而CAG的发生、发展是否与RASSF1A的甲基化有关,化浊解毒方是否可影响RASSF1A的甲基化状态,有待今后进一步研究。
SAV1又称WW45,是Hippo信号通路中激酶级联反应链中的一员,起衔接和活化MST1/2、LATS1/2蛋白的作用,SAV1与MST1/2通过SARAH结构域结合形成二聚体,使SAV1自身发生磷酸化并增加其结构的稳定性,磷酸化SAV1可抑制PP2A-STRIPAK磷酸酶复合物的形成,从而激活MST1/2,进而促进LATS1/2、MOB1活化,诱导细胞凋亡[27]。SAV1基因缺失或被抑制,影响肿瘤尤其是消化道肿瘤的发生、发展。研究发现,SAV1是酒精性脂肪肝和肝癌最常见的突变基因之一,肝特异性敲除SAV1后能促进肝脂肪蓄积、肝细胞凋亡及纤维化,最终将加快肝肿瘤的发生[28]。Jiang等[29]研究发现,SAV1在人结直肠癌组织中低表达,其通过使Hippo信号通路磷酸化,抑制癌基因YAP转录,进而抑制Akt-mTOR信号通路活化,从而发挥抗癌作用。
本实验结果显示,CAG大鼠胃黏膜组织RASSF1A、SAV1、MST2低表达,而在正常胃黏膜组织中高表达,提示CAG大鼠胃黏膜病理变化可能与RASSF1A、SAV1、MST2异常表达有关。经药物干预后,化浊解毒方高剂量组大鼠胃黏膜组织病理改善明显优于化浊解毒方中、低剂量组及维酶素组,同时RASSF1A、SAV1、MST2表达明显高于其他给药组,表明高剂量化浊解毒方疗效存在明显优势,其治疗CAG的作用机制可能是通过干预Hippo信号通路实现的。本研究可为临床CAG的诊治与胃癌的防治提供新思路,为揭示化浊解毒方治疗CAG提供依据。
[1] PIMENTEL-NUNES P, LIBANIO D, MARCOS-PINTO R, et al. Management of epithelial precancerous conditions and lesions in the stomach (MAPS Ⅱ):European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and Sociedade Portuguesa de Endoscopia Digestiva (SPED) Guideline Update 2019[J]. Endoscopy, 2019,51(4):365-388.
[2] 王彦刚,田雪娇,李佃贵,等.李佃贵治疗慢性萎缩性胃炎用药规律研究[J].中国中医基础医学杂志,2017,23(5):702-705.
[3] 刘涛,张霞,魏玮.从“脾虚寒热瘀毒互结”辨治慢性萎缩性胃炎[J].中国中医药信息杂志,2018,25(2):124-126.
[4]田雪娇,王彦刚.王彦刚治疗慢性萎缩性胃炎伴舌感异常经验初探[J].中国中医药信息杂志,2017,24(6):111-113.
[5] MISRA J R, IRVINE K D. The Hippo signaling network and its biological functions[J]. Annual Review of Genetics,2018,52:65- 87.
[6] WANG L, LI B, ZHANG L, et al. miR-664a-3p functions as an oncogene by targeting Hippo pathway in the development of gastric cancer[J]. Cell Prolif,2019,52(3):e12567.
[7] ZHANG A, WANG W, CHEN Z, et al. Sharpin inhibits esophageal squamous cell carcinoma progression by modulating Hippo signaling[J]. Neoplasia,2020,22(2):76-85.
[8] 王彦刚,郝新宇,于仁杰,等.化浊解毒方对慢性萎缩性胃炎大鼠Hippo/TAZ信号通路及相关蛋白TAZ、LATS2、MST1的影响[J].中药药理与临床,2019,35(3):105-110.
[9] 郝新宇.化浊解毒方对慢性萎缩性胃炎大鼠Hippo/TAZ信号通路及相关蛋白的影响[D].石家庄:河北医科大学,2018.
[10] 集川原.化浊解毒方对慢性萎缩性胃炎大鼠Hippo信号通路中MOB1/LATS1/P-YAP的影响[D].石家庄:河北医科大学,2018.
[11] 田雪娇.化浊解毒方对慢性萎缩性胃炎大鼠Hippo/YAP信号通路及相关蛋白的影响[D].石家庄:河北医科大学,2017.
[12] 魏玥,杨晋翔,王再见,等.益气化瘀解毒法对慢性萎缩性胃炎伴异型增生大鼠EGFR/MAPK信号通路的影响[J].北京中医药大学学报,2015, 38(2):95-99.
[13] JIANG X Y, QIAN L P, ZHENG X J, et al. Interventional effect of Ginkgo biloba extract on the progression of gastric precancerous lesions in rats[J]. Journal of Digestive Diseases, 2010,10(4):293-299.
[14] LI Y, XIA R, ZHANG B, et al. Chronic atrophic gastritis:a review[J]. Journal of Environmental Pathology, Toxicology and Oncology,2018,37(3):241-259.
[15] WANG Y C. Medicinal plant activity on helicobacter pylori related diseases[J]. World J Gastroenterol,2014,20(30):10368- 10382.
[16] GOMEZ-CHANG E, URIBE-ESTANISLAO G V, MARTINEZ-MARTINEZ M, et al. Anti-helicobacter pylori potential of three edible plants known as quelites in Mexico[J]. J Med Food,2018,21(11):1150-1157.
[17] PAN M H, LAI C S, HSU P C, et al. Acacetin induces apoptosis in human gastric carcinoma cells accompanied by activation of caspase cascades and production of reactive oxygen species[J]. J Agric Food Chem,2005,53(3):620-630.
[18] YU C Y, SU K Y, LEE P L, et al. Potential therapeutic role of hispidulin in gastric cancer through induction of apoptosis via NAG-1 signaling[J]. Evid Based Complement Alternat Med,2013, 2013:518301.
[19] MIN C, HUI Z, ZHUBING S, et al. The MST4-MOB4 complex disrupts the MST1-MOB1 complex in the Hippo-YAP pathway and plays a pro-oncogenic role in pancreatic cancer[J]. Journal of Biological Chemistry,2018,293(37):14455-14469.
[20] SONG H, MAK K K, TOPOL L, et al. Mammalian MST1 and MST2 kinases play essential roles in organ size control and tumor suppression[J]. Proc Natl Acad Sci USA,2010,107(4):1431-1436.
[21] XU Z P, ZHU J S, ZHANG Q, et al. A breakdown of the Hippo pathway in gastric cancer[J]. Hepatogastroenterology,2011,58(110/111):1611-1617.
[22] GORDON M, BAKSH S. RASSF1A:Not a prototypical ras effector[J]. Small GTPases,2011,2(3):148-157.
[23] 胡斐,陈丽,毕明瑜,等.RASSF1A基因及其在结直肠癌中的研究进展[J].生命科学,2020,32(2):143-148.
[24] 赵军,张义胜,王永生,等.RASSF1A基因在胃癌中的表达及意义[J].南京医科大学学报(自然科学版),2017,37(1):90-92.
[25] YU G S, LAI C Y, XU Y, et al. Aberrant methylation of RASSF1A gene contribute to the risk of renal cell carcinoma:A meta- analysis[J]. Asian Pacific Journal of Cancer Prevention,2015, 16(11):4665-4669.
[26] PIMSON C, EKALAKSANANAN T, PIENTONG C, et al. Aberrant methylation of PCDH10 and RASSF1A genes in blood samples for non-invasive diagnosis and prognostic assessment of gastric cancer[J]. Peer J,2016,9(4):e2112.
[27] NI L, LI S, YU J, et al. Structural basis for autoactivation of human Mst2 kinase and its regulation by RASSF5[J]. Structure, 2013,21(10):1757-1768.
[28] KODAMA T, YI J, NEWBERG J Y, et al. Molecular profiling of nonalcoholic fatty liver disease-associated hepatocellular carcinoma using SB transposon mutagenesis[J]. Proc Natl Acad Sci USA,2018,115(44):E10417-E10426.
[29] JIANG J, CHANG W, FU Y, et al. SAV1 represses the development of human colorectal cancerby regulating the Akt mTOR pathway in a YAP-dependent manner[J]. Cell Proliferation,2017,50(4):e12351.
Effects ofPrescription on Expressions of RASSF1A, SAV1 and MST2 Proteins in Hippo Signaling Pathway of Rats with Chronic Atrophic Gastritis
HAO Xinyu1, WANG Yangang2, TIAN Xuejiao2
To observe the effects ofPrescription on expressions of RASSF1A, SAV1 and MST2 protein in Hippo signaling pathway of rats with chronic atrophic gastritis; To discuss its possible mechanism of action.CAG rat model was established by joint modeling method. After the CAG rat models were established successfully, they were randomly divided into model group, vitacoenzyme group, andPrescription high-, medium- and low-dosage groups, with 10 rats in each group, and 10 rats in the normal group. Rats in the normal group and model group were given distilled water for gavage, vitacoenzyme suspension solution for gavage in vitacoenzyme group, and relative dosage ofPrescription for gavage inPrescription high-, medium- and low-dosage groups. Animals were administered with corresponding drugs for 12 weeks. HE staining was used to observe the histopathological changes of gastric mucosa, and the expressions of RASSF1A, SAV1, MST2 proteins and mRNA in gastric mucosa were detected by Western blot and real-time quantitative PCR.Compared with the normal group, the expressions of RASSF1A, SAV1, MST2 mRNA and protein in gastric mucosa tissue of model group were significantly reduced (<0.05); compared with the model group, the expressions of RASSF1A, SAV1, MST2 mRNA and protein in gastric mucosa tissue significantly increased inPrescription high- and medium-dosage groups and vitacoenzyme group (<0.05), among which,Prescription high-dosage group increased the most.Prescription has the effects of intervening CAG and delaying the progression of cancer. Its mechanism may be related to the up-regulation of the expressions of the suppressor genes RASSF1A, SAV1 and MST2 in model rats.
Prescription; chronic atrophic gastritis; Hippo signaling pathway; RASSF1A; SAV1; MST2; rats
R285.5
A
1005-5304(2021)04-0069-06
10.19879/j.cnki.1005-5304.202007494

河北省自然科学基金(H2020423207)
王彦刚,E-mail:piwei001@163.com
(收稿日期:2020-02-05)
(修回日期:2020-08-16;编辑:华强)

