升陷汤对肺纤维化大鼠肺组织α-平滑肌肌动蛋白、肺表面活性蛋白D及TGF-β1/Smads通路蛋白表达的影响
张旭辉,刘喜平,孙杰,武妍琳,陈嘉慧,崔国宁
实验研究
升陷汤对肺纤维化大鼠肺组织α-平滑肌肌动蛋白、肺表面活性蛋白D及TGF-β1/Smads通路蛋白表达的影响
张旭辉1,刘喜平1,2,孙杰3,武妍琳1,陈嘉慧2,崔国宁2
1.甘肃中医药大学附属医院,甘肃 兰州 730000; 2.甘肃中医药大学,甘肃 兰州 730000; 3.广州中医药大学第一附属医院,广东 广州 510405
观察升陷汤对肺纤维化大鼠肺组织α-平滑肌肌动蛋白(α-SMA)、肺表面活性蛋白D(SP-D)及TGF-β1/Smads通路蛋白表达的影响,探讨其作用机制。SPF级SD雄性大鼠60只,随机分为正常组、模型组、吡非尼酮组和升陷汤高、中、低剂量组。除正常组外,其余大鼠采用气管内注射硫酸博莱霉素建立肺纤维化模型,造模后第8日起,升陷汤高、中、低剂量组分别予10.4、5.2、2.6 g/(kg•d)升陷汤灌胃,吡非尼酮组予0.72 g/(kg•d)吡非尼酮混悬液灌胃,连续28 d。记录大鼠肺脏质量和体质量,计算肺脏系数,HE染色观察大鼠肺组织病理变化,Masson染色观察大鼠肺组织纤维化程度,免疫组化检测大鼠肺组织α-SMA、SP-D的表达,Western blot检测大鼠肺组织转化生长因子-β1(TGF-β1)、Smad2、Smad7蛋白的表达。与正常组比较,模型组大鼠肺脏质量和肺脏系数明显增加,体质量明显减轻,肺组织损伤评分和肺组织胶原容积分数明显增加(<0.05),肺组织α-SMA、TGF-β1、Smad2蛋白表达明显升高,SP-D、Smad7蛋白表达明显降低(<0.05);与模型组比较,升陷汤高、中、低剂量组大鼠肺脏质量和肺脏系数明显降低,体质量增加,肺组织损伤评分及肺组织胶原容积分数明显降低(<0.05),肺组织α-SMA、TGF-β1、Smad2蛋白表达明显降低,SP-D、Smad7蛋白表达明显升高(<0.05)。升陷汤可降低肺纤维化模型大鼠肺脏质量,增加大鼠体质量,降低肺组织损伤,其机制可能与下调肺组织α-SMA、TGF-β1、Smad2蛋白的表达,上调SP-D、Smad7蛋白的表达相关。
升陷汤;肺纤维化;α-平滑肌肌动蛋白;肺表面活性蛋白D;TGF-β1/Smads通路;大鼠
肺纤维化是多种弥漫性间质性肺疾病的共同病理改变和最终结局。肺功能减弱、肺组织肌成纤维细胞激活、细胞外基质(ECM)过度形成和胶原持久沉积是其主要特点[1]。肺纤维化发病机制尚未明确,目前缺乏有效治疗手段,预后较差。临床多用糖皮质激素、免疫调节剂等药物治疗,但效果并不显著,新药吡非尼酮、尼达尼布虽有一定疗效,但价格昂贵,不良反应明显,临床应用受限。中医对肺纤维化的防治进行了许多有益的探索,并在改善患者肺功能、延缓肺纤维化进程、降低病死率方面具有明显优势。有学者对肺纤维化中医证候要素演变规律研究表明,气虚是其核心证候要素,贯穿于肺纤维化发病的不同临床分期[2]。研究发现,由气虚引起的胸中“大气下陷”在肺纤维化发病中具有重要意义,益气升陷法是肺纤维化的关键治法[3]。升陷汤源于《医学衷中参西录》,具有益气升陷之功,是治疗胸中“大气下陷”代表方剂[4],临床治疗肺纤维化疗效肯定[5],但机制尚不明确。α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)是肌成纤维细胞活化的重要指标之一[6]。肺表面活性蛋白D(pulmonary surfactant protein D,SP-D)是肺泡上皮细胞分泌的一种亲水性脂蛋白,可维持肺泡腔内肺表面活性物质磷脂的正常结构和功能[7]。转化生长因子-β1(TGF-β1)是迄今最为明确的ECM诱导剂,TGF-β1与TGF-βⅡ型受体(TGF-βRⅡ)结合,活化后的TGF-βRⅡ使Ⅰ型受体的丝甘氨酸序列结构域磷酸化,并与Ⅰ型受体形成异源聚体复合物,激活下游的Smads信号通路,Smads家族中的Smad2是TGF-β1/Smads通路中的主要活化蛋白,与肺纤维化的形成密切相关;Smad7则具有抑制TGF-β1/Smads通路活化的作用[8]。本研究采用硫酸博莱霉素诱导建立肺纤维化大鼠模型,观察升陷汤对肺纤维化大鼠肺组织α-SMA、SP-D及TGF-β1/Smads蛋白表达的影响,揭示升陷汤延缓肺纤维化大鼠肺组织纤维化的效应机制。
1 实验材料
1.1 动物
SPF级雄性SD大鼠60只,体质量(200±20)g,6~8周龄,甘肃中医药大学动物实验中心提供,动物许可证号SCXK(甘)2011-0002-0002141。常规饲养于甘肃中医药大学动物实验中心SPF级动物房,温度(22±2)℃,湿度50%~60%,12 h光暗循环。本研究所有动物实验经甘肃中医药大学实验动物伦理委员会审查批准(2019-205)。
1.2 药物及制备
升陷汤(黄芪、知母、柴胡、桔梗、升麻),饮片由甘肃中医药大学附属医院中药房提供,经甘肃中医药大学药学院景明教授鉴定符合2015年版《中华人民共和国药典》规定。上述饮片按《医学衷中参西录》升陷汤原方比例[4],即黄芪、知母、柴胡、桔梗、升麻按36∶18∶5∶5∶6比例混合,水煎煮2次,每次30 min,粗滤去除药渣,合并2次滤液,浓缩为含原药材1.26 g/mL;吡非尼酮胶囊,北京康蒂尼药业有限公司,批号190923,100 mg/粒,配制成0.036 g/mL混悬液备用。硫酸博莱霉素,上海阿拉丁生化科技股份有限公司,批号B107423。
1.3 主要试剂与仪器
α-SMA一抗,英国Abcam公司,批号AB6776;SP-D一抗,英国Abcam公司,批号134047;山羊抗鼠IgG二抗,美国Sigma公司,批号AB6743;山羊抗兔IgG二抗,美国Sigma公司,批号AB6939;HRP标记二抗,上海碧云天生物技术有限公司,批号A0208;多聚甲醛,上海生工生物工程技术服务有限公司,批号PB0684-500g;水合氯醛,上海阿拉丁生化科技股份有限公司,批号302170;苏木素染液,南京建成生物科技有限公司,批号D006;伊红染液,上海碧云天生物技术有限公司,批号C0109;苏木素,南京建成生物科技有限公司,批号D005。GAPDH,英国Abcam公司,货号ab124012;TGF-β1一抗,英国Abcam公司,货号ab143065;Smad2一抗,美国CST公司,货号CST3102;Smad7一抗,英国Abcam公司,货号ab169492。XB220A型电子分析天平,瑞士梅特勒-托利多仪器有限公司;CKX41倒置显微镜,日本OLYMPUS公司;HI1220型烤片机,德国Leica公司;RM2255型切片机,德国Leica公司;Nano Zoomer-SQ型数字切片扫描仪,日本滨松光子学株式会社;垂直板电泳转移装置,美国Bio-Rad;Tanon 2500R凝胶成像仪,上海天能科技有限公司;稳压DNA电泳仪,美国Tianneng公司。
2 实验方法
2.1 分组及造模
大鼠适应性喂养1周,按随机数字表法选择10只为正常组,不进行任何干预,其余大鼠腹腔注射10%水合氯醛(3 mL/kg)麻醉,气管内注射硫酸博莱霉素5 mg/kg建立肺纤维化模型[9]。造模完成后将大鼠再随机分为模型组、吡非尼酮组和升陷汤高、中、低剂量组,每组10只。给药剂量参照人与大鼠体表系数折算[10],造模成功后第8日开始,升陷汤高、中、低剂量组分别给予10.4、5.2、2.6 g/kg升陷汤灌胃(相当于临床成人剂量12、6、3倍),吡非尼酮组给予吡非尼酮混悬液0.72 g/kg灌胃(相当于临床成人剂量6倍)。给药体积10 mL/kg,正常组和模型组给予等体积生理盐水灌胃,每日1次,连续28 d。
2.2 肺脏质量、体质量及肺脏系数测定
大鼠腹腔注射7%水合氯醛(0.05 mL/kg)麻醉,固定于解剖台,逐层分离各层组织,迅速摘取肺脏,并用预冷的生理盐水清洗,弃肺外气管后称重,参考文献[11]方法计算肺脏系数。肺脏系数(%)=肺脏质量(g)÷体质量(g)×100%。
2.3 肺组织病理观察
取右下叶肺组织,4%多聚甲醛固定,石蜡包埋,切片(厚约5 μm),脱蜡复水,苏木素染液染色10 min,再用伊红染液染色30 s,蒸馏水洗涤,95%乙醇脱水2 min,二甲苯透明5 min,中性树脂封片。镜下观察肺组织损伤情况,每张切片选择3个视野拍照,进行肺组织炎症病理程度评分[12]。0分:肺组织结构正常,无炎性细胞浸润,结构清晰;1分:肺组织结构正常,可见轻微炎性细胞浸润,有轻微组织变性、坏死;2分:肺组织结构明显改变,可见较多炎性细胞浸润,组织变性、坏死;3分:肺组织结构显著异常,可见炎性浸润,组织变性、坏死,肺组织结构模糊。同时,石蜡包埋切片,行Masson染色,镜下观察肺组织纤维化改变,通过Image J软件计算胶原容积分数(collagen volume fraction,CVF),即蓝色面积占组织总面积的百分比。
2.4 免疫组化检测肺组织α-平滑肌肌动蛋白和肺表面活性蛋白D的表达
将肺组织切片常规脱蜡,抗原修复后滴加正常山羊血清封闭液,室温放置20 min,分别滴加α-SMA、SP-D一抗50 μL(1∶200),37 ℃放置60 min,再加入HRP标记二抗(1∶70),37 ℃放置30 min。按试剂盒说明书进行DAB显色10 min,苏木素复染5 min,脱水,透明,封片。用数字切片扫描仪对切片进行拍照,观察染色结果,细胞质和/或细胞核中见棕黄色或棕褐色颗粒即为α-SMA及SP-D染色阳性。采用Image Pro Plus 6.0进行分析,每个样本随机选取6个视野,测量每个视野阳性染色面积(μm2),计算阳性染色面积与总面积的比值。
2.5 Western blot检测肺组织转化生长因子-β1、Smad2、Smad7蛋白的表达
提取肺组织总蛋白,按BCA法检测总蛋白浓度后,将蛋白与5×SDS上样缓冲液按4∶1混合,沸水煮5 min,使蛋白变性。加入电泳液后等量蛋白上样,电泳,80 V电泳30 min,120 V电泳2 h,200 mA、4 ℃湿转2 h;5%脱脂牛奶(TBST配制)室温封闭2 h,按1∶1000稀释TGF-β1、Smad2、Smad7和GAPDH抗体,温育1.5 h;次日按1∶1000稀释二抗,温育1.5 h;TBST清洗4次,每次5 min。凝胶成像仪测量条带灰度值,以GAPDH为内参计算蛋白相对表达量。
3 统计学方法
4 结果
4.1 升陷汤对大鼠肺脏质量、体质量及肺脏系数的影响
与正常组比较,模型组大鼠肺脏质量、肺脏系数明显增加,体质量明显下降,差异有统计学意义(<0.01,<0.05);与模型组比较,升陷汤各剂量组和吡非尼酮组大鼠肺脏质量、肺脏系数均显著降低,体质量明显增加,差异有统计学意义(<0.05,<0.01)。见表1。
4.2 升陷汤对肺纤维化大鼠肺组织病理形态的影响
HE染色结果显示,正常组大鼠肺组织结构及肺泡壁均完整,细支气管壁及肺泡隔少见炎性细胞浸润;模型组大鼠肺组织结构破坏严重,肺间质纤维组织广泛增生,纤维化区可见大量胶原纤维沉积及增生纤维细胞,并见大小不等囊性纤维气腔,肺泡腔内可见大量炎性细胞浸润;升陷汤各剂量组和吡非尼酮组大鼠炎性细胞浸润明显减轻,成纤维细胞及胶原纤维沉积明显减少,肺组织炎症评分显著降低,差异有统计学意义(<0.05,<0.01)。Masson染色结果显示,正常组大鼠肺泡区可见少量胶原纤维,支气管壁胶原层较薄;模型组各区域均可见大量胶原纤维增生,弥漫性肺纤维化形成;升陷汤各剂量组和吡非尼酮组胶原纤维明显减少,CVF显著降低,差异有统计学意义(<0.05,<0.01)。见图1、图2和表2。
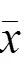
表1 各组大鼠肺脏质量、体质量及肺脏系数比较(±s)
注:与正常组比较,*<0.05,**<0.01;与模型组比较,#<0.05,##<0.01

图1 各组大鼠肺组织形态(HE染色,×400)

图2 各组大鼠肺组织形态(Masson染色,×400)
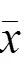
表2 各组大鼠肺组织炎症评分和CVF比较(±s)
注:与正常组比较,*<0.05;与模型组比较,#<0.05,##<0.01
4.3 升陷汤对大鼠肺组织α-平滑肌肌动蛋白和肺表面活性蛋白D表达的影响
免疫组化染色显示,正常组大鼠肺组织可见少量α-SMA蛋白表达,大量SP-D蛋白表达;与正常组比较,模型组大鼠肺组织α-SMA蛋白表达显著升高,SP-D蛋白表达显著降低(<0.05,<0.01);与模型组比较,升陷汤各剂量组大鼠肺组织α-SMA蛋白表达显著降低,SP-D蛋白表达显著升高(<0.05,<0.01)。见图3、图4和表3。

图3 各组大鼠肺组织α-SMA蛋白阳性表达(免疫组化染色,×400)

图4 各组大鼠肺组织SP-D蛋白阳性表达(免疫组化染色,×400)

表3 各组大鼠肺组织α-SMA、SP-D蛋白表达比较(±s,%)
注:与正常组比较,*<0.05,**<0.01;与模型组比较,#<0.05,##<0.01
4.4 升陷汤对大鼠肺组织转化生长因子-β1、Smad2、Smad7蛋白表达的影响
与正常组比较,模型组大鼠肺组织TGF-β1、Smad2蛋白表达显著升高(<0.01),Smad7蛋白表达显著降低(<0.01);与模型组比较,升陷汤各剂量组和吡非尼酮组大鼠肺组织TGF-β1、Smad2蛋白表达显著降低(<0.05,<0.01),Smad7蛋白表达显著升高(<0.05,<0.01)。结果见图5、表4。

注:A.正常组;B.模型组;C.升陷汤高剂量组;D.升陷汤中剂量组;E.升陷汤低剂量组;F.吡非尼酮组
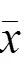
表4 各组大鼠肺组织TGF-β1、Smad2、Smad7蛋白表达比较(±s)
注:与正常组比较,**<0.01;与模型组比较,#<0.05,##<0.01
5 讨论
肺纤维化属中医学“肺痿”范畴,其临床证候错综复杂。肺纤维化患者临床常见呼吸浅短而不相顺接,随着肺纤维化病情发展,部分患者常出现心悸、气短、面色灰黯、紫绀及舌质瘀斑青紫等瘀血阻滞、肺络不通的表现。升陷汤由黄芪、知母、柴胡、桔梗、升麻组成,方中重用黄芪为君药,补大气,举下陷,又能通过补气令气旺血行、瘀去络通;柴胡、升麻升阳举陷,助黄芪升举大气下陷,共为臣药;佐以凉润之知母,以制黄芪之温燥;桔梗入胸中肺经,性善上行,既开宣肺气,又载药上行,直达病所,为使药。全方药少力专,共奏益气升陷之功,与肺纤维化“大气下陷”证候相对应。
肺成纤维细胞是肺纤维化发生发展的重要效应细胞[13],肺成纤维细胞转化为大量肌成纤维细胞参与肺纤维化的发生发展,是肺纤维化的主要原因。α-SMA是肌成纤维细胞活化的指标。SP-D具有降低肺泡表面张力,维持肺泡腔内肺表面活性物质磷脂正常结构和功能,提高肺的顺应性、促进肺气体交换及阻滞肺泡炎性水肿等作用[7]。研究发现,肺纤维化患者肺组织SP-D表达明显下降,且肺组织中SP-D表达越低,纤维化程度越严重,生存率越低,预后越差[14]。因此,α-SMA和SP-D表达水平可作为肺成纤维细胞向肌成纤维细胞转化及判断肺纤维化程度的重要标志[15]。进一步研究表明,肺成纤维细胞中α-SMA的表达受TGF-β的调控[16]。TGF-β1是影响肺纤维化发生发展的致纤维化因子,能刺激纤维粘连蛋白和胶原蛋白等ECM合成和过度沉积[17],诱发成纤维细胞过度增殖和分化,产生大量肌成纤维细胞[18]。Smad蛋白是TGF-β1诱导纤维化作用的关键效应分子,TGF-β1与其受体结合后,可产生磷酸化Smad2,磷酸化Smad2转移到核内可启动TGF-β1靶基因的转录[19]。Smad7是Smads家族的抑制性分子,可与Smad2等激活性Smads家族分子竞争TGF-β1受体,阻断TGF-β信号传递[20]。因此,调控TGF-β1/Smad通路相关分子的表达是治疗肺纤维化的重要途径。
本研究发现,肺纤维化大鼠肺组织可见肺泡结构不同程度破坏,肺间质增生,炎性细胞浸润和胶原纤维增生明显;肺组织α-SMA蛋白表达显著升高,SP-D蛋白表达显著降低,二者存在明显负相关。同时,肺组织TGF-β1、Smad2蛋白表达显著升高,Smad7蛋白表达显著降低。升陷汤可通过降低肺纤维化大鼠肺组织α-SMA、TGF-β1、Smad2蛋白的表达,提高SP-D、Smad7蛋白的表达,减轻肺纤维化大鼠肺组织炎性细胞浸润程度,减少胶原纤维沉积,抑制纤维增生,发挥抗肺纤维化的作用。
[1] 陆再英,钟南山.内科学[M].北京:人民卫生出版社,2008:101.
[2] 郭思佳,封继宏,宋雅琳,等.特发性肺纤维化不同分期中医证素演变规律初步研究[J].世界中西医结合杂志,2018,13(6):809-812.
[3] 王振兴,张秀,王宇帆,等.从大气下陷论治肺间质纤维化[J].中医杂志,2016,57(7):567-569.
[4] 张锡纯.医学衷中参西录[M].太原:山西科学技术出版社,2009:82.
[5] 郝伟欣,董振华.升陷汤加味治疗结缔组织病合并肺间质纤维化体会[J].中华中医药杂志,2008,23(8):707-709.
[6] SZAPIEL S V, ELSON N A, FUlMER J D, et al. Bleomycin-induced interstitial pulmonary disease in the nude, athymic mouse[J]. The American Review of Respiratory Disease,1979,12(4):893-899.
[7] 王钧,吴万鹏.肺表面活性蛋白D的研究进展[J].国际呼吸杂志,2012, 32(23):1825-1828.
[8] LEE C M, JIN W P, WON K C, et al. Modifiers of TGF-β1 effect or function as novel therapeutic targets of pulmonary fibrosis[J]. Korean Journal of Internal Medicine,2014,29(3):281-290.
[9] 宋新文,高海丽,王宏伟,等.PDTC对肝纤维化大鼠核转录因子-κB、α-平滑肌肌动蛋白和Ⅰ型胶原表达影响研究[J].免疫学杂志,2013, 29(3):216-221.
[10] 陈奇.中药药理研究方法学[M].北京:人民卫生出版社,2006:18.
[11] 孙建新,安娟,连军.影响实验动物脏器重量及肺脏系数因素分析[J].实验动物科学,2009,26(1):49-51.
[12] 薛晓伟,李星奇,周良锐,等.常规HE染色不同染色系统的评分分析[J].中华病理学杂志,2016,45(4):262-263.
[13] 蔡琳,徐军.HMGB1 RNA干扰对博莱霉素诱导肺纤维化小鼠α平滑肌肌动蛋白的抑制作用[J].免疫学杂志,2013,29(4):322-326.
[14] BARLO N P, VAN MOORSEL C H, RUVEN H J, et al. Surfactant protein-D predicts survival in patients with idiopathic pulmonary fibrosis[J]. Sarcoidosis Vasculitis & Diffuse Lung Diseases Official Journal of Wasog,2009,26(2):155-161.
[15] YAN Z, KUI Z, PING Z. Reviews and prospectives of signaling pathway analysis in idiopathic pulmonary fibrosis[J]. Autoimmunity Reviews,2014,13(10):1020-1025.
[16] 孙林清,周倩文,王发选.转化生长因子β1对肺成纤维细胞中平滑肌肌动蛋白表达的影响[J].宁夏医科大学学报,2019,41(5):461-464.
[17] BARBARIN V, AURELIE N, MISSON P, et al. The role of pro- and anti-inflammatory responses in silica-induced lung fibrosis[J]. Respiratory Research,2005,6(1):112.
[18] 张秀,胡静.TGF-β-Smad通路及相关因子在肺纤维化中的“串话”现象[J].现代医药卫生,2016,32(1):54-56.
[19] 唐娜,肖建华.TGF-β与转录因子在肝纤维化中的相互作用[J].微生物学免疫学进展,2016,44(6):85-88.
[20] SRIRAM N, KALAYARASAN S, MANIKANDAN R, et al. Epigallocatechin gallate attenuates fibroblast proliferation and excessive collagen production by effectively intervening TGF-β1 signaling[J]. Clinical & Experimental Pharmacology & Physiology,2015,42(8):849-859.
Effects ofDecoction on Expressions of α-Smooth Muscle Actin, Pulmonary Surfactant Protein D and TGF-β1/Smads Pathway in Lung Tissue of Rats with Pulmonary Fibrosis
ZHANG Xuhui1, LIU Xiping1,2, SUN Jie3, WU Yanlin1, CHEN Jiahui2, CUI Guoning2
To observe the effects ofDecoction on expressions of α-smooth muscle actin (α-SMA), pulmonary surfactant protein D (SP-D) and TGF-β1/Smads pathway in lung tissue of model rats with pulmonary fibrosis; To explore its mechanism of action.Totally sixty male SD rats with SPF grade were randomly divided into normal group, model group,Decoction high-, medium- and low-dosage groups and pirafenidone group. Except for the normal group, the remaining rats were injected with bleomycin to establish the pulmonary fibrosis model. From the 8th day after the model was established, the high, medium and low dosages of 10.4, 5.2, 2.6 g/(kg•d)Decoction were respectively given for gavage. The rats in the pirafenidone group received 0.72 g/(kg•d) pirafenidone suspension. After 28 days, the lung mass and body mass of the rats were recorded and the lung coefficient was calculated. HE staining was used to observe the pathological changes of lung tissues in each group. Masson staining was used to observe the degree of pulmonary fibrosis in each group. Immunohistochemistry was used to detect the expressions of α-SMA and SP-D in lung tissue. The expressions of TGF-β1, Smad2 and Smad7 were detected by Western blot.Compared with the normal group, the lung mass and lung coefficient of the model group significantly increased, the body mass was reduced, the lung injury score and lung collagen volume fraction increased (<0.05), the expressions of α-SMA, TGF-β1 and Smad2 protein in lung tissue increased, and the expressions of SP-D and Smad7 protein decreased (<0.05). Compared with the model group, lung mass and lung coefficient were reduced, body mass increased, lung injury score and lung tissue collagen volume fraction decreased (<0.05), the expressions of α-SMA, TGF-β1 and Smad2 in lung tissues decreased, while the expressions of SP-D and Smad7 increased inDecoction high-, medium- and low-dosage groups (<0.05).Decoction can reduce the lung mass of model rats, increase the body mass of rats, and reduce lung tissue damage, and the mechanism may be related to down-regulation of expressions of α-SMA and TGF-β1, Smad2 protein, and up-regulation of expressions of SP-D and Smad7 protein.
Decoction; pulmonary fibrosis; α-SMA; SP-D; TGF-β1/Smads pathway; rats
R285.5
A
1005-5304(2021)04-0063-06
10.19879/j.cnki.1005-5304.202007587

甘肃省自然科学基金(20JR5RA165);甘肃中医药大学科研发展基金(81360539)
刘喜平,E-mail:lxpd-257@163.com
(收稿日期:2020-07-29)
(修回日期:2020-09-07;编辑:华强)

