甜瓜细菌性果斑病病菌鉴定及不同材料抗病性测定
刘梦华 卢霞 李腾

摘要 为明确近几年江苏地区甜瓜叶片及瓜上发生的某一细菌性病害,以江苏绿港现代农业发展有限公司设施大棚中甜瓜发病叶片为研究对象,经分离纯化得到菌株LG08,观察病菌形态初步判定该病原菌为甜瓜细菌性果斑病菌,为进一步明确该病菌,分别用4对细菌性果斑病菌通用标记(BX、BX-S、ERC和WFB)、3对甜瓜细菌性果斑病菌特异性标记(AcM380、AcM797、AcM13)及16S测序进行分析。结果表明,菌株LG08为燕麦嗜酸菌西瓜亚种(Acidovorax avenae subsp.citrulli)。苗期和坐果期对西甜瓜部分材料接种菌株LG08,结果发现菌株LG08对西甜瓜都有致病性。该研究不仅有利于进一步了解甜瓜细菌性果斑菌的特性,为果斑病的防治提供参考,而且也有助于甜瓜抗病品种的选育。
关键词 甜瓜;细菌性果斑病菌;分离纯化;抗病材料
Abstract To identify the pathogen causing leaves and fruits disease in melon these years in Jiangsu Province, diseased materials were sampled from solar greenhouse of Jiangsu Greenport Modern Agriculture Development Co., Ltd.. In this study,the isolated pathogen named LG08 was purified and initially identified as melon Bacterial Fruit Blotch (BFB) pathogen based on its colonies morphological characterization. Further, four pairs of commonly used BFB markers BX, BX-S, ERC and WFB as well as three pairs of melon specific BFB markers AcM380, AcM797 and AcM13 were used for molecular characterization. In addition, DNA sequencing of LG08 was performed based on 16S amplified fragments. Together, LG08 was ultimately confirmed as a strain of Acidovorax avenae Subsp. citrulli(Aac). It was found that LG08 was pathogenic to melon and watermelon upon inoculating it to some of their plants materials during seedling and fruit setting period. This study not only helps to more understanding the characteristics of BFB, but also provides resistant lines to melon breeding program while constituting a reference for the prevention and treatment of BFB.
Key words Melon;Bacterial fruit blotch;Isolation and purification;Resistant materials
甜瓜(Cucumis melo)為葫芦科甜瓜属一年生蔓性草本植物,是我国最早利用为果品的瓜类[1],世界各地广泛栽培,我国甜瓜栽培面积也在逐渐增加,但随着全球气候变暖及设施大棚的普及,甜瓜病害的种类也逐年增多,其中细菌性果斑病对甜瓜的危害特别严重,造成甜瓜大范围的减产甚至绝产。该病最早于1969年在佛罗里达州发现[2]。1978年Schaad等[3]将其病原菌鉴定为西瓜燕麦嗜酸菌(Acidovorax citrulli)。刘丹丹等[4]通过在LB 培养基上培养该病原菌48 h后观察其形态呈圆形,直径1~2 mm,乳白色、半透明、光滑菌落。李俊阁等[5]对甜瓜苗期接种果斑病菌,发现该病害发病初期子叶出现水渍状病斑,从叶脉开始发展直至叶片失绿,病斑周围有黄色晕圈或坏死。于海博等[6]在辽宁西甜瓜上也发现细菌性果斑病,该病害不仅危害西甜瓜叶片,而且也危害果实,在叶片上初期为水渍状病斑,后逐渐坏死且病斑周围有黄色晕圈;果实感病时,初期呈绿褐色水渍状病斑,随后病斑扩大病菌侵入果肉组织造成水浸状、褐腐或木栓化。2016年Eckshtain-Leiv等[7]在以色列甜瓜上发现细菌性果斑病菌株M6。2019年Park等[8]在韩国西瓜上也发现了该细菌性果斑病菌株KACC17005。
我国海南[9]、新疆[10]、内蒙古[4]、山东[11]等地区也都在西甜瓜上发现并分离出该病原菌,但江苏地区很少报道。甜瓜细菌性果斑病具有发病迅速、传播速度快、暴发性强、防病难等特点,已成为影响我国瓜类生产的主要病害之一,对甜瓜生产造成了巨大的经济损失,该病原菌可通过伤口和气孔侵染瓜类子叶和果实,高温高湿极易发病[4],一旦发病将难以控制,如何有效地防治细菌性果斑病成为生产中的重中之重。目前我国主要通过化学药剂防治细菌性果斑病,但使用的大部分农药效果不是很理想,且对环境污染较大,容易产生抗药性[5],所以筛选果斑病抗性品种是广大育种工作者目前亟待解决的问题。
随着分子生物学和生物信息学的发展,许多用于细菌种类鉴定的分子标记被开发。利用这些分子标记能够快速、准确地检测和鉴定该病原菌,韩盛等[10]使用扩增细菌ITS序列的通用引物L1/L2证实引起新疆甜瓜发病的7个病原菌均为嗜酸菌燕麦西瓜亚种(Acidovorax avenae subsp. citrulli),吉训聪等[9]使用细菌通用引物16S rDNA将甜瓜菌株鉴定为嗜酸菌燕麦西瓜亚种(Acidovorax avenae subsp citrulli Willems)。2008年Bahar等[12]用 3对分子标记BX、BX-S、ERC鉴定葫芦科细菌性果斑病菌;2014年Walcott等[13]用分子标记WFB鉴定细菌性果斑病菌。2019年Islam等[14]用3对分子标记AcM380、AcM797和AcM13鉴定甜瓜细菌性果斑病菌。笔者以发病甜瓜叶片为研究对象,通过病菌分离纯化、形态学观察、分子标记检测及16S rRNA基因测序分析等方法,鉴定所分离的甜瓜叶片病原菌,并通过致病性接种检测试验筛选出抗病的甜瓜种质资源,为甜瓜育种提供参考。
1 材料与方法
1.1 试验材料
1.1.1 甜瓜细菌性果斑病标本的采集。2020年3月在江苏绿港现代农业发展有限公司(简称:江苏绿港)拱棚采集病叶带回实验室进行分离纯化。
1.1.2 西甜瓜材料。哈密瓜类7份,玉菇类19份,羊角脆类型10份,厚皮甜瓜10份,薄皮甜瓜4份,西瓜4份材料均由江苏绿港育种研究所提供。供试材料定植于单栋拱棚,依照江苏绿港西甜瓜作物栽培管理标准体系进行栽培管理。
1.1.3 培养基。分离培养用KMB固体培养基(20 g胰蛋白胨、1.5 g硫酸镁、10 g丙三醇、10 g琼脂、3 g磷酸氢二钾,定容至1 000 mL,pH=7)。
摇菌用NB液体培养基(3 g牛肉膏、5 g蛋白胨,定容至1 000 mL,pH=7)。
1.2 试验方法
1.2.1 病原菌分离、纯化。将采集的病叶用自来水冲洗病斑表面、晾干,在生物安全柜中用已灭菌的剪刀将叶片病健交界处组织剪至2~3 mm片段,先用70%乙醇冲洗20 s、無菌水冲洗30 s,重复3次,晾干。将叶片组织放在KMB固体培养基上,每皿5~6片组织,28 ℃恒温培养箱培养24 h。用10 μL灭菌的枪头挑取叶片边缘的菌落至新的KMB固体培养基上,划线培养,放入28 ℃恒温培养箱培养24 h,选取单菌落进行纯化培养,挑单菌落至加入氨苄抗生素的KMB固体培养基上划线培养,如此重复3次,挑取单菌落至加入氨苄抗生素的NB液体培养基中摇菌,置于28 ℃、150 r/min恒温振荡培养箱培养48 h。将纯化后的菌株保存在冰箱(4 ℃)中待用。
1.2.2 病原菌形态观察。将分离纯化后的菌株接种于KMB培养基上,于28 ℃恒温培养箱中培养48 h,观察菌落形态、大小、透明度及表面光滑程度等性状。
1.2.3 病原菌PCR检测。PCR 扩增时采用的反应体系为25 μL 体系,其中菌液2 μL,2×Taq MasterMix(Dye)12.5 μL,正反引物各1 μL,加入灭菌的超纯水至25 μL;PCR反应程序:94 ℃预变性2 min;然后进行35个循环,每个循环包括 94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸 45 s;最后延伸 2 min,置于4 ℃保存。PCR检测时引物(表1)为4对细菌性果斑病菌通用标记(BX、BX-S、ERC和WFB)及3对甜瓜细菌性果斑病菌特异性标记(AcM380、AcM797、AcM13)。PCR产物在加有溴化乙锭(EB)的2%琼脂糖凝胶进行电泳,电泳缓冲液为1× TAE缓冲液,电压为150 v。电泳结束后在凝胶成像分析仪中观察电泳条带,在365 nm波长下分析DNA电泳条带大小,扫描图像并保存。
1.2.4 16S rRNA扩增及基因测序分析。用细菌通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)对分离病菌进行PCR 扩增。PCR反应体系(25 μL):菌液2.0 μL,2×Taq MasterMix(Dye)12.5 μL,正反引物各1.0 μL,加入灭菌的超纯水至25 μL;PCR反应程序:94 ℃预变性2 min;然后进行35个循环,每个循环包括 94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s;最后延伸 2 min。反应结束后,吸取10 μL在2%的琼脂糖凝胶电泳上检测。
用PCR产物纯化试剂盒纯化回收PCR产物,与pMD-19-T载体连接,连接产物转化大肠杆菌DH5a感受态细胞。筛选阳性克隆,PCR法鉴定是否含有外源目标插入片段,将含有目标DNA的转化子进行测序,测序工作由杭州尚亚塞生物技术有限公司完成。利用DNAMAN7生物信息学软件对获得的序列进行比对。
1.2.5 致病性测定及甜瓜材料抗性鉴定。将分离纯化的菌株在NB液体培养基中摇菌48 h,待摇浑后,将菌株配成1×108 CFU/mL的菌悬液。随机选取50份甜瓜材料、4份西瓜材料进行致病性测定和甜瓜抗性试验,每份材料播种7粒,两叶一心定植,甜瓜和西瓜缓苗结束后,在苗龄为4~6叶期时,将菌悬液用喷雾法接种至西甜瓜叶片上,以无菌水喷雾作对照。接种后加大棚内的温湿度,隔3~7 d观察记录发病情况。
2 结果与分析
2.1 病害症状
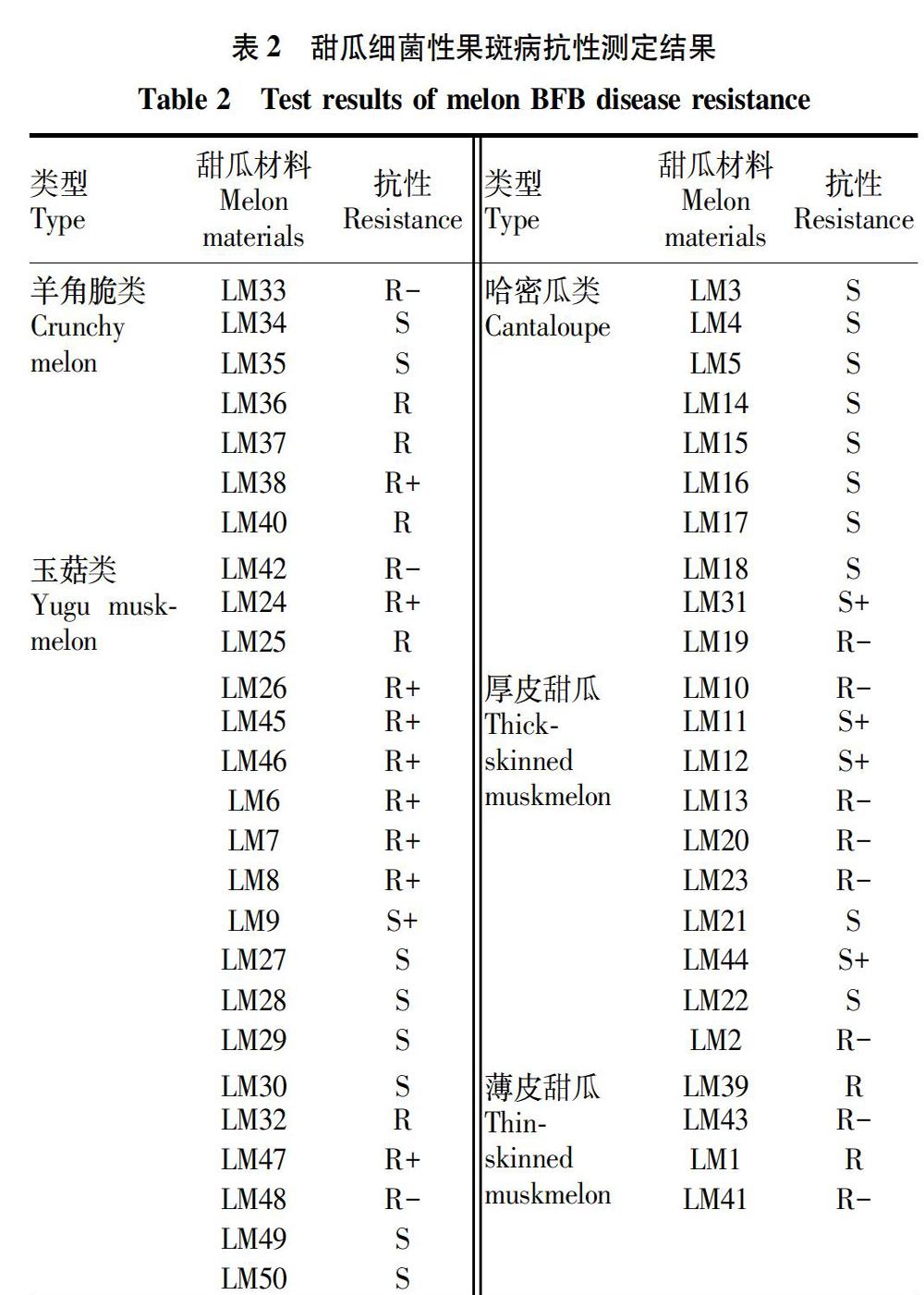
江苏绿港甜瓜田间调查发现,感病甜瓜初期叶片出现不规则褐色斑点,叶脉先发病逐渐向整个叶片蔓延;果实症状比较明显,初期出现水渍状病斑,逐渐扩大成水渍状大斑,侵入果肉引起果肉腐烂(图1 a和b)。
2.2 菌株形态特征
将所采病样1份经3次单菌落的分离纯化,通过菌落形态观察,结果得到1株菌株,编号为LG08。菌株在KMB培养基上形成多菌落,且菌落形态单一。菌落呈凸状,光滑至略带颗粒,乳白色,边缘带半透明(图1c)。
2.3 分子鉴定
为了明确分离得到的菌株LG08是否是瓜类细菌性果斑病,利用4对细菌性果斑病通用标记BX、BX-S、ERC、WFB对菌株LG08进行PCR扩增,经琼脂糖凝胶电泳分别扩增出476、279、342、360 bp的条带(图1d),且带型清晰,该结果与之前报道的结果一致,表明菌株LG08为细菌性果斑病菌。为了进一步验证其是否为甜瓜细菌性果斑病菌,利用3对甜瓜细菌性果斑病特异性标记AcM 380、AcM 797、AcM 13对菌株LG08进行PCR扩增,其结果与之前文献报道的结果一致,同样扩增出了大小分别为853、938、724 bp清晰片段(图1e)。
2.4 16S rRNA基因测序分析
对菌株LG08的16S rDNA序列进行PCR扩增,获得了1 571 bp的PCR产物(图1d),将PCR产物回收测序,测序结果通过NCBI数据库进行BLAST同源性比对(https://blast.ncbi.nlm.nih.gov/Blast.cgi),菌株LG08与已报道的燕麦嗜酸菌西瓜亚种具有高度同源性,即与KACC17005[8]序列同源性达99.80%,与AAC00-1[15]和M6[7]序列同源性高达99.87%;说明菌株LG08也属于燕麦嗜酸菌西瓜亚种(A.avenae subsp.citrulli)。
2.5 病原菌的致病性鉴定及甜瓜抗性鉴定 将菌株LG08分别在苗期和坐果期接种到西甜瓜上,5 d后观察西甜瓜叶片均有发病,且发病症状与上述描述的甜瓜细菌性果斑病的症状一致(图2)。再次对西甜瓜发病叶片和果实进行分离纯化,得到与菌株形态特征相同的菌株,表明菌株LG08可能为细菌性果斑病病原菌。
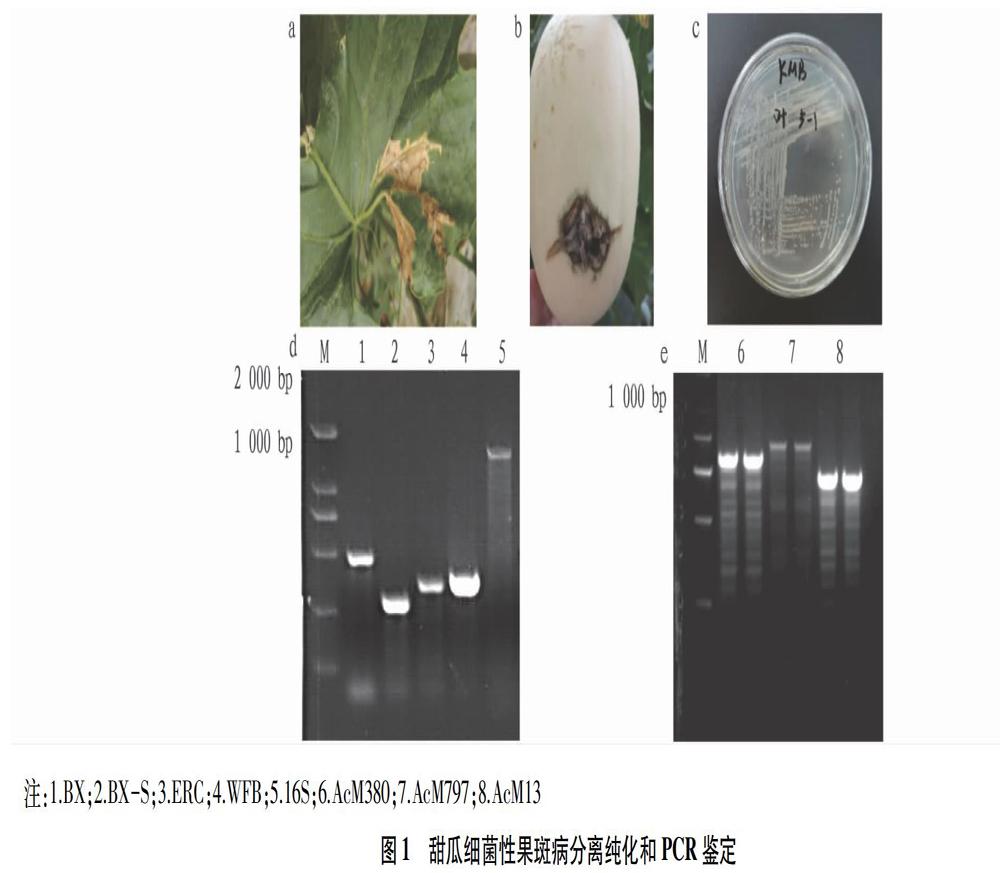
由表2可知,在所有供试甜瓜类型中发病情况有明显的差别。哈密瓜类型的10份材料90%都表现出感病;玉菇类的19份材料中,有12份表现出不同程度的抗病情况,7份表现感病,有可能因为这7份感病材料与其他12份玉菇类的材料无亲缘关系;羊角脆类型的7份材料中,5份表现出不同程度的抗病性,2份表现出感病,这主要是由于个体存在差异性;其他4份薄皮甜瓜均表现出抗性。总体而言,甜瓜薄皮系列、玉菇类具有较强的抗性,哈密瓜类型比较容易感病。由于厚皮甜瓜类型多,控制甜瓜性状的基因也多,其抗感性不易确定。
3 结论与讨论
甜瓜细菌性果斑病主要侵染甜瓜的植株、果实和种子,造成苗期死亡或者果实腐烂等严重现象,对甜瓜育种及生產者造成巨大的影响。该研究采集江苏绿港疑似甜瓜细菌性果斑病病叶1份,对其进行分离纯化,获得1株菌株LG08。
用7对细菌性果斑病相关标记BX、BX-S、ERC、WFB、AcM380、AcM797及AcM13对菌株LG08进行PCR扩增检测,PCR扩增产物经过琼脂糖凝胶电泳,均显示出清晰条带,且经16S rDNA测序分析结果表明该菌株LG08与之前西瓜上分离出的ACC00-1、KAC17005菌株和甜瓜上分离出的M6菌株均具有高度的同源性。将分离纯化得到的菌株LG08回接到健康甜瓜、西瓜幼苗上。接种结果表明,该菌株LG08能引起健康甜瓜、西瓜植株发病。笔者对接种后发病西甜瓜植株叶片再次分离纯化,得到与菌株LG08在菌落形态等方面一致的菌株,且发病叶片症状与田间发病症状相同,由此确定该菌株LG08可能是引起江苏地区西甜瓜的细菌性果斑病菌。Islam等[14]利用其自主开发的3对甜瓜细菌性果斑病特异的标记AcM 380、AcM797和AcM13对甜瓜菌株NIHHS15-280和KACC18782进行PCR扩增检测,发现其能扩增出清晰的目标片段,田间接种甜瓜、西瓜等材料,结果只在甜瓜上发病,而在西瓜上不发病,因此Islam等[14]认为菌株NIHHS15-280和KACC18782对甜瓜具有高度毒性而对西瓜基本无毒性。Islam等[14]用同样的3对标记对2株西瓜菌株ACC00-1、KAC17005也进行了PCR扩增,未扩增出目标条带。而该研究发现,用3对Islam等[14]开发的标记AcM 380、AcM79、AcM13对LG08进行PCR扩增,均扩增出了目标片段,且与Islam等[14]从甜瓜上分离菌株NIHHS15-280和KACC18782扩增的条带大小相同,且田间接种试验表明该菌株LG08不仅能侵染甜瓜而且能引起西瓜发病。该研究利用标记16S仅对保守细菌基因进行测序,而不是对整个基因组进行测序,因此序列相似性结果可能会产生偏差,从而影响序列分析的可靠性。将PCR检测、16S序列分析以及田间致病性结果综合起来,菌株LG08可能与菌株NIHHS15-280和KACC18782相同或存在差异。另外,试验条件和材料背景也可能会影响菌株的致病性。
为了筛选抗细菌性果斑病的甜瓜种质资源,该研究对50份甜瓜材料接种菌株LG08进行致病性检测,观察苗期发病情况。在供试的甜瓜材料中,甜瓜类型与抗性之间存在一定差异,哈密瓜类比较容易感病;玉菇类甜瓜总体上都表现出一定的抗病性,羊角脆类甜瓜中70%抗病,其中有2份材料表现感病,可能因为个体的差异性。由于环境及设施条件可能达不到菌株最适宜的生长环境,抗感材料观察结果可能会有一定的误差,后期会进一步克服外界因素,进行大规模甜瓜抗性筛选试验。该研究可为甜瓜细菌性果斑病抗病基因QTL定位奠定基础,将来可以选取更多甜瓜材料,包括该研究中已选择的材料,设计3种不同的甜瓜栽培模式(露地栽培、日光温室栽培和拱棚栽培),进行大规模的甜瓜抗性筛选试验。
参考文献
[1]鲁思梦,王贤磊,宁雪飞,等.甜瓜 MR-1 细菌性果斑病抗病基因 QTL 定位分析[J].分子植物育种,2019,17(9):2924-2931.
[2]CRALL J,SCHENCK N C.Bacterial fruit rot of watermelon in Florida[J].Plant disease reporter,1969,53(1):74-75.
[3]SCHAAD N W,POSTNIKOVA E,SECHLER A,et al.Reclassification of subspecies of Acidovorax avenae as A. avenae(Manns 1905) emend., A. cattleyae(Pavarino, 1911) comb. nov.,A.citrulli Schaad et al.,1978)comb.nov.,and proposal of A.oryzae sp.nov.[J].Systematic and applied microbiology,2008,31(6/7/8):434-446.
[4]刘丹丹,刘畅.甜瓜细菌性果斑病菌鉴定及杀菌剂毒力测定[J].北方园艺,2017(18):6-10.
[5]李俊阁,王惠林,张亮,等.种子接种果斑病菌对不同甜瓜幼苗生长的影响[J].北方园艺,2015(12):103-106.
[6]于海博,毕馨月,夏博,等.辽宁西瓜和甜瓜细菌性果斑病的病原鉴定[J].沈阳农业大学学报,2019,50(3):345-350.
[7]ECKSHTAIN-LEIV N,SHKEDY D,GERSHOVITS M,et al.Insights from the genome sequence of Acidovorax citrulli M6,a group I strain of the causal agent of bacterial fruit blotch of cucurbits[J].Frontiersin microbiology,2016,3(7):1-12.
[8]PARK H J,SEONG H J,SUL W J,et al.Complete genome sequence of Acidovorax citrulli strain KACC17005,a causal agent for bacterial fruit blotch on watermelon[J].Korean journal of microbiology,2017,53(4):340-341.
[9]吉訓聪,肖彤斌,黄伟明,等.海南甜瓜细菌性果斑病病原菌鉴定[J].广东农业科学,2012,39(11):89-91,95.
[10]韩盛,杨渡,玉山江·麦麦提,等.新疆籽瓜细菌性果斑病的发生与分子鉴定[J].新疆农业科学,2015,52(9):1631-1639.
[11]赵廷昌,赵洪梅,王怀松.山东省西瓜、甜瓜发生瓜类细菌性果斑病[J].植物保护,2009,35(5):170-171.
[12]BAHAR O,EFRAT M,HADAR E,et al.New subspecies-specific polymerase chain reaction-based assay for the detection of Acidovorax avenae subsp.citrulli[J].Plant pathology,2008,57(4):754-763.
[13]WALCOTT R R,GITAITIS R D.Detection of Acidovorax avenae subsp. citrulli in watermelon seed using immunomagnetic separation and the polymerase chain reaction[J].Plant disease,2000, 84(4):470-474.
[14]ISLAM M R,HOSSAIN M R,KIM H T,et al.Development of molecular markers for detection of Acidovorax citrulli strains causing bacterial fruit blotch disease in melon[J].International journal of molecular sciences,2019,20:1-16.
[15]COPELAND A,LUCAS S,LAPIDUS A,et al.Complete sequence of Acidovorax avenae subsp.citrulli AAC00-1[M].Walnut Creek,CA,USA:US DOE Joint Genome Institute,2006.

