SIRT1调控氧化应激的研究进展
刘 旺,周琴怡,莫志勇,李 峰
(南华大学附属南华医院,湖南省衡阳市 421002)
氧化应激被认为是损伤细胞的重要因素,通常是由活性氧(reactive oxygen species,ROS)过度生成所致。在生理情况下,ROS产生水平很低,并可被内源性抗氧化系统清除,而当人体暴露在氧化应激环境下,体内产生ROS超过内源性抗氧化系统能力时,随后导致细胞氧化应激损伤,诱导细胞凋亡,从而表现为各种临床疾病,包括:认知障碍、精神障碍、退行性疾病以及心、脑、肺、肝等脏器疾病。沉默信息调节因子1(silent information regulator of transcription 1,SIRT1)是一种保守的、烟酰胺腺嘌呤二核苷酸(NAD+)依赖的Ⅲ类组蛋白去乙酰化酶。近年来研究表明,SIRT1在抗氧化应激损伤中发挥重要作用,其机制可能与其去乙酰化作用于不同靶基因、靶蛋白有关。本文从SIRT1的生物学功能、SIRT1调控不同靶基因、靶蛋白抗氧化应激损伤方面进行综述,了解SIRT1在抗氧化应激损伤机制的作用,更好地将SIRT1作为一个靶点服务于临床氧化应激相关疾病。
1 SIRT1的生物学功能
Sirtuin家族于2000年首次在哺乳动物中发现,由于其可调控原核及真核生物的重要代谢途径,从而参与了细胞存活、衰老、增殖、凋亡、DNA修复、细胞代谢和氧化应激等多种生物学过程[1]。目前公认的家族成员包括:SIRT1~7,其中SIRT1最具有代表性,因而研究最多。SIRT1是一种去乙酰化酶,基因主要定位于染色体10q22.1,全长为33 660 bp,可编码相对分子质量约为120 kDa的蛋白,其结构主要由N-末端、催化核心、别构部位、C-末端四部分组成,其中别构部位和催化核心构成了SIRT1的活性中心,具有去乙酰化作用。目前多项研究表明,SIRT1可通过调控细胞核因子(nuclear factor-κB,NF-κB)[2]、叉头转录因子1(forkhead box class O1,FOXO1)[3]、P53[4]、过氧化物酶体增殖活化受体γ辅助活化因子(peroxisome proliferator-activated receptor γ coactivator 1α,PGC-1α)[5]、核转录因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)[6]、缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)[7]、腺苷酸活化蛋白激酶(adenosine 5′-monophosphate (AMP)-activated protein kinase,AMPK)[8]、内皮型一氧化氮合酶(endothelial nitric synthase,eNOS)[9]、Ku70[10]、P66Shc[11]等多种靶基因、靶蛋白(图1),进而在氧化应激损伤中发挥重要作用。SIRT1也参与了细胞凋亡和衰老、基因转录、新陈代谢等多种生理功能的调节。
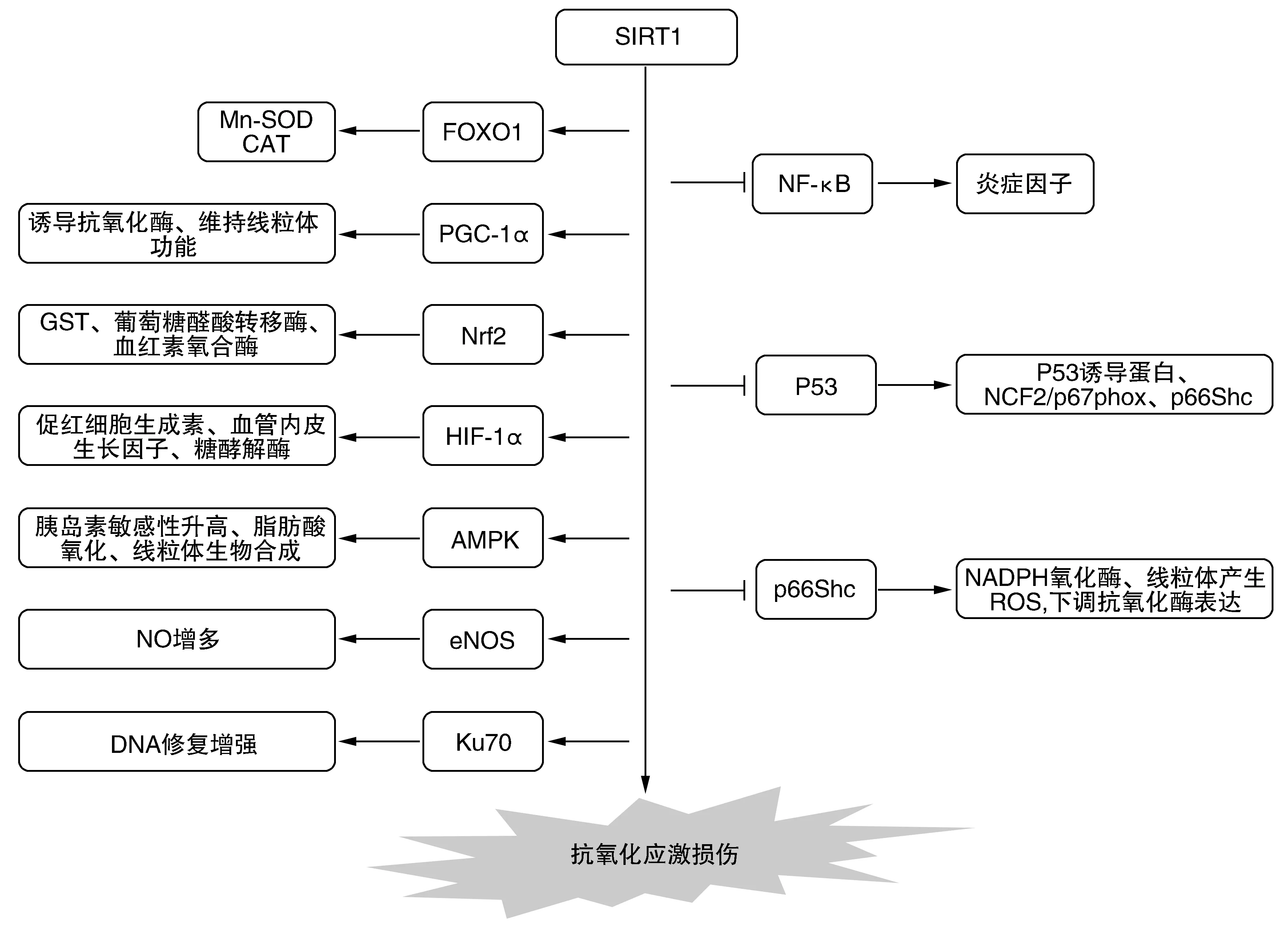
图1 SIRT1抗氧化应激损伤的作用示意图SIRT1通过作用于不同靶基因、靶蛋白,从而发挥抗氧化应激损伤的作用。
2 SIRT1调控不同靶基因、靶蛋白抗氧化应激损伤
2.1 SIRT1调控NF-κB
NF-κB是一种核转录因子,由p50,p52,RelA/p65,cRel和RelB五个亚基组成,与DNA特异序列的结合来调节相关基因转录[12],从而在调控氧化应激、炎症反应、细胞周期、凋亡中发挥重要作用。活化的NF-κB因子可激活炎症因子,对人体造成损伤,同时又可促进ROS的产生,损伤组织器官且进一步促进炎症因子的表达。在正常情况下,NF-κB与其抑制性蛋白(inhibitor of nuclear factor-κB, IκBα)在胞质结合形成无活性复合物,当受到刺激时,IκB激酶使IκBα磷酸化而释放NF-κB,然后活化的NF-κB进入细胞核,与相应的启动子基因靶点结合促进转录。Li等[2]研究表明,SIRT1可去乙酰化RelA/p65,使NF-κB与IκBα结合,抑制NF-κB的转录活性,从而减少炎症因子的表达。因此,本文认为SIRT1可通过去乙酰化抑制NF-κB的转录活性,从而抗氧化应激损伤。
2.2 SIRT1调控FOXO1
叉头转录因子家族(forkhead box class Os,FOXOs)在哺乳动物内主要有四种,分别为:FOXO1、FOXO3、FOXO4、FOXO6。其结构由高度保守的叉头DNA结合区、DNA结合区下游核定位信号区、N端的核输出序列叉头区及高度无序区四个部分组成,其活性受到磷酸化、乙酰化、泛素化等多种方式调节。研究表明FOXO1可通过调控下游靶基因如:锰超氧歧化物酶(Mn-superoxide dismutase,Mn-SOD)、过氧化氢酶等,清除过量的ROS,从而减轻细胞氧化应激损伤[13]。Yao等[3]研究表明,SIRT1可通过去乙酰化激活FOXO1,减轻H2O2所致的细胞氧化应激损伤,抑制成骨细胞凋亡。因此,本文认为SIRT1可通过去乙酰化激活FOXO1而抗氧化应激损伤。此外,在Xiong等[14]的研究中表明FOXO1亦可提高SIRT1的表达水平。可见其自身反馈可能参与了FOXO1依赖的SIRT1转录和SIRT1介导的FOXO1去乙酰化。
2.3 SIRT1调控P53
P53是一种应激反应转录因子,同时也是一种重要肿瘤抑制因子,在细胞周期、凋亡、自噬、氧化应激、DNA复制等方面发挥重要作用。P53可通过调节不同靶蛋白如:P53诱导蛋白、还原型烟酰胺腺嘌呤双核苷酸磷酸(nicotinamide)的胞质亚单位NCF2/p67phox、p66Shc、Bax等促进氧化应激损伤,诱导细胞凋亡[15]。Kim等[16]研究发现,H2O2诱导的氧化应激环境增加了P53基因的表达和积累,而SIRT1的激活降低了P53的活性。Lin等[4]的研究证实,SIRT1可通过去乙酰化P53,抑制P53活化,从而保护肾小管细胞免受氧化应激损伤,减少细胞凋亡。因此,SIRT1可通过去乙酰化抑制P53活性,减少氧化应激损伤所致的细胞凋亡,从而抗氧化应激损伤。
2.4 SIRT1调控PGC-1α
PGC-1α是过氧化物酶体增殖活化受体γ(peroxisome proliferator-activated receptor γ,PPAR-γ)的辅助活化因子,其结构主要由N-末端、活性区域、调节结构域、C-末端四部分组成。PGC-1α在抗氧化应激系统中起关键作用,其活性受到磷酸化、乙酰化、泛素化等多种方式调节[17]。研究表明,PGC-1α可能通过清除过量ROS、诱导抗氧化酶的表达、以及维持线粒体功能等发挥抗氧化应激损伤[18]。Tang[5]的研究发现SIRT1可通过去乙酰化PGC-1α而发挥调节代谢紊乱作用,减轻外界刺激所致的细胞损伤。Liang等[19]研究表明,SIRT1通过去乙酰化激活PGC-1α,清除氧化应激导致的ROS,减轻肠道氧化应激损伤。因此,SIRT1可通过去乙酰化激活PGC-1α的表达,从而抗氧化应激损伤。
2.5 SIRT1调控Nrf2
Nrf2是一种亮氨酸转录因子,由Neh 1-6六个结构域组成,在抗氧化反应元件(antioxidant response element,ARE)依赖的防御基因的转录调控中起着极其重要的作用。在生理情况下,Nrf2在胞质与抑制蛋白Keap1结合并以无活性的Nrf2-Keap1复合物形式存在,而当受到刺激时,Nrf2与Keap1解离进入细胞核内,与ARE相互作用,调节抗氧化基因如:谷胱甘肽S转移酶(glutathione stransferase,GST)、葡萄糖醛酸转移酶、血红素氧合酶等的表达,从而抗氧化应激损伤[20]。Tang等[6]研究表明,SIRT1可通过去改变Keap1的结构来激活Nrf2,导致Nrf2核转移,从而促进抗氧化基因的表达。此外,Huang等[21]的研究发现,白藜芦醇通过增加SIRT1的表达,可直接促进Nrf2的去乙酰化和随后的激活,最终导致Nrf2靶基因的上调以及更高的抗氧化能力。因此,SIRT1可通过直接或间接作用激活Nrf2,调节抗氧化基因表达,进而抗氧化应激损伤。
2.6 SIRT1调控HIF-1α
缺氧诱导因子家族(hypoxia induceble factor,HIF)包括HIF1、HIF2、HIF3三种,当组织缺氧处于氧化应激、炎症状态时,HIF表达增高。HIF可调节多种靶基因如:促红细胞生成素、血管内皮生长因子以及各种糖酵解酶,从而在血管形成、能量代谢、细胞存活、凋亡、维持细胞在缺氧条件的稳定性上发挥重要作用[22]。研究表明,HIF-1α的激活与氧化应激有关,可通过直接或间接作用调节ROS的形成[23]。目前,SIRT1调控HIF1在缺血再灌注诱导的氧化应激中研究较多。Shin等[7]在研究中发现,SIRT1升高后HIF-1α乙酰化水平降低,且当敲低SIRT1后,HIF-1α乙酰化水平明显升高,说明SIRT1通过调控HIF-1α乙酰化水平来抗肝脏缺血再灌注损伤。因此,SIRT1可通过调控HIF-1α,在氧化应激中发挥调节作用。
2.7 SIRT1调控AMPK
AMPK即AMP活化蛋白激酶,其活性是代谢动态平衡的主要调节因子,常在缺血、缺氧等氧化应激条件下被激活。AMPK可被肝脏激酶B1(liver kinase B1,LKB1)激活,激活后的AMPK可通过促进胰岛素敏感性、脂肪酸氧化和线粒体生物合成,产生ATP,从而减轻氧化应激损伤。研究表明SIRT1的过表达可导致LKB1的去乙酰化,从细胞核转移到细胞质,从而激活AMPK[24]。Wang等[8]的实验表明SIRT1激动剂SRT1720通过上调SIRT1可增加AMPK的表达,提高2型糖尿病大鼠抗氧化能力。由此可见,SIRT1可通过调控LKB1进而激活AMPK,从而抗氧化应激损伤,促进细胞存活。此外,有研究表明,SIRT1与AMPK是可以相互调节的,而且两者可分别通过乙酰化和磷酸化直接影响PGC-1α的活性[25],从而发挥抗氧化应激损伤作用。
2.8 SIRT1调控eNOS
eNOS主要在内皮细胞中表达,在心脏、血管氧化应激中发挥重要作用,其机制主要是通过产生一氧化氮(nitric oxide,NO)和抑制ROS的生成。而在氧化应激环境中eNOS功能发生障碍,导致ROS的生成增多,抑制NO的生物活性且不再产生NO。研究发现SIRT1在调节eNOS活性中起重要作用,通过上调SIRT1可以降低eNOS乙酰化(失活状态),增强eNOS磷酸化(激活状态)[9]。而且在目前各种缺血再灌注模型中,SIRT1/eNOS通路的激活已被证明能抑制氧化应激反应,从而改善缺血再灌注损伤。如:Li等[26]的体内外实验表明,通过激活SIRT1/eNOS通路可减少ROS的产生,抑制氧化应激反应,改善心肌缺血再灌注损伤。此外,在Guo等[27]的研究中发现激活SIRT1/eNOS通路可抑制H2O2诱导的氧化应激损伤,保护内皮细胞。因此,SIRT1可通过去乙酰化激活eNOS,从而抗氧化应激损伤。
2.9 SIRT1调控Ku70
Ku70是一种DNA修复蛋白,参与各种刺激所致的DNA损伤修复、细胞凋亡等。各种氧化应激损伤都可能导致DNA损伤。Takata等[28]研究表明,在通过辐射直接或间接氧化应激导致的DNA损伤后,Ku70蛋白表达明显升高,表明Ku70在辐射所致的DNA损伤过程中密切相关。Jeong等[10]在对辐射诱导的DNA损伤研究中发现,SIRT1通过去乙酰化Ku70,增强了辐射后DNA修复活性。此外,在生理条件下,促凋亡蛋白Bax与Ku70相结合,当受到氧化刺激时,Ku70发生乙酰化,两者发生解离,然后解离后的Bax定位线粒体膜,促进细胞凋亡。研究表明[29],SIRT1可使Ku70去乙酰化,使其与Bax的相互作用加强,进而减少Bax转移到线粒体膜上而减少大鼠生殖细胞凋亡,从而减轻细胞氧化应激损伤。因此,SIRT1可通过去乙酰化调控Ku70,从而抗氧化应激损伤。
2.10 SIRT1调控p66Shc
p66Shc是哺乳动物原癌基因ShcA蛋白家族一员,由于具有发挥氧化还原酶作用的胶原增殖学结构,因而在线粒体ROS的产生和对氧化应激信号的凋亡反应中发挥重要作用。研究发现p66Shc可通过激活NADPH氧化酶、下调抗氧化酶表达以及促进线粒体产生ROS等机制来增加细胞ROS水平,从而导致细胞氧化应激损伤[30]。Chen等[31]发现当SIRT1被抑制或敲除时,在氧化应激条件下,p66Shc的mRNA及蛋白表达升高,而SIRT1过表达时则抑制了p66Shc的上调。Zhou等[32]发现,SIRT1对P66Shc表达的调控主要是通过去乙酰化P66Shc启动子区域,从而抑制P66Shc的转录和表达。此外,Yan等[11]发现P66Shc的表达与SIRT1的表达呈负相关,且SIRT1介导的P66Shc表达抑制可以减轻肝脏缺血再灌注损伤。这些实验结果表明,P66Shc是SIRT1的靶点,其表达可以通过SIRT1的上调而降低。因此,SIRT1可通过去乙酰化调控P66Shc,从而抗氧化应激损伤。
3 总结与展望
综上所述,SIRT1可通过调控多种不同靶基因、靶蛋白,减轻各种氧化应激导致的细胞、组织损伤,从而参与机体的多种生理病理过程,在多种生物学过程中发挥重要作用。但氧化应激损伤是一个复杂的病理过程,其机制庞大而复杂,除了受到SIRT1影响之外,还受到其他因素的影响,各种抗氧化应激损伤机制间相互联系,相互调节,且目前已知的激活SIRT1表达的化合物较少。因此,未来应该更加深入了解SIRT1抗氧化应激损伤的具体分子机制,完全阐明SIRT1的作用,并开发能够调节其作用的药物,这对于治疗临床氧化应激所致相关疾病具有重要的意义。

