连作种植下不同抗重茬药剂处理对甜菜苗期生长的影响
崔汝菲, 路正禹, 耿 贵, 於丽华, 王宇光(黑龙江大学 现代农业与生态环境学院,哈尔滨150080)
0 引 言
连作(Continuous cropping)指在同一块土地上连续种植同种作物的农艺措施[1]。连作障碍,又称再植病害(Replant disease)[2],指实际生产过程中因连作而造成的作物生长不良、病虫害加剧以及产量下降的现象。连作障碍是现代农业可持续发展的瓶颈,也是影响农作物生产的关键性因素[3]。连作制度下,土壤养分匮缺、微生物群落失衡以及自毒物质积累均会影响植物的正常生长[4]。在中国,超过20%的土地遭受连作障碍所带来的影响[5]。Yasir等发现连作下棉花、花生、小麦以及茶树的病害发病率增加[6]。因此,如何缓解连作障碍已成为当下的研究热点。
甜菜(Beta vulgaris L.)是藜科甜菜属双子叶植物,作为世界第二大糖料作物[7],其约占全球糖料作物种植面积的三分之一[8],且提供世界30%的糖产量。此外,甜菜也是生物乙醇和动物饲料的来源[9]。随着近几年甜菜种植面积的增加,甜菜重茬连作经常发生,给甜菜的实际生产带来严重影响。林柏森等试验表明,连作多粒种甜菜较单作减产22 429 kg·hm-2,平均含糖降低2.58度[10]。本文通过研究重茬土下不同抗重茬药剂处理对甜菜幼苗生长指标及生理指标的影响,以期探寻重茬连作下甜菜苗期立枯病的有效防治措施,为保证生产实践中甜菜幼苗健康、延长生育期及提高甜菜产量等提供理论研究基础。
1 材料与方法
1.1 试验基本情况
供试药剂为噁霉灵、再植病防治液、沣润源菌剂和中国农大重茬剂,供试甜菜种子为“KWS1176”。
供试土壤为黑龙江大学呼兰校区(东经126°38′,北纬46°0′)二年重茬土,试验于黑龙江省哈尔滨市黑龙江大学现代农业与生态环境学院光照培养室中进行。
1.2 试验方法
1.2.1 试验设计
试验共设置1个空白处理和4个药剂处理:CK(空白对照)、T1(再植病防治液1∶200)、T2(沣润源菌剂1∶120)、T3(中国农大重茬剂1∶50)、T4(噁霉灵98%1∶1 000),每组处理8个重复,具体信息如表1所示。将黑龙江大学呼兰校区采集的重茬土壤按照表1的施用方法处理后,每盆放500 g,均匀放置20粒甜菜品种“KWS1176”种子,覆重茬土100 g。各处理每天定时浇等量的水,使土壤湿度保持一致,并定时调换各处理的位置使其光照保持一致。

表1 试验处理及药剂用量Table 1 Experimental treatments and dosage
1.2.2 测定项目与方法
记录播种后不同处理甜菜的发芽数和发病数,参考卢明艳的方法[11]计算甜菜幼苗的发芽率和发病率。计算公式如下:

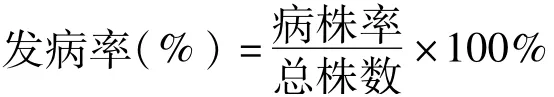
将收获的5组不同处理的甜菜幼苗叶片选取一部分进行干、鲜重称重,每处理选取5株幼苗,采用游标卡尺测定株高;甜菜鲜重用分析天平称取,然后在烘箱105℃杀青20 min,80℃烘干至质量恒重,测其干重。将其他甜菜幼苗叶片剪碎,并按0.5 g一份准确称量,以便后续试验。参照李合生的方法[12]测定甜菜叶片的丙二醛(MDA)含量、超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)活性、相对电导率和叶绿素含量;参考侯占山的方法[13]测定脯氨酸、可溶性蛋白和可溶性糖含量。使用CI-340手持式光合作用测量系统对光照培养室种植的植物进行光合作用测量[14],在晴天8∶30~11∶30选取不同处理的植株,测定植株最顶端叶片的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr),上述测定每个指标重复3次。
1.3 数据分析
采用SPSS 26软件对试验数据进行统计学分析;采用单因素方差分析(ANOVA)和最小显著性差异(LSD)方法,以P<0.05为显著性水平评价效果;采用Pearson方法进行相关性分析;采用Microsoft Excel 2019软件进行数据整理和绘图。
系统网络结构包括:主/备历史数据服务器、主/备实时监测服务器、主/备隔离装置、主/备WEB服务器、主/备通信服务器、主/备数据服务器、交换机、集控中心工作中、各电站侧测点数据。
2 结果与分析
2.1 重茬条件下不同抗重茬药剂对甜菜幼苗生长状况的影响
植物生长表型能反映其适应重茬环境的能力[15]。如图1(a)所示,重茬条件下不同抗重茬药剂对甜菜株高促进效果明显,药剂处理组表型与CK相比差异明显,各组株高均高于CK。从抗重茬药剂处理甜菜幼苗的生长表现来看,T2株形高大,根系发达,且已经长出第二对真叶(图1)。T3甜菜生长状况仅次于T2,子叶下轴生长良好,叶片翠绿。T1植株与T2、T3相比长势稍弱,T4长势较弱,叶片发黄偏小,但根部基本没有病变。CK立枯病发病症状明显,茎呈淡褐色,在基部有赤色霉状物,茎叶变黄呈凋萎状,子叶下轴至幼根干枯变黑。

图1 重茬条件下施用不同抗重茬药剂时甜菜幼苗生长情况表型(a)和单株(b)对比Fig.1 Effects of different anti-recropping agents on growth of phenotype(a)and single plant(b)of sugar beet seedlings under continuous cropping conditions
从表2可以看出,不同抗重茬药剂处理下,各组发芽率无显著差异。各处理株高均大于CK,较CK分别增加了16.50%、47.54%、29.31%和17.73%。从发病情况来看,各组甜菜立枯病发病率均显著低于对照组(P<0.05),T4株高较其他组稍低,但发病率最低,盆栽中几乎无立枯病的发生。T2株高最高,其发病率仅次于T4,该药剂能够明显促进其生长。以上结果表明,药剂处理有助于植物生长,降低发病率。

表2 重茬条件下不同抗重茬药剂对甜菜种子发芽率和幼苗发病率的影响Table 2 Effects of different anti-recropping agents on the germination rate and seedling incidence rate of sugar beet seeds under continuous cropping conditions
由图2可知,4组处理的干重、鲜重均大于对照组,其中T1、T2、T3与对照组均具有显著性差异(P<0.05)。甜菜幼苗干、鲜重与株高一致,各组鲜重较CK分别增加了55.71%、148.82%、104.72%和39.57%,各组干重较CK分别增加了70.17%、128.72%、125.28%和55.11%,其中T2的干、鲜重增长最多。以上结果表明,药剂处理可以促进甜菜的物质积累。

图2 重茬条件下不同抗重茬药剂对甜菜幼苗鲜重(a)和干重(b)的影响Fig.2 Effects of different anti-recropping agents on fresh weight(a)and dry weight(b)of sugar beet seedlings under continuous cropping conditions
2.2 重茬条件下不同抗重茬药剂对甜菜幼苗细胞膜透性的影响
MDA作为膜脂过氧化产物,能够直观反映植物膜脂的过氧化程度;相对电导率是衡量植物遭受外界胁迫时细胞膜损伤程度的生理指标[16]。如图3(a)所示,对照组甜菜幼苗叶片细胞内的MDA含量最高,各处理组较CK分别减小了8.06%、1.46%、17.35%和11.53%,其中T1、T3和T4与CK具有显著性差异(P<0.05),T3组MDA含量最小。试验结果表明,重茬障碍下甜菜叶片细胞内的MDA含量明显下降,以中国农大重茬剂处理变化最为明显。
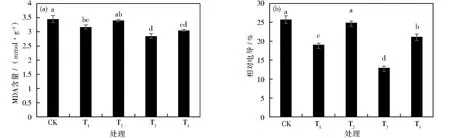
图3 重茬条件下不同抗重茬药剂对甜菜幼苗叶片相对电导率(a)和MDA(b)的影响Fig.3 Effects of different anti-recropping agents on relative conductivity(a)and MDA(b)of sugar beet seedling leaves under continuous cropping conditions
由图3(b)可知,对照组的甜菜叶片相对电导率最高,平均为25.76%左右。当甜菜幼苗在重茬土条件下施用不同抗重茬药剂处理后,各处理叶片相对电导率均有下降,T2与CK比较变化不显著,较CK下降了3.37%,T1、T3和T4较CK分别降低25.88%、49.64%和17.8%。以上表明,四组抗重茬药剂处理的相对电导率和MDA均较CK下降,药剂处理能够降低甜菜叶片的MDA和相对电导率,从而减轻植物膜脂过氧化和细胞膜损伤。
2.3 重茬条件下不同抗重茬药剂对甜菜幼苗抗氧化酶系活性的影响
在外界胁迫条件下,植物的需氧细胞会产生活性氧簇(ROS),造成膜脂过氧化,使细胞膜流动性和通透性发生改变,导致植物发生生理紊乱。在植物的活性氧清除系统中,SOD、POD、CAT和APX起着关键性作用,这些酶能够保护细胞免受活性氧毒害。在不同抗重茬药剂处理下,各处理POD、CAT均较CK下降,SOD除T2外均小于CK。
从图4(a)可以看出,不同抗重茬药剂处理下,甜菜叶片的POD活性与CK呈差异显著性(P<0.05),较CK分别下降了28.33%、26.67%、40.00%和25.00%。各处理以T3组POD活性最低,T4最高。由图4(b)可知,各处理SOD活性均与CK存在显著差异性(P<0.05),除T2外,其他处理均小于CK,分别较CK降低了16.60%、25.06%和12.85%。T2高于CK,较CK上升了11.73%。

图4 重茬条件下不同抗重茬药剂对甜菜幼苗叶片POD活性(a)和SOD活性(b)的影响Fig.4 Effects of different anti-recropping agents on POD activity(a)and SOD activity(b)of sugar beet seedling leaves under continuous cropping conditions
由图5(a)可以得出,各组CAT活性均较CK出现不同幅度的下降,较CK分别降低了5.33%、6.21%、11.14%和2.07%,其中T3下降幅度最大,与CK呈差异显著性(P<0.05)。由图5(b)可以看出,各组APX活性与CK无明显差异,T2和T4的APX活性均大于CK,两组较CK分别上升了16.44%和15.07%。T1和T3的APX活性均小于CK,较CK分别降低了13.69%和6.85%。

图5 重茬条件下不同抗重茬药剂对甜菜幼苗叶片CAT活性(a)和APX活性(b)的影响Fig.5 Effects of different anti-recropping agents on CAT activity(a)and APX activity(b)of sugar beet seedling leaves under continuous cropping conditions
由上述分析可知,不同抗重茬药剂处理后,甜菜幼苗的各抗氧化酶活性较CK发生变化,其中T1、T3的叶片POD、SOD、CAT和APX活性均小于CK,而T2处理下,POD和CAT活性小于CK,SOD和APX均大于CK。T4处理除APX高于CK活性,其他酶活性均小于CK。

图6 重茬条件下不同抗重茬药剂对甜菜幼苗叶片脯氨酸的影响Fig.6 Effects of different anti-recropping agents on proline of sugar beet seedling leaves under continuous cropping conditions
2.4 重茬条件下不同抗重茬药剂对甜菜幼苗渗透调节物质的影响
从图6可以看出,在药剂的作用下,甜菜幼苗的脯氨酸含量发生变化,其中T2、T3与CK之间呈显著差异性(P<0.05),分别升高了102.46%、73.24%。T1、T3与CK无明显差异,T1较CK下降了4.82%,T3较CK升高了7.17%。不同抗重茬药剂处理能够改变甜菜叶片中脯氨酸含量,从而维持细胞渗透压平衡。
不同抗重茬药剂处理下甜菜幼苗的渗透调节物质可溶性糖和可溶性蛋白的含量如图7所示,各处理除T2外均大于CK。由图7(a)可见,T1、T3和T4甜菜幼苗叶片内可溶性糖含量较CK相比均有不同程度上升,T1上升程度最为显著(P<0.05),可溶性糖含量较CK增长92.67%,T3和T4较CK分别升高了67.97%和24.27%,且T3与CK呈差异显著性(P<0.05),而T2较CK下降16.23%。由图7(b)可见,不同处理下甜菜叶片中可溶性蛋白含量比CK分别升高了12.78%、10.75%、11.95%和4.31%,T2的可溶性蛋白含量最高。不同药剂处理后,除T2组可溶性糖含量下降,其他组甜菜叶片的可溶性蛋白和可溶性糖均升高,从而降低细胞的渗透势和水势,促进细胞吸水,抵御外界不良影响。
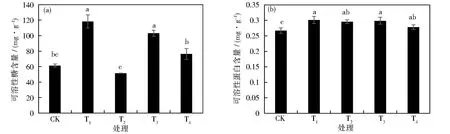
图7 重茬条件下不同抗重茬药剂对甜菜幼苗叶片可溶性糖(a)和可溶性蛋白(b)的影响Fig.7 Effects of different anti-recropping agents on soluble sugar(a)and soluble protein(b)of sugar beet seedling leaves under continuous cropping conditions
2.5 重茬条件下不同抗重茬药剂对甜菜幼苗叶片光合作用相关参数的影响
从图8可以看出,在不同抗重茬药剂处理下,甜菜幼苗叶片的叶绿素含量和Pn趋势基本一致,各组处理均大于CK。由图8(a)可知,各处理的甜菜幼苗叶绿素含量与CK相比分别上升了39.50%、19.17%、34.20%和7.84%,其中T1、T2和T3与对照组呈现差异显著性(P<0.05),且T1的叶片叶绿素含量最多。从图8(b)可以看出,各组Pn较CK分别增加了33.05%、51.97%、148.60%和0.80%,其中T3、T2与CK呈现差异显著性(P<0.05),且T3的Pn最高,该药剂对植株Pn有明显促进作用。
从图9可以看出,在不同抗重茬药剂处理下,甜菜幼苗叶片的Gs和Tr趋势基本一致,各组处理均大于CK。由图9(a)可知,各处理的甜菜幼苗Gs与CK相比分别上升了13.74%、53.79%、30.18%和0.12%,其中T2叶片气孔导度最高,T4最低。从图7(b)可以看出,各处理叶片Tr与CK呈差异显著性(P<0.05),较CK分别增加了19.05%、51.86%、127.51%和13.76%。T3的Tr最高,与CK存在极显著差异(P<0.05)。

图8 重茬条件下不同抗重茬药剂对甜菜幼苗叶片叶绿素(a)和净光合速率(b)的影响Fig.8 Effects of different anti-recropping agents on chlorophyll(a)and net photosynthetic rate(b)of sugar beet seedling leaves under continuous cropping conditions

图9 重茬条件下不同抗重茬药剂对甜菜幼苗叶片气孔导度(a)和蒸腾速率(b)的影响Fig.9 Effects of different anti-recropping agents on stomatal conductance(a)and transpiration rate(b)of sugar beet seedling leaves under continuous cropping conditions
2.6 重茬条件下不同抗重茬药剂下甜菜幼苗各指标相关性分析
计算甜菜幼苗种子发芽率、幼苗发病率、生长和生理指标之间的相关性,结果如表3所示。

表3 重茬条件下不同抗重茬药剂下甜菜幼苗各指标相关性分析Table 1 Correlation analysis of different anti-recropping agents on sugar beet seedling indexes under continuous cropping conditions

续表
甜菜幼苗发病率与干重、鲜重、株高、相对电导率、抗氧化酶系和脯氨酸基本呈负相关关系,且与脯氨酸和APX呈显著负相关,表明发病率与植物生长指标、细胞膜透性、抗氧化酶系和脯氨酸有负相关关系。甜菜幼苗干重、鲜重、株高存在极显著正相关关系,且干重、鲜重均与Pn、Tr和Gs存在显著正相关关系,与相对电导率存在显著负相关关系,表明植物生长指标与光合作用有极显著正相关关系,而与细胞膜透性存在负相关关系。可溶性糖、可溶性蛋白和脯氨酸三者均为渗透调节物质,可溶性糖、可溶性蛋白存在极显著正相关,且两者均与脯氨酸呈显著负相关。此外,四种抗氧化酶活性中POD与CAT呈极显著相关性,SOD与APX呈显著相关性。
3 讨 论
在实际生产中,甜菜的重茬连作现象屡见不鲜,且病害日益加重[17]。甜菜立枯病是甜菜苗期主要土传病害,重茬连作条件下立枯病发病率升高,影响甜菜的产量和质量。在正常情况下,植株体内的活性氧处于动态平衡状态,连作障碍使甜菜体内的活性氧平衡被破坏,植物体内的H2O2和MDA含量可以反映植物的活性氧水平。植株在活性氧诱导下产生SOD,SOD催化超氧自由基生成H2O2,然后产生CAT、APX[18]和POD,以减少H2O2,而植株MDA含量则依靠SOD和POD来降解,以保持ROS的动态平衡[19]。试验表明,不同药剂处理下相对电导率和MDA含量均小于CK,由此推测药剂处理能够减少环境胁迫对植株活性氧水平的影响。再植病防治液和中国农大重茬剂处理下,甜菜叶片的抗氧化酶活性均小于CK,由此推测抗氧化酶活性降低与两组药剂施用有关。沣润源菌剂处理下,甜菜幼苗的相对电导率和MDA含量较CK变化较小,POD和CAT活性均低于CK,而SOD和APX活性高于CK,由此推测该处理通过提高SOD和APX活性降低H2O2和MDA含量,从而维持活性氧动态平衡。噁霉灵喷施处理下,幼苗发病率最低,其APX高于CK,推测噁霉灵处理通过增加APX活性来维持ROS动态平衡。
渗透调节物质可以调节植物细胞渗透压平衡,防止细胞脱水[16]。本试验表明,不同药剂处理下渗透调节物质出现不同程度的上升,中国农大重茬剂和噁霉灵处理下三种渗透调节物质均有不同程度的升高,施用再植病防治液使脯氨酸和可溶性蛋白升高,沣润源菌剂增加可溶性糖和可溶性蛋白的含量。因此,推测各处理通过增加三种渗透调节物质的含量来调节渗透压平衡,缓解重茬连作障碍对植株的影响。
Pn是表示光合作用强弱变化的核心指标之一,蒸腾速率指植株在单位时间内,单位叶面积通过蒸腾作用散失的水量。气孔导度与气孔的大小和开放程度有关,植物的蒸发速率和蒸腾速率较高则表明其气孔导度较高[20-21]。周振翔等的研究表明,植物叶片中叶绿素的含量与光合作用呈正相关[22]。本试验得出,甜菜幼苗叶片的叶绿素含量、Pn、Gs和Tr趋势基本一致,且均大于CK处理。叶绿素、Pn、Gs和Tr呈正相关,其中沣润源菌剂和中国农大重茬剂处理光合作用最强,这与其表型一致,两组对甜菜的光合作用均有明显促进作用。李勇等的研究表明,大部分水稻叶片吸收的光远超其自身光合所需,即叶绿素呈现“冗余”现象[23]。再植病防治液处理组叶绿素含量与中国农大重茬剂处理组相差不大,但Pn、Gs和Tr相差较大,由此推测再植病防治液处理组的叶绿素呈现“冗余”现象。
试验结果表明,沣润源菌剂可明显增加甜菜幼苗的株高、干鲜重,并降低发病率;中国农大重茬剂能明显促进植株的光合作用;喷施噁霉灵可最大程度降低立枯病发病率;再植病防治液防治效果较弱。沣润源菌剂主要成分有抗病菌和低温菌,能够降低幼苗的发病率,促进其生长;中国农大重茬剂主要是防治甜菜根部病害,能够降低幼苗发病率,促进其光合作用;噁霉灵是新型抗重茬药剂,为湿粉剂,于出苗时对根部进行喷施,能够有效抑制立枯丝核菌菌丝的正常生长,与土壤中的金属离子产生反应,加强药剂效果。再植病防治液是防治镰刀菌立枯病和根腐病的菌种,因而对立枯病防治效果较弱。
4 结 论
重茬连作下不同药剂的施用对甜菜幼苗的生长指标、生理指标以及光合指标影响不同。药剂处理不仅能降低甜菜幼苗立枯病的发病率,而且有助于植株维持ROS、渗透压动态平衡以及促进其光合作用。在实际生产过程中,建议重茬地种植甜菜时选用沣润源菌剂或中国农大重茬剂,并配合喷施噁霉灵,从而缓解重茬连作对甜菜幼苗的影响,提高甜菜产量和质量。

