极低/超低出生体质量儿晚发型败血症死亡相关因素分析
詹媛丽 彭海波 张敏 李惠玲 梁小琴 陈幽
极低/超低出生体质量儿由于自身免疫功能低下、有创操作多及住院时间长,容易发生晚发型败血症,且疾病临床表现无特异性[1-2],国外报道疾病死亡的高危因素包括男性、革兰阴性菌感染、气管插管、血小板减少、合并休克、NEC、颅内出血(intraventricular hemorrhage,IVH)等[2],国内相关临床对照研究的报道较少。本研究回顾性分析66例V/ELBWI并发血培养确诊LOS的临床资料,探索V/ELBWI并发LOS死亡的危险因素,为降低V/ELBWI死亡率提供临床依据。
1 资料与方法
1.1 一般资料
选取2016年9月—2019年12月广东省深圳市宝安区妇幼保健院新生儿科收治的66例出生体质量<1 500 g,血培养阳性,诊断LOS[3]的新生儿为研究对象。根据预后分为死亡组(51例)和治愈组(15例)。纳入标准:出生体质量<1 500 g;生后72 h出现异常临床表现;血液培养阳性。排除标准:(1)先天性发育畸形及免疫缺陷性疾病;(2)遗传代谢性疾病。
1.2 研究方法
比较两组病例临床资料,找出死亡相关及独立危险因素。
1.3 观察指标
基础资料:(1)一般资料:孕母年龄、产次、分娩方式、羊水情况、胎膜早破、出生医院、急性绒毛膜羊膜炎、Apgar评分[4]、胎龄、出生体质量等;(2)发病前治疗情况:有创血管置管,有创辅助通气,抗生素使用;(3)发病时临床表现:发热,呼吸暂停,气促,反应差,皮肤苍白,心率增快,消化道症状(包括腹胀、呕吐或积乳等):(4)并发症:DIC,感染性休克,化脓性脑膜炎,IVH,NEC,胆汁淤积症,支气管肺发育不良(bronchopulmonary dysplasia,BPD)。
实验室数据:血液或脑脊液培养,全血细胞计数中白细胞计数(white blood cell,WBC),血小板计数(blood platelet,PLT),超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)等。
实验室数据处理:根据发病时间将WBC、hs-CRP、PLT等记为:指标1:发病后0~6 h(出现症状6 h内留取标本,如发病后6 h内未抽血送检,第一次结果为缺失值);指标2:发病后6~24 h;指标3:发病24~72 h;指标4:发病后3~5 d;指标5:发病后5~7 d。
实验室指标异常相关定义:WBC减少是指WBC<5×109/L;PLT减少指PLT<150×109/L。hs-CRP升高指hs-CRP≥8 mg/L。
1.4 统计学方法
用SPSS 21.0软件进行数据处理,两组间计数资料描述采用例(%),比较采用χ2检验或Fisher精确概率法,不同胎龄、出生体质量、发病前抗生素使用天数比较采用趋势χ2检验;计量资料:正态分布的计量资料采用(±s)表示,组间比较采用t检验;偏态分布计量数据的描述采用M(P25,P75),组间比较采用非参数检验秩和检验。以P<0.05为差异有统计学意义。多因素分析使用Logistic回归分析,自变量的选择,按α入=0.05,α出=0.1的标准,采用前进法进行回归分析。(依据《医学统计学》人卫版)。
2 结果
2.1 临床资料情况
2016年9月—2019年12月间,共收治出生体质量<1 500 g的新生儿538例,其中<1 000 g超低出生体质量儿154例,66例发生晚发型败血症,发病率为12.27%(66/538)。革兰阴性菌37例(56.06%),革兰阳性菌22例(33.33%),真菌10例(15.15%)(其中有3例先后培养出G-杆菌和真菌)。常见致病菌为:肺炎克雷伯菌13例,表皮葡萄球菌9例,鲍曼不动杆菌9例,粘质沙雷氏菌7例,金黄色葡萄球菌6例,其他的致病菌包括:阴沟肠杆菌4例,席木龙念珠菌4例,头状念珠菌3例,医院不动杆菌2例,溶血葡萄球菌2例,白色念珠菌2例,似平滑念珠菌1例,李斯特菌1例,弗劳地柠檬酸杆菌1例,粪肠球菌1例,伊丽莎白菌1例。其中1例先后为大肠埃希菌及席木龙念珠菌感染,1例先后为粘质沙雷氏菌及席木龙念珠菌感染,1例先后为阴沟肠杆菌及似平滑念珠菌,本文统计选取第一次晚发型败血症致病菌。死亡15例,病死率为22.73%。
2.1.1 一般情况 两组孕母年龄、产次、分娩方式、胎膜早破、出生地点、羊水污染、绒毛膜羊膜炎等,新生儿性别、发病日龄、Apgar评分、肺透明膜病等的差异无统计学意义(P>0.05)。胎龄小、出生体质量低,病死率高,且随着胎龄减小、出生体质量减低,病死率逐渐增高(P<0.05),见表1。
2.1.2 发病前后治疗情况 由表2可见,脐静脉置管及置管天数、脐动脉置管、PICC置管,使用抗生素、使用抗生素大于3天等两组间的差异无统计学意义(P>0.05)。死亡组发病前接受3种及以上抗生素、抗生素使用时间超过7天、脐动脉置管天数、有创机械通气等高于治愈组(P<0.05)。而发病后到抗生素使用时间两组比较,差异无统计学意义(P>0.05)。
2.1.3 临床表现及并发症 见表3,两组病例发病时心率增快差异无统计学意义(P>0.05),而死亡组出现皮肤苍白及消化道症状高于治愈组(P<0.05)。死亡组发生 DIC、NEC、感染性休克比例明显高于对照组(P<0.05)。
2.2 实验室资料情况

表1 两组胎龄及出生体质量比较

表1 (续)
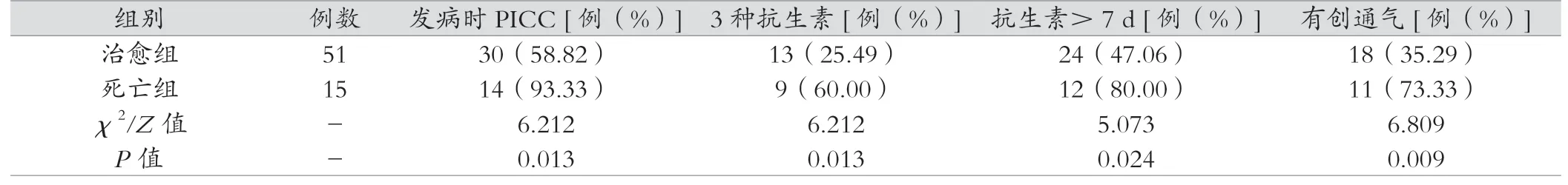
表2 两组发病前治疗情况比较

表2 (续)

表3 两组病例临床表现及合并症比较 [例(%)]
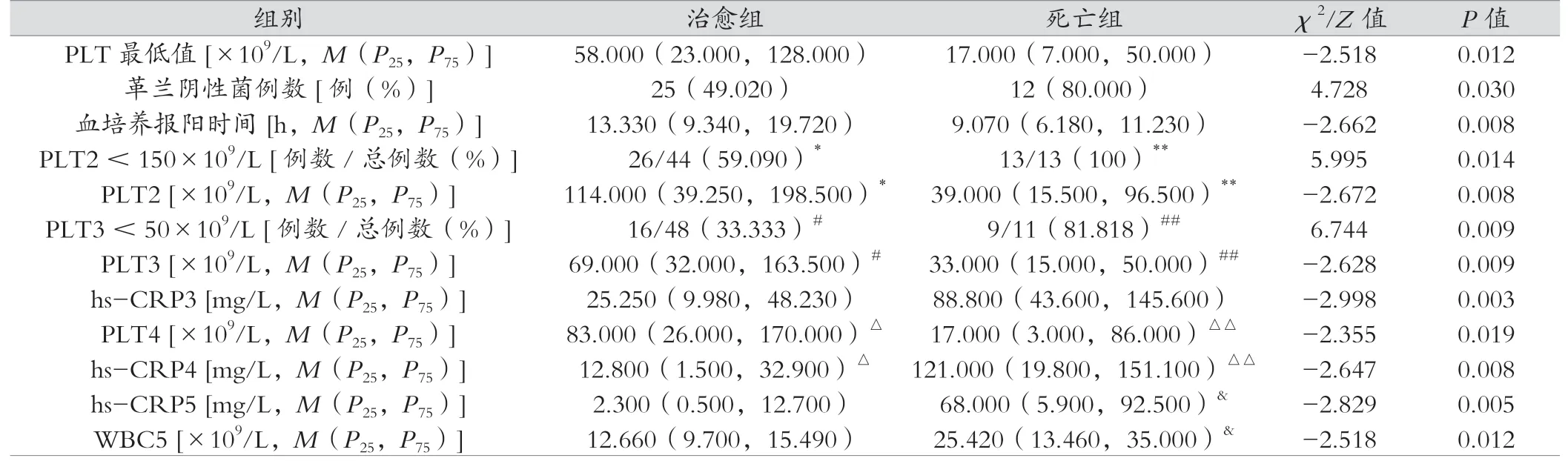
表4 两组多次实验室结果比较

表5 多因素Logistic回归分析
分别将两组发病后第1到5次的血液分析、超敏CRP统计学分析,发现第1次的WBC、PLT计数、hs-CRP均无统计学差异。表4可见:死亡组PLT<150×109/L(第2次)、PLT<50×109/L(第3次)的发生率高于治愈组(P<0.05)。死亡组第2次、第3次、第4次PLT值低于治愈组(P<0.05),第3次、第4次、第5次hs-CRP高于治愈组(P<0.05)。死亡组最低PLT值、细菌培养报阳时间低于治愈组,死亡组革兰阴性菌比例高于治愈组(P<0.05)。其余实验室指标两组比较,差异均无统计学意义,P>0.05。
2.3 多因素Logistic回归分析
胎龄、合并感染性休克、NEC、PLT3(即发病24~72 h PLT计数)是V/ELBWI并发LOS死亡的独立危险因素(P<0.1),见表5。
3 讨论
LOS是V/ELBWI常见并发症,为医院获得性感染,是导致该人群院内死亡的重要原因之一。国外报道V/ELBWI并发LOS发病率为12.2%~24.0%,病死率 10.6~26.6%,胎龄越小,病死率越高[4]。本文发病率为12.27%,病死率为22.73%,小于26周病死率50%,小于750 g病死率37.50%,病死率随着胎龄及出生体质量减低逐渐升高,胎龄小是LOS死亡的独立危险因素。
本研究中,V/ELBWI并发LOS死亡与发病前有创操作包括PICC、有创通气等有关,与国内外报道一致[1,5]。V/ELBWI住院时间长,常接受机械通气、中心静脉置管、脐血管置管等有创操作,而需要长时间血管内置管及有创机械通气的V/ELBWI病情更危重;且有创置管破坏皮肤及黏膜屏障、输液污染的风险、静脉营养中的脂肪乳剂有利于细菌生长等原因导致LOS的发生[5]。本文中,脐动脉置管与病死率高有关,未见文献报道,考虑原因:脐动脉置管病例,均为循环功能障碍,需有创动脉血压监测,病情危重,病死率高。
本研究中,发病前使用三种及以上抗生素、抗生素使用时间长的LOS病例死亡率高。国内外研究发现抗生素暴露是V/ELBWI发生LOS的独立危险因素[1,6]。Cantey等[6]发现V/ELBWI早期使用抗生素导致LOS、NEC的发病率及病死率升高,与抗生素使用时长呈正相关。抗生素可杀灭新生儿体内的共生菌,使肠道菌群多样性消失,变形杆菌(如大肠杆菌、肺炎克雷伯菌等)激增,导致NEC和LOS[7]。
新生儿LOS早期临床症状无特异性[3],本研究中,死亡组早期出现末梢循环障碍及消化系统异常症状的比例高,发病初期诊断感染性休克及NEC的病例病死率高。NEC导致V/ELBWI肠道屏障功能受损,肠道菌群通过受损黏膜进入血液系统,诱发LOS;而LOS所致全身炎症反应及循环障碍,可引起肠道缺血缺氧,发生局部炎症反应,诱发NEC[7]。LOS与NEC互为因果,且NEC增加了LOS治疗难度,使病死率增加。
本研究中,血小板减少且难以恢复的LOS病死率高。Ree等[8]发现合并血小板减少的败血症新生儿死亡风险升高4倍,是疾病预后不良的敏感指标。病理机制为:败血症时血小板生成速度增快,但感染引发的DIC、细菌毒素对血小板的破坏等导致血小板的消耗速度大于其生成速度,从而导致血小板减少[9]。本研究中,两组hs-CRP,发病后24 h内差异无统计学意义,P>0.05,而24~72 h、3~5 d、6~7 d hs-CRP,死亡组高于治愈组,说明感染难以控制导致死亡。动态监测PLT及hs-CRP,有助于评估病情的严重程度及预后。
本文中,G-菌(37例,56.06%)为主要致病菌,80%死亡病例为G-菌感染,与国内文献类似[1,10],可能与G-菌产生内毒素血症引起“瀑布样炎症反应”及DIC有关[11];死亡组血液培养报阳时间较治愈组短,原因可能与细菌种类及送检标本的细菌初始浓度有关,G-杆菌中的肠杆菌科(如大肠埃希菌、肺炎克雷伯菌等)培养报阳时间最短,细菌浓度与临床严重程度及预后密切相关[12]。临床上,对于培养报阳时间短的LOS,需警惕预后不良可能。
总之,避免小胎龄早产,规范使用抗生素,减少侵入性操作及缩短使用时间,对可疑败血症V/ELBWI及时抗感染治疗,动态监测PLT及hs-CRP等,积极处理感染性休克、NEC等并发症,有望提高救治成功率。

