Super-ARMS PCR和ddPCR检测晚期肺腺癌患者血浆循环肿瘤DNA EGFR基因T790M突变的临床价值研究
许万星,王 琳,郭巧梅,黄 霞,娄加陶
上海交通大学附属胸科医院检验科,上海 200030
有研究表明,表皮生长因子受体抑制剂(EGFR-TKI)在晚期非小细胞肺癌的治疗中取得突破性进展,对表皮生长因子受体(EGFR)基因药物敏感性的突变患者,EGFR-TKI的疗效明显高于标准化疗方案[1-2]。但是约50%耐药患者经EGFR-TKI治疗后可检测到T790M突变[3]。第三代靶向药物对经过第一、二代EGFR-TKI治疗后耐药患者有良好的效果[4]。研究证实肺癌患者外周血中循环肿瘤DNA(ctDNA)可用于检测EGFR突变和EGFR-TKI疗效监测[5-7]。目前,临床实验室检测ctDNA基因突变常用的方法包括超级扩增阻滞突变系统PCR(Super-ARMS PCR)、微滴式数字PCR(ddPCR)等。Super-ARMS PCR检测特异度高,但灵敏度相对较低[8]。ddPCR检测灵敏度高且绝对定量。本研究以经过EGFR-TKI治疗后耐药的晚期肺腺癌患者为研究对象,分别采用Super-ARMS PCR和ddPCR检测ctDNA中T790M突变,比较2种方法的一致性和检出率,同时讨论检出率与用药时间的相关性。
1 资料与方法
1.1一般资料 收集2018年6月至2019年12月本院确诊的肺癌患者124例。纳入标准:(1)经病理组织和分子分型确认为EGFR敏感突变型腺癌;(2)接受EGFR-TKI治疗,根据实体瘤的临床疗效评估标准出现一个或多个新病灶和(或)存在非目标病灶进展;(2)临床资料完整,包括性别、年龄、吸烟史、肿瘤分期、病理组织类型、用药时间和随访等。(3)有充足的血液标本。排除标准:(1)合并有严重心血管系统疾病;(2)近期内使用过免疫抑制剂。本研究经本院医学伦理委员会批准,患者均签署知情同意书。患者一般资料见表1。
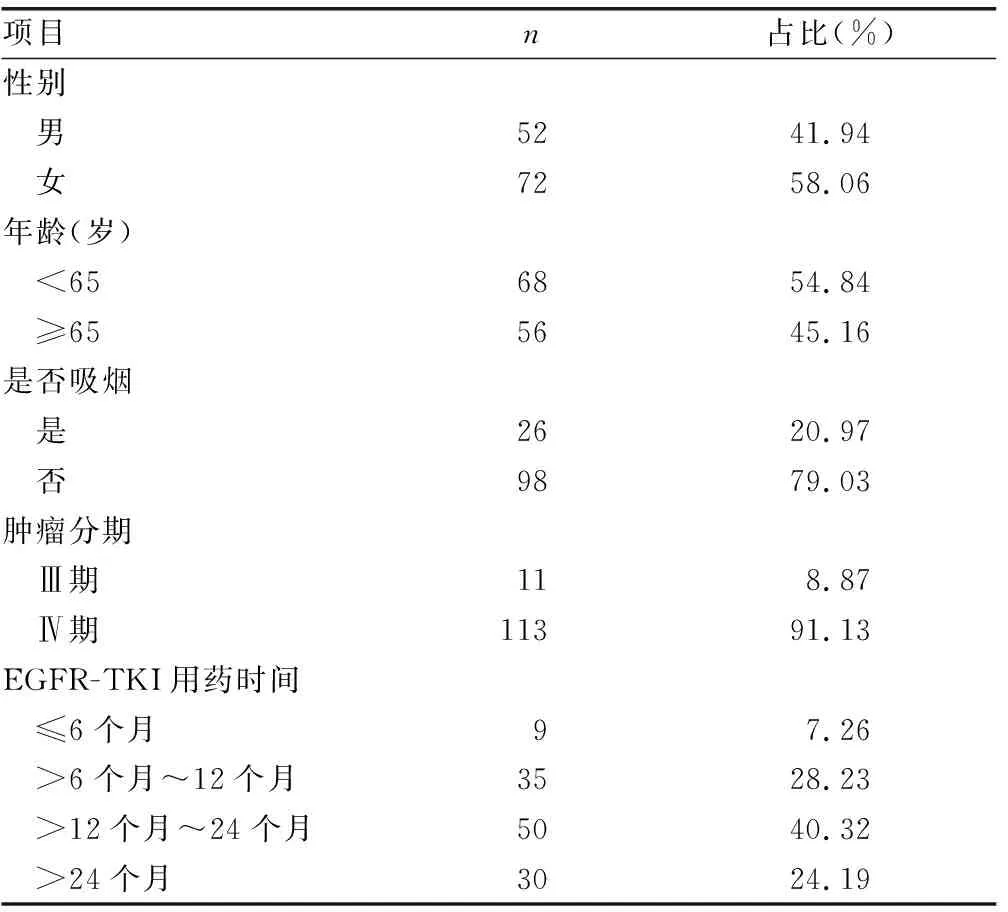
表1 患者一般资料
1.2仪器与试剂 ABI 7500实时荧光定量PCR仪、QubitTM荧光定量仪均购自美国Thermo Fisher Scientific公司;QX200TMDroplet DigitalTMPCR System ddPCR仪、QX200 Droplet微滴生成仪、微滴阅读仪、ddPCRTMSupermix for Probes(No dUTP)、ddPCRTMprobe assay Kit均购自美国Bio-Rad公司;DK-S12型电热恒温水浴锅购自上海森信实验仪器有限公司;OSE-100C恒温金属浴购自北京天根生化科技有限公司;YB-DX23D电动吸引器购自上海斯曼峰有限公司;QIAamp游离核酸纯化试剂盒购自德国Qiagen公司;人类EGFR基因突变检测试剂盒(多重荧光PCR法)购自厦门艾德生物医药公司。
1.3方法
1.3.1标本采集 使用一次性乙二胺四乙酸真空抗凝采血管,采集患者静脉血8~10 mL,以1 600×g在4 ℃下离心10 min分离上层血浆,以16 000×g在4 ℃下离心10 min,再次分离上层血浆,-80 ℃保存备用。血浆需在采集后2 h内完成分离。
1.3.2血浆ctDNA提取 取上述血浆4~5 mL,按照QIAamp游离核酸纯化试剂盒说明书的操作步骤进行血浆ctDNA提取。采用QubitTM荧光定量仪测定提取的核酸浓度,取吸光度(A260/A280)在1.8~2.0的合格标本用于后续EGFR基因检测。
1.3.3EGFR基因检测 EGFR基因分别使用Super-ARMS PCR法和ddPCR法进行检测。Super-ARMS PCR法采用人类EGFR基因突变检测试剂盒。按照操作流程检测T790M的突变情况。使用ABI 7500实时荧光定量PCR仪,探针模式设为Reporter Dye:FAM、VIC、ROX、CY5;Quencher Dye:TAMRA;Passive Reference:NONE。总反应体系72 μL:2.5 μL P-EGFR反应液,67.5 μL待测样品;2 μL P-EGFR混合酶。PCR反应程序:95 ℃ 10 min,1个循环;95 ℃ 40 s,64 ℃ 40 s,72 ℃ 30 s,15个循环;93 ℃ 40 s,60 ℃ 45 s,72 ℃ 30 s,28个循环;第三阶段60 ℃收集FAM/VIC/ROX/CY5信号。
ddPCR法应用ddPCRTM探针检测试剂盒。反应体系22 μL:EGFR ddPCR Supermix 10 μL,ddPCR T790M探针引物2 μL,待测DNA 10 μL。将反应体系放入8通道微滴生成器中。将生成微滴于QX200TMDroplet DigitalTMPCR System ddPCR仪上进行扩增。PCR反应程序:95 ℃ 10 min;94 ℃ 30 s,70 ℃ 60 s,72 ℃ 30 s,40个循环;98 ℃温浴10 min,最后置于4 ℃。PCR反应后,将96孔板置于微滴阅读仪中,检测微滴荧光信号。采用QuantaSofrt软件分析,2个及以上微滴出现FAM信号阳性时,判断此标本为阳性,否则为阴性。根据泊松分布原理及阳性微滴的个数与比例,即可得出靶分子的起始拷贝数或浓度。
1.4统计学处理 采用SPSS20.0统计软件进行数据处理分析,计量资料以例数和百分率表示,组间比较采用χ2检验,一致性分析采用Kappa检验,以P<0.05为差异有统计学意义。
2 结 果
2.1Super-ARMS PCR法与ddPCR法检测结果比较 124例患者分别进行ddPCR法与Super-ARMS PCR法检测EGFR基因T790M突变。其中Super-ARMS PCR法检出T790M突变38例(占30.65%),ddPCR法检出T790M突变50例(占40.32%)。2种方法检测结果一致性较好(Kappa=0.756,P<0.001)。ddPCR与Super-ARMS PCR法的阳性符合率为74.00%(37/50),阴性符合率为98.65%(73/74),总符合率为88.71%(110/124)。14例标本在2种检测方法中结果出现差异,其中13例在Super-ARMS PCR法中检测为阴性标本,在ddPCR法中检测为阳性标本,1例在Super-ARMS PCR法中检测为阳性标本,在ddPCR法中检测为阴性标本。见表2、3。
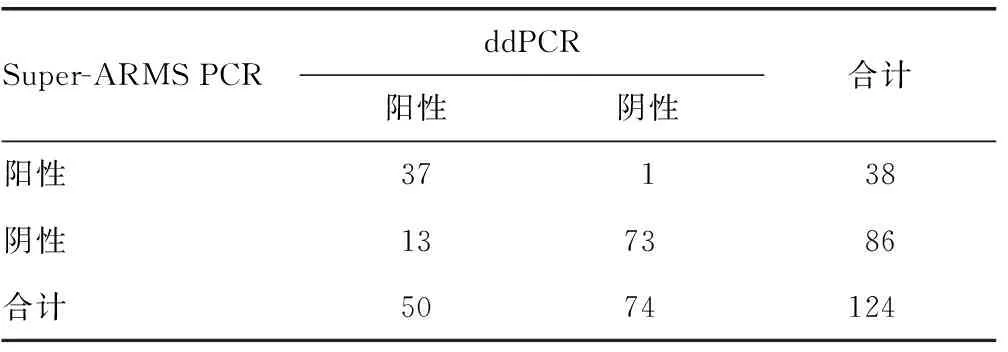
表2 Super-ARMS PCR法与ddPCR法检测结果比较(n)
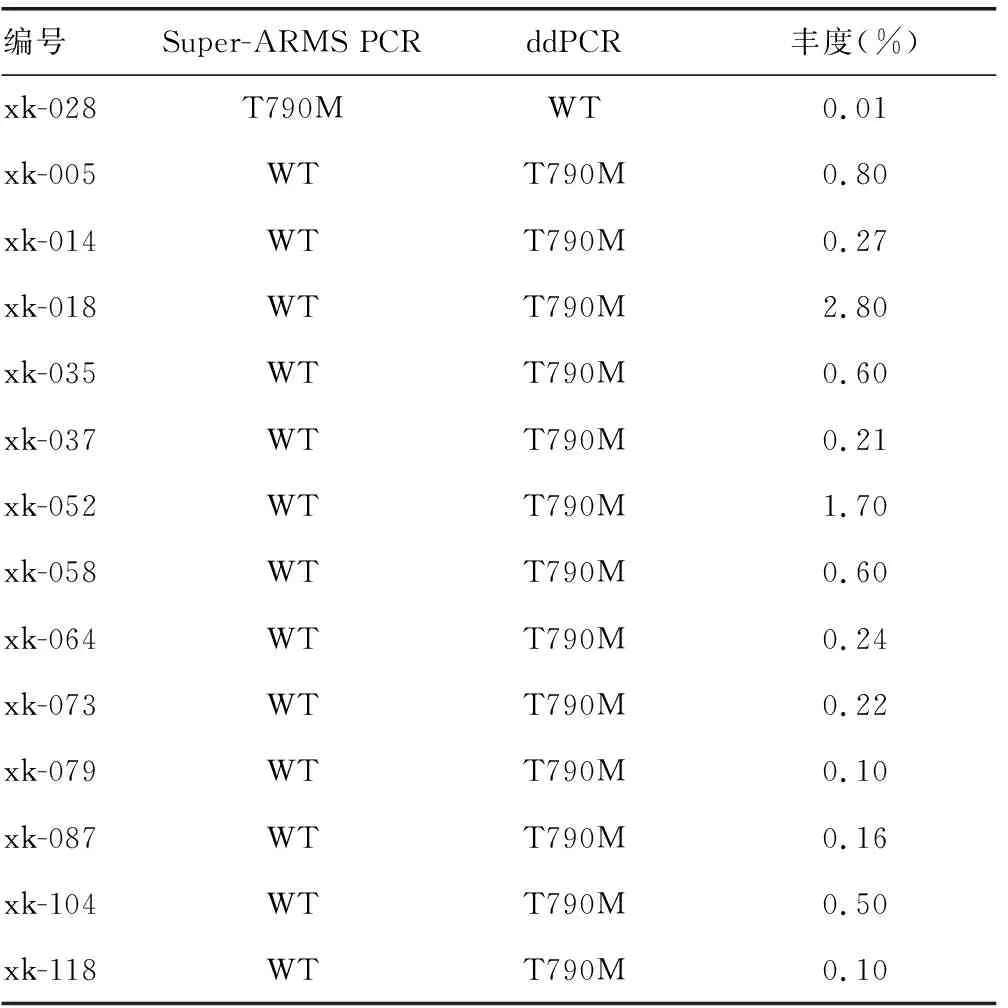
表3 14例检测结果不一致标本的信息
2.2T790M检出率与用药时间相关性 所有患者经EGFR-TKI治疗后,出现疾病进展的用药时间中位数为14个月。在所有入组患者中,随着用药时间的增加,Super-ARMS PCR法检出率升高,用药时间≥12个月患者采用Super-ARMS PCR法检测T790M突变的检出率高于用药时间<12个月的患者(P<0.05),而ddPCR法在不同用药时间人群中检出率比较,差异无统计学意义(P=0.729)。见表4。

表4 T790M检出率与用药时间的关系(%)
2.3T790M突变丰度分析 应用ddPCR法检测出50例T790M突变患者中,突变丰度在0.01%~68.10%。突变丰度≥5%的患者占28.00%(14/50);突变丰度为1%~<5%的患者占比较高,占38.00%(19/50);突变丰度<1%的患者占34.00%(17/50),其中突变丰度≤0.1%的患者占4.00%(2/50)。
3 讨 论
随着肿瘤精准治疗时代的到来,分子靶向和免疫治疗已经成为热点。由于大部分肿瘤患者在诊断时已经处于晚期,且预后较差,失去了手术根治的机会,因此化疗成为临床上主要的治疗手段。但是一线含铂两药联合化疗的有效率也只有35%左右,同时伴随十分明显的药物不良反应。因此,包含EGFR-TKI在内的分子靶向药物为晚期非小细胞肺癌患者的治疗提供了新的方向。尽管EGFR-TKI治疗在EGFR突变的肿瘤患者中取得了比较优异的成效,但是经过一段时间治疗后,患者均会出现耐药情况。第三代EGFR-TKI对出现T790M突变伴疾病进展的耐药患者有较好的效果。因此在进行第三代EGFR-TKI治疗前,对EGFR基因T790M突变的检测尤为重要。随着《非小细胞肺癌血液EGFR基因突变检测中国专家共识》的颁布[9],临床上对灵敏度较高的检测方法的需求更加迫切。目前各实验室常用的EGFR基因突变检测方法包括ARMS PCR、Super-ARMS PCR、ddPCR、新一代测序(NGS)等[10-11]。由于ctDNA具有片段小、浓度低、易降解的特点,目前针对ctDNA中EGFR基因突变检测并没有公认的“金标准”技术。本实验室前期建立了ctDNA ddPCR和NGS检测平台,经过验证,ddPCR和NGS的灵敏度基本一致,均可达0.1%[12]。ddPCR不依赖循环阈值或内参基因,可确定低至单拷贝的待检靶分子的绝对数目,具有绝对定量、灵敏度高、标本需求量低、耐受性高等特点,包括PCR和NGS在内的较多分子生物学检测技术会利用ddPCR进行比较和验证。本研究将Super-ARMS PCR法与ddPCR法在ctDNA T790M突变检出率和一致性方面进行了比较和分析。
本研究中ddPCR法和Super-ARMS PCR法检测耐药患者T790M突变检出率分别为40.32%和30.65%,与研究报道的数据较为一致[13-14]。此外,Super-ARMS PCR法和ddPCR法对晚期肺腺癌患者经EGFR-TKI治疗后ctDNA EGFR基因T790M突变检测具有较高的一致性(Kappa=0.756,P<0.001),总符合率为88.71%。其中,13例Super-ARMS PCR法检测T790M突变阴性的患者,利用ddPCR法检测阳性,通过突变丰度分析,这13例患者的突变丰度较低,在0.01%~2.80%,可能由于Super-ARMS PCR检测低突变丰度标本时,其检测性能不稳定。1例Super-ARMS PCR法检测T790M突变阳性的患者,利用ddPCR法检测阴性,可能由于ddPCR法操作过程较为复杂,操作不当等因素造成实验失败。
耐药分为原发性和获得性,原发性耐药临床定义为接受EGFR-TKI后第一时间对治疗无反应,临床症状、疾病控制或总生存率无明显改善。获得性耐药是指开始EGFR-TKI靶向治疗后取得明显治疗效果,但服药6个月之后,肿瘤病灶不能得到有效抑制,进一步增大,根据相关标准判定为疾病进展。本研究中患者经EGFR-TKI治疗后,出现疾病进展的用药时间中位数为14个月。在124例患者中,随着患者用药时间的增加,检出率也有升高,用药超过12个月的患者采用Super-ARMS PCR法检测T790M突变的检出率高于用药小于12个月的患者(P<0.01)。说明用药时间超过12个月,产生耐药性的患者占比较高,提示临床可以在这段时间加强随访。
本研究应用ddPCR法检测出50例T790M突变,T790M突变丰度在0.01%~68.10%,其中突变丰度≤0.1%的患者占4.00%。突变丰度在1%~<5%的患者占比最高,占38.00%。当患者血浆中的DNA无法达到Super-ARMS PCR法所能检测的最低限度时,常被其判为阴性;本研究中,ddPCR法的突变丰度最低可以达到0.01%,可以检出Super-ARMS PCR法检测为阴性的标本。
综上所述,Super-ARMS PCR法和ddPCR法在经EGFR-TKI治疗后的晚期肺腺癌患者外周血标本进行EGFR基因T790M突变的检测中具有较高的一致性,可以为临床肺腺癌患者靶向治疗提供重要参考。但ddPCR法灵敏度更高并且可以通过绝对定量提供突变丰度的信息,后续可针对突变丰度与患者的用药疗效和预后开展研究,从而为临床治疗提供更全面的信息。

