一种木麻黄灵芝茎腐病病原鉴定及生物学特性
单金雪,李增平,张 宇,樊雨皇
(海南大学 植物保护学院/热带农林生物灾害绿色防控教育部重点实验室,海口 570228)
木麻黄(Casuarina equisetifolia)原产于澳大利亚,是一种速生的防风常绿乔木[1],在我国沿海地区主要用于防风固沙。海南岛位于我国南海北部,因其特殊的地理位置,常遭受台风的侵袭。因此,海南岛从20 世纪50 年代开始大规模种植木麻黄,通过营造木麻黄人工海防林,全岛风沙问题得到了基本解决。目前,木麻黄已经成为海南防护林建设中的重要树种之一[2],但以木麻黄为主的海防林容易遭受灵芝属(Ganoderma)病原木腐菌的侵染,常引起其发生茎腐或根腐病,造成树木死亡[3−4]。在对海口、澄迈、万宁、昌江沿海和沿江木麻黄防护林的调查中发现,由南方灵芝〔Ganoderma australe(Fr.) Pat.〕引起的茎腐病发病率为3%~10%,为有效保护海岸线防护林,有必要对引起木麻黄木腐病的病原菌进行研究。2004 年,吴兴亮等[5]首次对中国南方灵芝的地理分布和生境进行了报道。陈礼浪等[4]对海南木麻黄木腐菌进行了研究,共发现6 种病原灵芝木腐菌,包括南方灵芝。吴如慧[6]对由二孢假芝(Amauroderma subresinosum)引起的海南木麻黄茎腐病的病原菌进行了致病性测定和生物学特性研究。目前,尚未见由南方灵芝引起的木麻黄活立木茎腐病的致病性测定及生物学研究的报道。笔者从海南发病的木麻黄活立木病树上采集病样并进行分离培养,对其病原菌通过接种完成致病性测定,采用形态学结合分子生物学手段进行种类鉴定,以及对其菌丝生长的生物学特性进行研究,旨在为研究木麻黄茎腐病的发病规律及诊断等提供理论依据。
1 材料与方法
1.1 研究材料于2018−10−06,从海南省万宁市东澳神州半岛近海边发病的木麻黄活立木的茎基部采集新鲜灵芝样本,带回实验室进行组织分离并风干保存;供试植物为海南大学教学实习基地内种植3~4 年生的木麻黄苗木。
1.2 培养基马铃薯葡萄糖琼脂培养基(PDA);槟榔(Areca catechuLinn.)、木麻黄(Casuarina equisetifolia)、印度紫檀(Pterocarpus indicus)、橡胶树(Hevea brasiliensis)、耳叶相思(Acacia auriculiformis)、银合欢(Leucaena leucocephala)6 种树木的新鲜叶柄或枝条浸汁培养基,采用文献[7 − 8]的方法进行配制;木屑培养基的配制参考文献[9]的方法。
1.3 试剂及仪器DNA 提取试剂盒OMEGA Fungal DNA Kit 购自美国OMEGA 公司,2×Taqplus PCR Master Mix 购自Biosharp 公司,D2000DNA Ladder 购自合肥博美生物科技有限责任公司。摄影生物显微镜为日本Olympus BX-51。
1.4 菌株的分离纯化采用常规的担子果组织分离法,参照文献[6]中的高等担子菌分离,对分离得到的菌落进行多次纯化,获得10 株形态相同的菌株,选取其中长势优良的3 株菌株进行rDNA-ITS 检测,测序结果一致后,从中选取具有代表性的菌株(编号为MMHJF001),放置于PDA 培养基上,28 ℃恒温黑暗条件下保存,备用。
1.5 接种体制备从MMHJF001 菌落边缘打取边长约1 cm×1 cm 的菌丝块接种到灭菌后的袋装木屑培养基中,28 ℃恒温培养约30 d,待菌丝布满袋装培养基后备用。
1.6 致病性测定参考文献[9]的方法,略作改动。用70%的乙醇对3~4 年生的木麻黄幼树基部茎干表面进行消毒,再用灭过菌的手术刀在待接种木麻黄树茎干部位削去1 层表皮产生轻微创伤,将长满MMHJF001 菌丝的接种体紧贴在伤口处,并用湿棉花进行保湿,然后用保鲜膜将接种体捆绑固定。设置8 个重复,用同样的方法将空白接种体接种3 株对照木麻黄树。接种后定期观察并淋水,拍照记录。
1.7 担子果诱导打取MMHJF001 菌落的菌丝块放置于瓶装木屑培养基(已灭菌)中,进行担子果诱导。放置于室内弱光条件下常温保湿培养,定期观察。
1.8 病原菌的鉴定依据《中国真菌志:第十八卷灵芝科》[10]《中国大型真菌》[11]等资料对病原菌的担子果进行表观形态鉴定,用摄影生物显微镜对病原菌的显微结构进行观察、测量和拍照。将MMHJF001 菌株培养5 d 后,使用OMEGA Fungal DNA Kit 提取其总DNA。采用通用引物ITS1(5′-TCCGTAGGTGAACC TGCGG-3′)/ ITS4(5′-TCCTCCGCTTATTGATATGC-3′)扩增rDNA 基因内转录间隔区和通用引物NS1(5′-GTAGTCATATGCTTGTCTC-3′)/NS4(5′-CTTCCGTCAATTCCTTTAAG-3′)扩增核糖体小亚基序列[12]。扩增产物纯化、回收后,送生工公司进行序列测定。将所获的序列在NCBI 进行Blast 比对,并提交序列。使用Sequence Matrix 软件进行序列拼接,使用MEGA6.0 软件以最大似然法(Maximum Likelihood)构建系统发育树[13]。
1.9 MMHJF001 菌株生物学特性测定用直径5 mm 的灭菌打孔器从培养5 d 的MMHJF001 菌株菌落边缘打下菌丝块,分别将菌丝块接种至培养基上,5 d 后采用十字交叉法测量菌落的直径。每个处理3 个重复。将接种菌丝块的PDA 培养基,分别置于15、18、20、23、25、28、30、33、35、37、40 ℃共11 个不同温度条件下进行恒温暗培养。用1 mol·L−1的HCL 和1 mol·L−1的NaOH 将PDA 培养基的pH 分别调至2、3、4、5、6、7、8、9、10 共9 个梯度,制成平板后接入菌株菌丝块,28 ℃恒温黑暗培养。将菌丝块移接至PDA 平板上,分别在连续光照、完全黑暗和12 h 光暗交替3 种不同条件下培养(28 ℃)。
将菌株菌丝块分别移接于供试的6 种树木浸汁培养基上,28 ℃黑暗条件下培养。
1.10 数据处理利用SAS 8.1 软件和Excel 2019 软件对数据进行统计分析,采用Duncan’s multiple range test 进行差异显著性分析。
2 结果与分析
2.1 木麻黄田间发病症状木麻黄树被病原菌侵染后表现为树冠稀疏,嫩枝失绿,枯枝多(图1A),后期整株变黄枯死(图1B,图1C)。在发病树木的茎干基部木质部组织出现白色腐朽(图1D)。多雨季节,病株茎基部长出褐色檐状的新鲜灵芝担子果(图1E,图1F)。
2.2 致病性测定接种3 个月后观察MMHJF001 菌株对木麻黄树基部的侵染的情况,结果发现,幼树树冠稀疏,生长不良,枯枝多,重病株整株枯死(图2A),茎干接种部位长满白色菌丝,茎干内部组织白腐(图2B,图2C),与田间病害症状相同。对照幼树则生长正常,创伤部位边缘已长出愈伤组织,内部组织健康(图2D)。采集发病组织进行再分离获得的菌株与MMHJF001 相同。表明分离菌MMHJF001 为致病菌。将菌株接种到瓶装木屑培养基,6 个月后长出的担子果与发病树木茎基部生长的担子果形态特征相同(图2E)。

图1 木麻黄的田间发病症状A:病株树冠稀疏:B,C:病树整株枯死:D:病树茎干木质部组织白腐;E,F:病树茎基部生长的担子果。Fig.1 Field symptoms of diseased Casuarina equisetifoliaA: Sparse crown of the infected tree; B and C: The trees died of infection; D: White rot of stem xylem tissue of the infected tree; E and F: Basidiocarps on the stem base of the infected tree.

图2 菌株的致病性测定A:接种5 个月后的木麻黄整株枯死;B、C:病原菌已在接种部位定殖,内部组织白腐;D:对照;E:接种分离菌的瓶装木屑培养基诱导长出的担子果。Fig.2 Pathogenicity test of Ganoderma australe (Fr.) PatA: The whole plant died after 5 months of inoculation; B and C: Pathogens have colonized at the inoculation site, and white rot appeared on the internal tissue; D: Healthy plant; E: Isolated strains were developed into basidiocarps in bottled sawdust medium.
2.3 病原菌鉴定形态鉴定 (1)菌落特征:在PDA 平板上培养的MMHJF001 的菌落前期为白色,边缘圆形或扇形,菌丝边缘稀薄,中间较浓密,菌落老化后变淡黄色(图3A)。(2)担子果:担子果一年生至多年生,无柄,硬木栓质,单生、群生或叠生。菌盖呈半圆形,大小为(8.0~21.8) cm×(5.8~12.5) cm,厚约4 cm,有明显同心环纹和环棱,菌盖边缘较钝;担子果上表面颜色呈灰褐色、土褐色或黑褐色,无漆样光泽,边缘较钝,白色,下表面灰白色。阴暗条件下生长的担子果颜色较深,强光下生长的担子果颜色稍浅。菌肉呈棕色或肉桂色,厚1.5~2.1 cm,菌管褐色或深褐色,长0.5~0.7 cm(图3B~图3E)。(3)显微结构:刚弹射出不久的新鲜孢子为典型的南瓜子形,双层壁,褐色或淡褐色,大小为(5.5~6.5) μm ×(8.7~11.1) μm,平均5.9 μm×10.0 μm,大端钝圆,小端呈圆锥形,其顶端无色透明,担孢子中央有一个较大的油滴;老熟担孢子小端平截,无色部分消失,大小为(5.8~6.8) μm×(7.4~8.8) μm,平均6.1 μm×8.3 μm,双层壁明显,颜色略深(图3F)。

图3 病原菌形态A:PDA 培养基上生长5 天的菌落(正面);B:弱光下生长的担子果;C:强光下生长的担子果;D:担子果(正面);E:担子果(反面);F:担孢子。Fig.3 Morphology of pathogenA: Colony morphology of 5 days old culture on PDA medium (front side); B: Basidiocarps growing in a low light condition;C: Basidiocarp growing in a strong light condition; D: Basidiocarp (front side); E: Basidiocarp (back side); F: Basidiospores.
分子鉴定:测序后获得MMHJF001 菌株的rDNA-ITS 和SSU 序列长度分别为635 bp(NCBI 登录号为MN696209.1)和1 076 bp(登录号为MN696211.1)。将序列分别在NCBI 上进行BLAST 比对,结果显示与NCBI 上登陆号为MN689631.1、LC084663.1、AF0266291.1 等南方灵芝[Ganoderma australe(Fr.) Pat.]的序列相似度达99%。在NCBI 数据库中选取rDNA-ITS,SSU 相关基因序列(表1),将2 种序列拼接,利用MEGA 6.0 软件联合构建系统发育树,结果表明,菌株MMHJF001 与南方灵芝的遗传距离最小,聚为一类,同源性达100%(图4)。结合形态学鉴定,确定MMHJF001 菌株为南方灵芝[Ganoderma australe(Fr.) Pat.]。
2.4 生物学特性从图5 可知,MMHJF001 菌株菌丝在15~37 ℃均能生长,在15~28 ℃时随着温度的上升菌落直径增大,在28~37 ℃时随着温度的上升菌落直径则逐渐减小,40 ℃时停止生长,25~30 ℃温度范围适宜生长,28 ℃为菌丝生长的最适温度。
从图6 可知,病原菌MMHJF001 菌株在pH 为3~9 范围内均能生长,pH3~7 时菌丝生长速率增快,pH7 时菌落直径最大,极显著高于其他处理,表明pH7 最适宜菌丝生长。实验结果显示,南方灵芝更适于在弱酸性至中性环境中生长。
表1 菌株的序列登录号Tab.1 Accession number of sequences of fungal strains in GeneBank
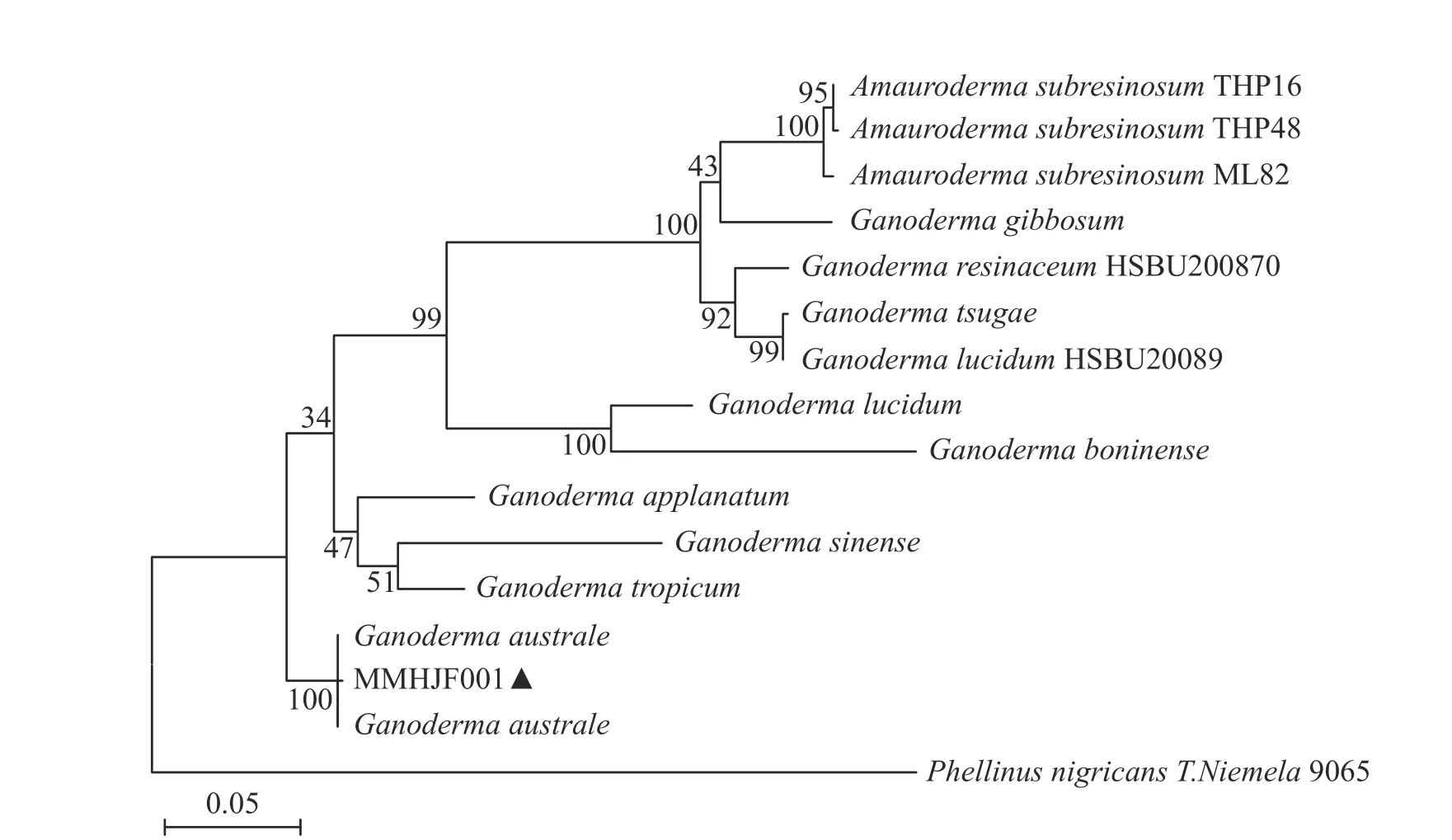
图4 基于rDNA-ITS 及SSU 序列基础的菌株MMHJF001 与其他灵芝属相关种的系统发育树Fig.4 Phylogenetic trees of the strain MMHJF001 based on rDNA-ITS and SSU sequences and other related species of Ganoderma

图5 不同温度培养MMHJF001 菌株的菌落直径小写字母代表在P<0.05 水平差异显著,大写字母代表在P<0.01 水平差异极显著,下同。Fig.5 Colony diameter of the strain MMHJF001 cultured at different temperaturesLowercase letters represent significant differences at the P<0.05 level; uppercase letters represent highly significant differences at the P<0.01 level, similarly hereinafter.
从图7 可知,3 种不同光照和黑暗条件MMHJF001 菌株菌丝的生长差异显著。在黑暗的条件下菌株菌落直径最大,菌落边缘呈圆形,菌丝生长均匀。在连续光照条件下的菌落直径最小,菌落外围呈不规则扇形,菌丝生长不均匀。实验结果显示,黑暗条件有利于病原菌的菌丝生长。
从表2 可知,原菌MMHJF001 菌株在供试的6 种培养基上均能生长。在橡胶树、耳叶相思和银合欢枝条浸出液培养基上长势较好,木麻黄、紫檀次之,而在槟榔叶柄浸汁培养基上病原菌长势较差,菌丝较稀薄。本研究结果表明,银合欢浸汁培养基最适合木麻黄灵芝茎腐病病原菌的生长。

图6 不同 pH 条件下MMHJF001 菌株的菌落直径Fig.6 Colony diameter of the strain MMHJF001 cultured at different pH values
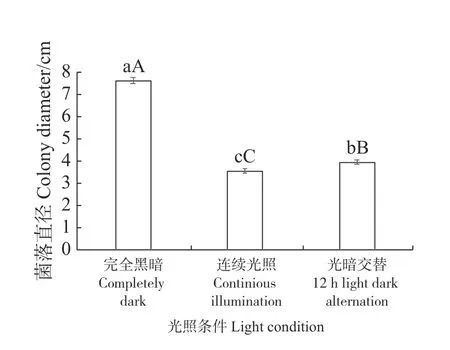
图7 不同光照下MMHJF001 菌株的菌落直径Fig.7 Colony diameter of the strain MMHJF001 cultured under different light conditions

表2 不同植物浸出液培养基对MMHJF001 菌丝生长的影响Tab.2 Effect of different culture mediums on the mycelium growth of the strain MMHJF001
3 讨 论
灵芝属(Ganoderma)担子菌主要分布在东亚暖温带、亚热带炎热与潮湿的环境中。目前被世界公认的灵芝属有224 个种[14]。灵芝属真菌均是木腐菌,其中,某些种被作为重要的药用真菌,另一些种则可寄生活立木,引起树木的根腐病或茎腐病,其发生严重时造成树木枯死,是一类重要的病原菌。南方灵芝是一种多寄主的病原木腐菌,可侵染多种热区林木,使树木基部组织白色腐朽,严重时树木死亡,其主要分布在华中、华东和华南地区的天然林和人工林内[15]。南方灵芝在海南各市县比较常见,是海南主要的野生灵芝资源之一。目前,国内外对南方灵芝的研究报道主要集中在子实体化学成分、生物降解和基因组等方面[16−18],南方灵芝子实体的化学成分主要为三萜和甾醇,具有很好的药用和保健价值,在生物降解方面具有减少废水中酚类物质的能力。尚未见南方灵芝引起木麻黄茎腐病的报道。本研究从海南省万宁市木麻黄上发现的木麻黄灵芝茎腐病,采用形态学和分子生物学鉴定,确定该茎腐病病原菌为南方灵芝(Ganoderma australe(Fr.) Pat.)。本研究结果表明,该病原菌适宜生长的温度范围为25~30 ℃,最适生长温度为28 ℃,最适pH 为7。这与LUANGHARN 等[19]研究中灵芝菌丝体生长的最佳条件(pH 值为7~8,温度为25~30 °C)结果一致。光照对其菌丝生长有抑制作用;南方灵芝适宜在橡胶树、银合欢、耳叶相思枝条浸汁培养基上生长。
笔者在对海南不同市县田间调查时发现,橡胶树、椰子、油棕、槟榔、银合欢和耳叶相思等植物上均有由南方灵芝侵染引起的茎腐病。在海口、澄迈、万宁、昌江沿海和沿江的木麻黄防护林中发现,树龄越大的木麻黄林发病率越高,风断树多的林地发病重。其原因主要是此类林地临近水域,林间湿度大有利于南方灵芝子实体的形成和担孢子产生,强台风及造成的伤口则较有利于南方灵芝担孢子的传播和侵染。
目前,由灵芝科担子菌引起的木麻黄茎腐病和根腐病的研究有不少报道,吴如慧等[6]发现,木麻黄二孢假芝(Amauroderma subresinosum)可引起木麻黄茎腐病,陈礼浪等[3]的研究结果表明,热带灵芝(Ganoderma tropicum)能引起木麻黄红根病等。与本研究发现的南方灵芝引起的木麻黄茎腐病进行比较,南方灵芝担子果无似漆样光泽,颜色呈灰褐色或黑褐色,菌肉呈棕色或肉桂色,而二孢假芝和热带灵芝担子果均稍有似漆样光泽,热带灵芝新鲜担子果表面颜色红褐色或黄褐色,菌肉褐色,二孢假芝新鲜担子果表面红褐色,成熟后表面呈黑褐色,菌肉浅黄色或污白色。除担子果形态不同以外,南方灵芝和二孢假芝引起病树茎基部组织白腐,而热带灵芝则引起木麻黄红根病,树根表面平粘一层泥沙,病根表面可见枣红色或黑红色革质菌膜。笔者调查发现,灵芝科中多种真菌均可引起木麻黄等林木的茎腐病或根腐病。不同病原种类的灵芝菌引起的木麻黄茎腐病还有待进一步深入研究,以便为准确诊断和防治此类病害提供参考。

