黑种草子总皂苷对人宫颈癌SiHa细胞生物学行为的影响
方 磊,杨 涛,盛 磊,木塔力甫·艾买提,齐鑫鑫,艾尼娃尔·艾克木,*,伊力亚尔·尼加提,*
(1.新疆医科大学药学院,新疆 乌鲁木齐830011;2.新疆医科大学中心实验室,新疆 乌鲁木齐 830011;3.新疆医科大学公共卫生学院,新疆 乌鲁木齐 830011)
宫颈癌是全球发病率第4 的妇科恶性肿瘤,每年有超过100万妇女被诊断患有宫颈癌,并有30多万人因此死亡,宫颈癌对全球女性生命健康造成巨大威胁。在宫颈癌治疗方面,放射治疗、化学药物治疗和手术治疗仍是主要治疗手段,这些治疗方法虽能在一定程度上改善临床症状,提高患者预后生存率,但会影响患者的免疫功能导致并发症。因此寻找更安全有效的治疗手段对改善宫颈癌患者生命质量具有重大意义。
传统中药可通过多成分、多靶点和多途径联合作用于肿瘤细胞增殖和周期进程,调节细胞信号传导通路,影响相关蛋白转录及细胞因子进而发挥抗宫颈癌作用。黑种草子为瘤果黑种草(Nigella glandulifera
Freyn)的干燥成熟种子,是一种药食同源的药材,在我国新疆地区有着悠久的药用和食用历史。现代研究表明,黑种草子中富含皂苷、黄酮和生物碱等,具有广泛的药理活性。在抗肿瘤作用方面,黑种草子皂苷类单体Nigella A、总黄酮及酚酸类物质都表现出良好效果。细胞自噬是细胞通过降解胞内损坏的细胞器及蛋白质等,以进行细胞自身代谢和更新,实现细胞自身物质循环利用的过程。研究发现,细胞自噬参与肿瘤发生发展的各个过程,肿瘤细胞可通过自噬维持自身环境稳态,在各种恶劣生长环境下生存。然而长时间高水平的自噬则会失去对细胞的保护作用,导致细胞死亡。因此寻找针对细胞自噬途径的治疗靶点,可能建立新的肿瘤治疗方法。
本研究在黑种草子总皂苷(total saponins from the seeds ofNigella glandulifera
Freyn,TSNG)对人宫颈癌SiHa细胞体外增殖活性及迁移抑制作用的研究基础上,拟探讨TSNG对SiHa细胞凋亡及自噬的影响。1 材料与方法
1.1 细胞与主要试剂
人宫颈癌SiHa细胞株,由新疆医科大学地方病重点实验室惠赠;黑种草子,购自新疆麦迪森有限公司,经质检鉴定符合药典规定;胎牛血清,购自美国Gibco 公司;DMEM 高糖培养基、0.25%胰酶,均购自天津灏洋生物公司;噻唑蓝(thiazolyl blue tetrazolium bromide,MTT),购自美国MP biomedical 公司;二甲基亚砜(dimethyl sulfoxide,DMSO),购自美国BIO FROXX 公司;凋亡检测试剂盒,购自美国BD 公司;Hoechst33342 试剂盒、单丹磺酰戊二胺(monodansyl cadaverine,MDC)试剂盒,均购自北京索莱宝公司;硫酸羟氯喹(hydroxychloroquine,HCQ),购自上海源叶公司;抗LC3B、抗p62 抗体均购自美国Abcam 公司;抗β-actin抗体,购自affinity公司。
1.2 仪器设备
本研究使用的主要仪器有:低温高速离心机(美国Beckman Coulter 公司);MLS-3020U 高压灭菌锅(日本Snayo 公 司); 倒 置 荧 光 显 微 镜(德 国 Leica 公 司);Thermo Multiskan GO 全波长酶标仪(美国 Thermo 公司);流式细胞仪(美国BD 公司);激光共聚焦显微镜(日 本 Nikon 公 司); 电 泳 仪 (美 国 Bio-Rad 公 司);FluorChem E 化学发光凝胶成像仪(美国Protein Simple公司)。
1.3 TSNG制备
黑种草子粉碎,以固液比1∶10 加入30%乙醇70 ℃回流提取3 次,每次1 h,合并提取液,旋蒸浓缩后经AB-8 大孔树脂纯化后得TSNG,以香草醛-冰醋酸-高氯酸比色法测定总皂苷质量分数为39.2%。
1.4 细胞培养
人宫颈癌SiHa细胞复苏后,使用含有10%胎牛血清的DMEM 高糖培养基,于CO体积分数为5%的37 ℃培养箱中。待细胞生长至汇合度为80%~90%时,对细胞进行传代培养。
1.5 MTT实验
取对数生长期细胞接种于96 孔培养板,过夜培养贴壁。根据课题组前期预实验结果,设置TSNG 系列浓度(0、0.8、0.9、1.0、1.1、1.2、1.4、1.6、1.8 mg/mL),作用24 h后,每孔加入MTT(5 mg/mL)20 μL继续培养4 h。弃去培养基,每孔加入DMSO 200 μL后于酶标仪检测490 nm处各孔吸光度值D
(490),按下式计算细胞生长抑制率。细胞生长抑制率/%=[D
(490)-D
(490)/D
(490)]×100%1.6 细胞形态观察
取对数生长期细胞接种于6 孔培养板,过夜培养贴壁。根据MTT 实验所得IC,分别选择IC的60%、70%、80%作为TSNG的作用浓度进行后期实验。以不同浓度(0、0.9、1.0、1.1 mg/mL)TSNG 作用 24 h 后分别在倒置显微镜下观察细胞生长密度、形状、体积等细胞形态特征,并拍照。
1.7 划痕实验
取对数生长期细胞接种于6 孔培养板,过夜培养贴壁。待细胞生长至100%,用200 μL 枪头在每孔中做3 条平行划痕。PBS 洗净漂浮细胞,于倒置显微镜下对各组划痕拍照。再以含2%胎牛血清培养基配制不同浓度(0、0.9、1.0、1.1 mg/mL)TSNG 作用 24 h 后使用倒置显微镜对划痕拍照,使用ImageJ软件计算各组划痕面积S
,并按下式计算细胞相对迁移率。相对迁移率=(S
-S
)/S
1.8 细胞凋亡实验
取对数生长期细胞接种于6 孔培养板,过夜培养贴壁。鉴于流式细胞术Annexin V-FITC/PI 染色法是一种能准确定量检测细胞凋亡率的手段,因此为更准确反映TSNG 对SiHa 细胞凋亡率的影响,本研究设置稍大作用浓度范围,分别用0、1.0、1.2、1.4 mg/mL TSNG 作用24 h 后收集细胞。采用凋亡试剂盒进行染色,以流式细胞仪检测各组细胞凋亡率。
1.9 Hoechst和MDC染色实验
取对数生长期细胞接种于四格玻底皿,过夜培养贴壁。分别以不同浓度(0、0.9、1.0、1.1 mg/mL)TSNG作用24 h后,使用Hoechst33342工作液37 ℃避光染色20 min 后,再以MDC 染色工作液室温避光染色20 min。激光共聚焦显微镜下观察细胞内绿色荧光颗粒的荧光强度和数量,以判断细胞内自噬体的数量。
1.10 蛋白免疫印迹实验
取对数生长期细胞接种于6 孔培养板,过夜培养贴壁。分别以不同浓度(0、0.9、1.0、1.1 mg/mL)TSNG 作用24 h。同时设置HCQ 干预组,使用自噬抑制剂HCQ(10 μmol/L)提前干预4 h 后再以TSNG(1.0 mg/mL)作用24 h。收集各组细胞并提取总蛋白。经十二烷基磺酸钠—聚丙烯酰胺凝胶电泳分离后转膜,5%脱脂牛奶室温封闭2 h,分别加入抗LC3B 抗体(1∶3 000 稀释),抗 p62 抗体(1∶3 000 稀释),抗β-actin抗体(1∶3 000 稀释),4 ℃过夜孵育后,室温孵育相应二抗1 h。ECL 化学发光显影后,ImageJ 软件分析蛋白条带,蛋白表达水平以相对值表示。
1.11 统计学方法
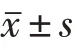
2 结 果
2.1 TSNG抑制SiHa细胞增殖
MTT实验结果见表1。TSNG对SiHa细胞增殖具有抑制作用,且随TSNG 作用浓度的增加,生长抑制率升高(P
<0.05)。使用SPSS 23.0 软件对抑制率进行Probit回归分析,计算得出其IC=1.322 mg/mL。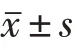
表1 MTT实验检测不同浓度TSNG作用后SiHa细胞的吸光度值和生长抑制率(n=3,)
2.2 TSNG对细胞形态的影响
形态观察结果见图1。空白对照组细胞多呈梭形,形态饱满,数量多,轮廓清晰。TSNG 作用后细胞密度明显降低,细胞内产生空泡,并且皱缩,破裂,死亡细胞逐渐增多。
2.3 TSNG抑制SiHa细胞迁移
划痕实验结果见图2 和图3。作用后24 h 后,空白组划痕面积及距离明显减小,TSNG 作用组随着药物浓度的增大,划痕面积减小程度逐渐降低。使用ImageJ 软件分析各组处理前后划痕面积并计算相对迁移率,0.9、1.0、1.1 mg/mL TSNG 作用组细胞相对迁移率分别为(20.40±2.49)%、(15.14±0.39)%、(5.05±1.04)%,均低于空白对照组的(36.63±2.52)% (P
<0.01)。2.4 TSNG对SiHa细胞凋亡影响
细胞凋亡率检测实验结果见图4。不同浓度(1.0、1.2、1.4 mg/mL)TSNG 作用于SiHa 细胞后细胞凋亡率(Q2+Q4)分别为(39.10±0.22)%,(68.37±0.58)%和(80.93±0.12)%。与空白对照组的(10.73±0.82)%相比,差异均具有统计学意义(P
<0.01)。TSNG对SiHa细胞凋亡具有明显诱导作用,特别是对早期凋亡影响显著。
图1 TSNG作用SiHa细胞后的形态观察(×100)

图2 TSNG作用SiHa细胞的划痕实验观察结果(×50)
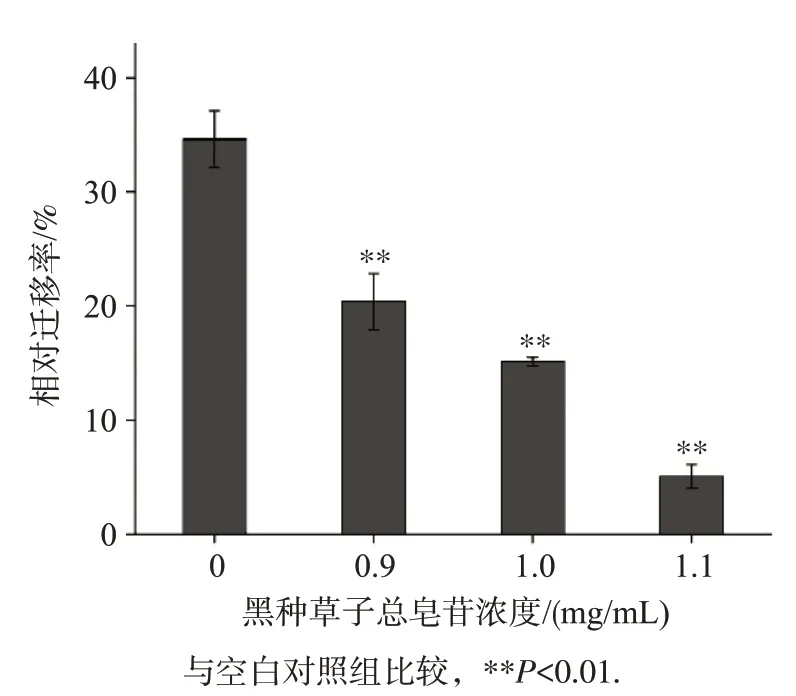
图3 划痕实验检测TSNG作用SiHa细胞后的相对迁移率
2.5 Hoechst和MDC染色结果
Hoechst33342 和MDC 染色共染结果见图5。相较于空白对照组,随着TSNG 作用浓度的增加,细胞核固缩、破裂,呈致密浓染细胞数量增多。同时细胞内绿色荧光颗粒数量明显增加,荧光强度增强。表明TSNG 能诱导细胞发生凋亡和引起细胞内自噬体数量的增加。
2.6 TSNG对SiHa细胞LC3-Ⅱ和p62蛋白表达影响
Western blot 实验结果见图6。与空白对照组相比,TSNG作用后SiHa细胞LC3-Ⅰ蛋白表达变化不明显,但LC3-Ⅱ和p62蛋白表达量均有明显上升(P
<0.05或0.01)。为进一步探究其可能的影响机制,使用HCQ合并TSNG 干预。相较于TSNG 作用组,HCQ 干预组LC3-Ⅱ和p62 蛋白相对表达量差异均无统计学意义。结果表明TSNG 可能作用于自噬流后期,阻碍自噬体和溶酶体的融合。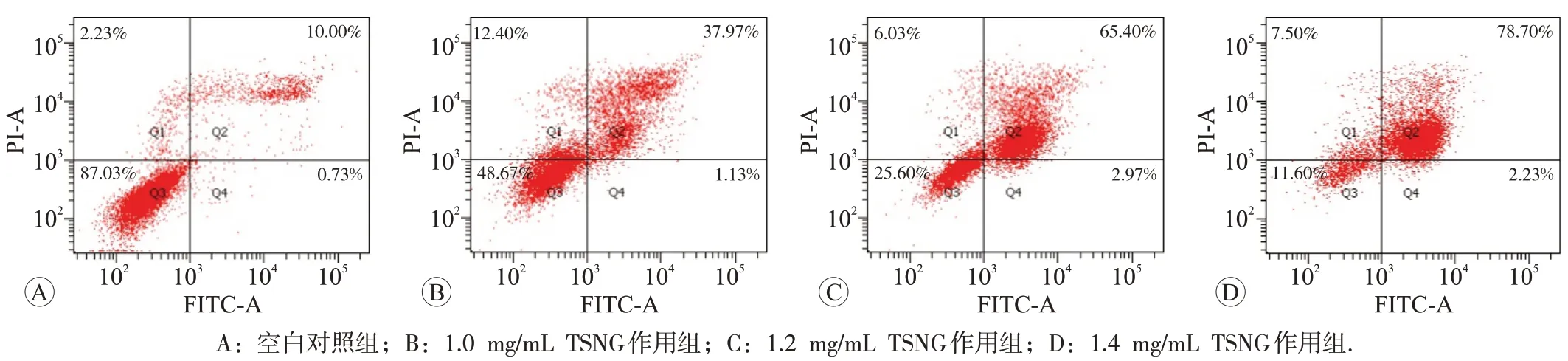
图4 流式细胞术检测TSNG作用SiHa细胞后的细胞凋亡率
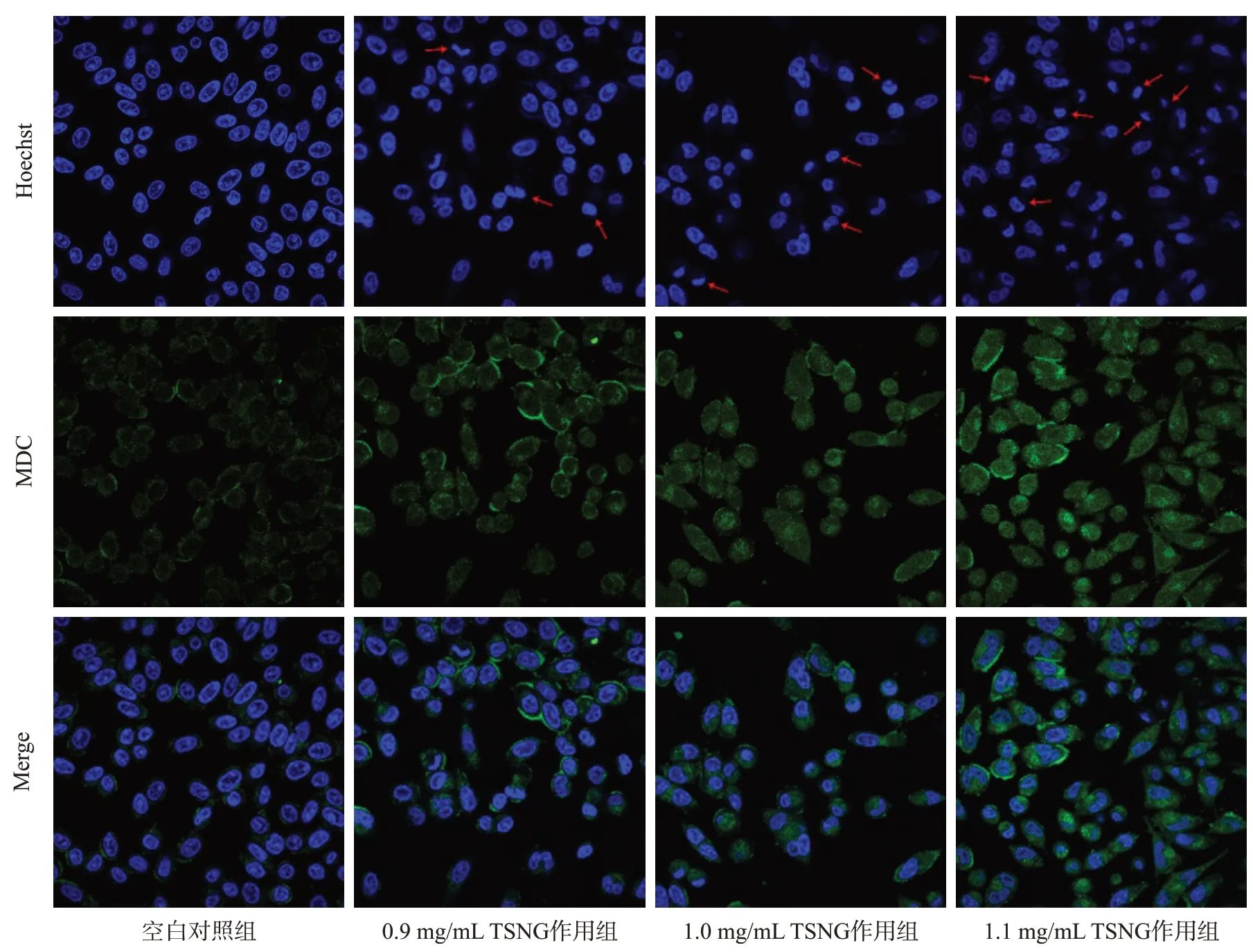
图5 Hoechst和MDC染色观察TSNG作用SiHa细胞后的荧光强度(×600)
3 讨 论
传统中药可通过多途径、多靶点发挥抗宫颈癌作用,且有并发症少的优势,具有良好的临床应用开发前景。皂苷类物质作为中医药用植物中常见的活性物质,可通过调控肿瘤细胞周期、诱导分化和促进凋亡等途径来发挥抗肿瘤作用。本研究实验结果表明,TSNG 对SiHa 细胞增殖和迁移表现出明显的抑制作用,并呈剂量-效应关系。
细胞凋亡又称程序性细胞死亡,目的是调控发育、维护机体内环境稳定,是细胞的基本生命活动,对维持机体正常生理功能具有重要意义。宫颈癌的发生发展与凋亡相关蛋白p53、Bcl-2 和Bax 等的异常表达密切相关,同时宫颈癌传统治疗手段如放射治疗和化学药物治疗等部分作用机制也与诱导凋亡有关。故而细胞凋亡途径可作为宫颈癌治疗潜在靶点。本研究采用流式细胞术检测TSNG 作用后的SiHa细胞凋亡率,结果表明,TSNG 在体外可显著诱导宫颈癌SiHa 细胞凋亡,尤其是对细胞早期凋亡影响显著。同时经凋亡特异性染料Hoechst33342 染色观察,TSNG 干预后细胞出现细胞核固缩、破裂呈致密浓染等经典凋亡现象,且药物干预浓度越大,现象越明显。
细胞凋亡和细胞自噬存在着多重联系,二者常伴随发生,既能相互抑制,也能相互促进。在肿瘤治疗过程中,抗肿瘤药物对肿瘤细胞生存产生压力,细胞则会启动自噬进行自我保护并抑制细胞凋亡。因此对细胞自噬与凋亡的相互作用研究,可能有助于寻找肿瘤治疗新途径。
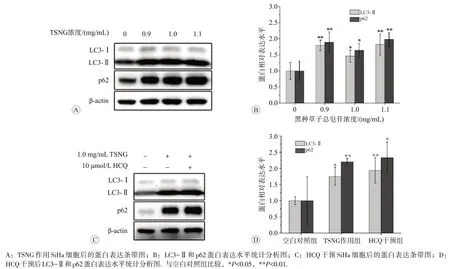
图6 Western blot实验检测细胞LC3-Ⅱ和p62蛋白表达
细胞自噬对肿瘤的发生及发展具有复杂的调节作用,在肿瘤形成早期,自噬可维持基因组和染色体的稳定从而抑制肿瘤的发生。但当肿瘤发展至一定阶段,肿瘤细胞将面临营养缺乏、缺氧的微环境改变,此时自噬可通过对细胞内物质循环再利用,维持微环境稳态,帮助肿瘤细胞生存。自噬调控主要是由自噬相关基因(autophagy-related genes,ATGs)编码蛋白质完成的,现阶段常用于自噬水平检测的蛋白标志物为LC3(microtubule-associated protein 1A/1B light chain 3)和p62/SQSTM1(Sequestosome-1)等自噬相关蛋白。LC3 蛋白分为胞质状态Ⅰ型(LC3-Ⅰ)和膜结合状态Ⅱ型(LC3-Ⅱ),自噬发生时LC3-Ⅰ转化为LC3-Ⅱ,LC3-Ⅱ存在于自噬前体和自噬体,随自噬体膜的增多而表达量增加。因此,LC3-Ⅱ蛋白的表达水平与自噬体数量密切相关。在自噬发生过程中,自噬体的生成增加、成熟或自噬后期自噬体降解障碍均能导致LC3-Ⅱ蛋白表达水平的升高。p62 作为连接LC3 和泛素化底物的自噬受体蛋白,最终将被整合至自噬体中,随后在自噬溶酶体中被酶解。通常情况下,当自噬流被阻断时p62 不能被正常降解,导致p62 表达水平上升。本研究在检测LC3-Ⅱ蛋白表达水平的基础上,试图通过检测p62蛋白的表达水平来证明TSNG对细胞自噬流的影响。实验结果表明,TSNG 作用后细胞LC3-Ⅱ和p62 蛋白表达水平均明显上升,TSNG 可对细胞自噬造成影响。但LC3-Ⅱ和p62蛋白表达水平同时上调,并非自噬发生的常规现象。
为进一步研究,采用自噬抑制剂HCQ干预,进行LC3 蛋白 turnover 实验。HCQ 作为常见自噬抑制剂,可作用于溶酶体蛋白酶干扰自噬体和溶酶体的融合以阻断自噬流。实验结果表明,HCQ 干预组与TSNG作用组的LC3-Ⅱ和p62蛋白相对表达水平未见明显差异。同时MDC 染色实验结果表明,TSNG 引起细胞内自噬体数量增加。综合以上实验结果,推测TSNG 可能作用于自噬流后期,干扰自噬体和溶酶体的融合以阻断自噬流造成自噬体降解障碍,从而导致LC3-Ⅱ和p62蛋白堆积。
综上所述,本研究中TSNG 对SiHa 细胞的增殖、迁移表现出抑制作用,对SiHa细胞凋亡具有诱导作用并且可阻断细胞自噬流。但其对SiHa细胞自噬的具体影响机制以及自噬与诱导凋亡间相互作用仍需进一步研究,以开发其抗宫颈癌临床应用的潜在价值。

