免疫微生态肠内营养联合加速康复策略对结直肠癌患者术后免疫状态的影响
牛恒,杨昆宪
(云南省第一人民医院 普通外科,云南 昆明 650032)
结直肠癌是世界上第四大致命癌症,每年有近90万例死亡[1]。发达国家结直肠癌发病率的上升可归因于人口的日益老龄化、不良的现代饮食习惯以及吸烟、欠缺体育锻炼和肥胖等危险因素的增加。针对原发性和转移性结直肠癌的新疗法已经出现,为患者提供了更多的选择;治疗方法包括内镜、外科局部切除、根治手术、术前放疗和全身治疗、局部和转移性疾病的广泛手术、转移性疾病的局部消融治疗、姑息性化疗、靶向治疗和免疫治疗[2]。尽管这些新的治疗方案使晚期疾病的总生存率翻了一番,达到3年,但其病死率仍然很高[3]。手术是非转移性结直肠癌患者的主要治疗手段,然而,手术结局与围手术期管理、手术质量、术前分期和治疗选择密切相关[4]。结直肠癌术后并发症发生率高达50%,与较高的发病率和病死率、较低的健康相关生活质量和增加的医疗费用有关[5]。并发症的数量和严重程度与术前各脏器功能状态、营养状况、心理状态和吸烟行为密切相关[6-7]。加速康复外科(ERAS)策略涉及术前、术中和术后因素,包括多种围手术期患者护理方法的组合,采用多学科团队方法,整合循证干预,降低手术创伤,维持术后生理功能,加速患者恢复。主要方法集中在术前咨询、无禁食、最佳液体管理、减少导管使用、阿片类镇痛和早期活动等方面[8]。ERAS已经在结直肠手术中得到广泛应用[9-12]。免疫微生态肠内营养由谷氨酰氨、益生菌和肠内营养混悬剂组成,可从多个方面维护肠道黏膜屏障,减少肠道细菌易位和内毒素释放,并且能够改善患者的免疫状态[13]。基于此,本研究探讨免疫微生态肠内营养联合加速康复策略对结直肠癌患者术后临床转归、营养状态和细胞免疫的影响。
1 资料与方法
1.1 一般资料
回顾性分析2016年3月—2018年9月于我院行结直肠癌手术治疗的96例患者临床资料,根据患者的治疗策略分为常规组和免疫微生态肠内营养组,每组48例。常规组采用加速康复策略,免疫微生态肠内营养组采用免疫微生态肠内营养联合加速康复策略。两组患者的年龄、男女性别比例、体质量指数(BMI)、肿瘤部位、病理类型、肿瘤-淋巴结-转移(TNM)分期、美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级、合并症等进行比较,差异均无统计学意义(P>0.05)(表1)。本研究经我院伦理委员会审核批准。
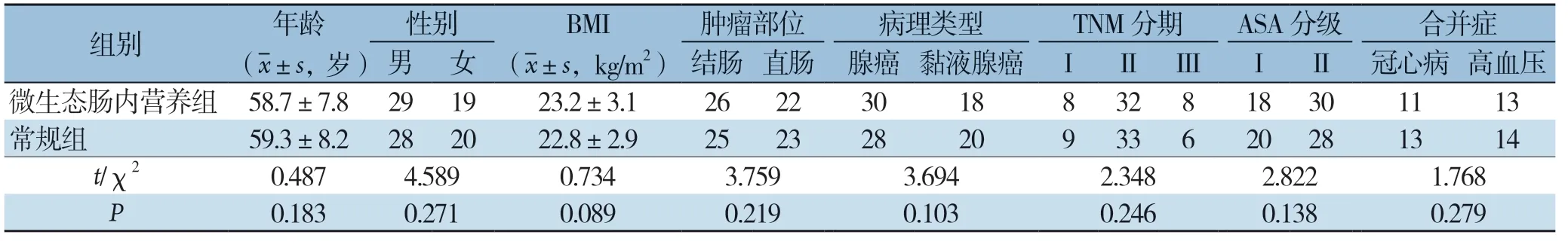
表1 两组患者一般资料的比较(n=48)
1.2 纳入与排除标准
纳入标准:(1) 所有患者均对本研究知情,且签署了知情同意书患者;(2) 病理明确诊断为结直肠癌;(3) TNM分期I~III期;(4) 术前未接受放化疗等抗肿瘤治疗;(5) 患者的病历及随访资料完整。排除标准:(1) 严重心、肺、肝、肾等器官功能障碍;(2) 术中联合切除其他脏器;(3) 伴有完全性肠梗阻需行姑息手术;(4) 资料不全;(5) 合并感染性疾病;(6) 合并内分泌系统疾病。
1.3 手术方法
两组患者的腹腔镜手术由同科室的同一医疗组医师完成[12]。(1) 常规组:采用加速康复策略[14-17],包括术前宣教、术前禁食、术中保温、术中补液、麻醉方法、术后恢复饮食、术后早期下床活动等。(2) 免疫微生态肠内营养组:在常规组基础上联合免疫微生态肠内营养治疗,具体如下:术前连续3 d每天给予肠内营养混悬液(伊力佳,雅培制药公司生产)1000 mL,口服双歧三联活菌肠溶胶囊(培菲康,含长型双歧杆菌、嗜酸乳杆菌、粪肠球菌,上海信谊药厂生产)630 mg和复方谷氨酰胺肠溶胶囊(地奥集团成都药业有限公司生产)3粒,均为每天2次。两组术后对症支持疗法相同。
1.4 观察指标
(1) 观察两组患者的一般手术指标,包括:出现首次肠鸣音的时间、首次排气时间、首次排便时间、住院时长;(2) 评估两组患者的并发症发生情况,包括:吻合口出血、吻合口瘘、切口感染、肺部感染、泌尿系感染、腹腔感染;(3) 评估患者围手术期营养状态和细胞免疫水平:于患者术前1 d、术后第1、4、7天清晨6点抽取空腹静脉血。测定前白蛋白(PA)、白蛋白(ALB)含量;采用流式细胞术测定患者外周血T细胞亚群(CD3+T细胞、CD4+T细胞以及CD4+/CD8+)水平。
1.5 统计学处理
采用SPSS 20.0分析数据,计量资料采用均数±标准差(±s)表示,组间比较采用t检验;计数资料采用率(%)表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者术后恢复情况的比较
微生态肠内营养组的出现首次肠鸣音的时间、首次排气时间、首次排便时间和住院时间均优于常规组(P<0.05)(表2)。
2.2 两组患者并发症发生情况比较
微生态肠内营养组并发症发生率明显低于常规组,差异有统计学意义(P<0.05)(表3)。
表2 两组患者术后恢复情况的比较(±s,n=48)
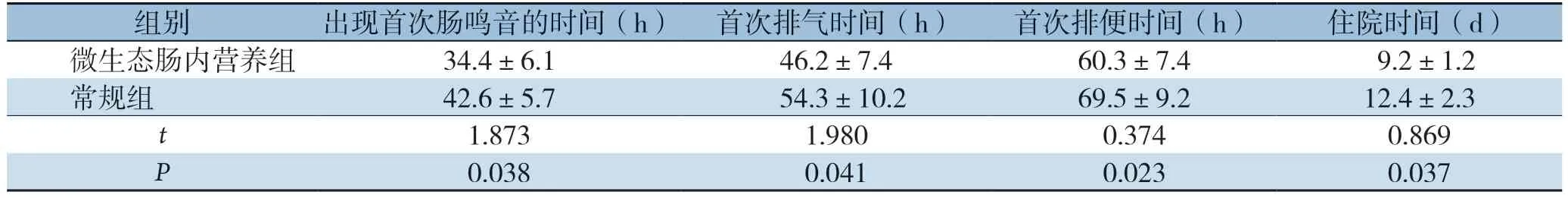
表2 两组患者术后恢复情况的比较(±s,n=48)
组别 出现首次肠鸣音的时间(h) 首次排气时间(h) 首次排便时间(h) 住院时间(d)微生态肠内营养组 34.4±6.1 46.2±7.4 60.3±7.4 9.2±1.2常规组 42.6±5.7 54.3±10.2 69.5±9.2 12.4±2.3 t 1.873 1.980 0.374 0.869 P 0.038 0.041 0.023 0.037
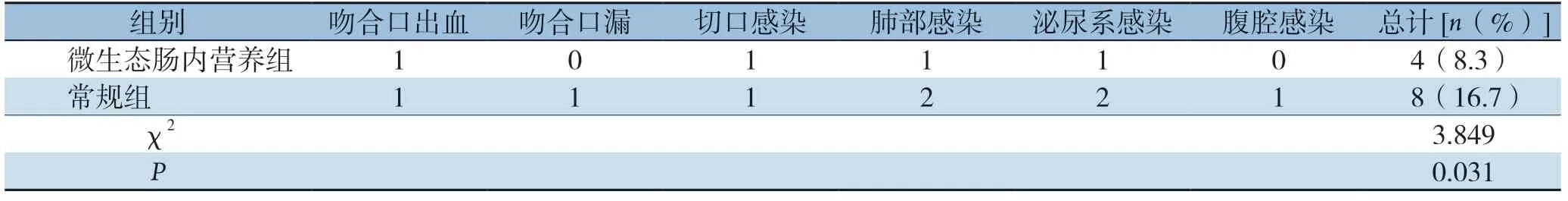
表3 两组患者的并发症发生情况对比(n=48)
2.3 两组患者围手术期营养状态比较
术前两组PA、ALB含量无差异(P>0.05),术后1 d两组患者PA和ALB含量降至最低,4 、7 d逐渐升高;术后4 、7 d,微生态肠内营养组患者PA和ALB含量均高于常规组(P<0.05)(表4)。
表4 两组患者围手术期营养状态比较(±s,n=48)
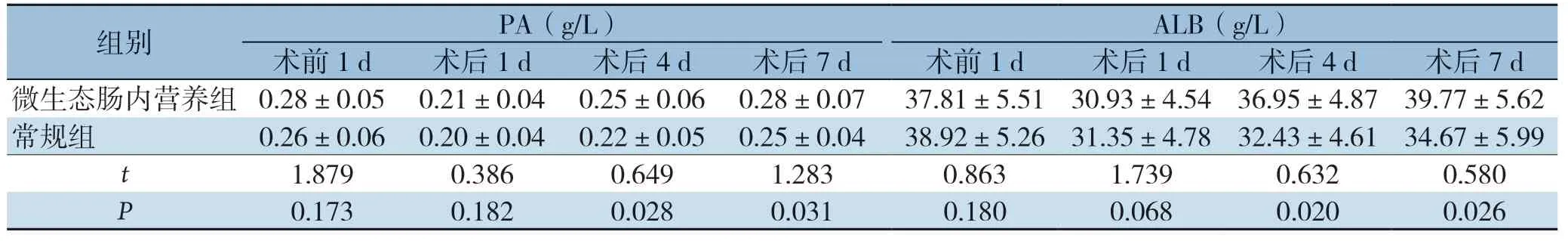
表4 两组患者围手术期营养状态比较(±s,n=48)
组别 PA(g/L) ALB(g/L)术前1 d 术后1 d 术后4 d 术后7 d 术前1 d 术后1 d 术后4 d 术后7 d微生态肠内营养组 0.28±0.050.21±0.040.25±0.060.28±0.0737.81±5.5130.93±4.5436.95±4.8739.77±5.62常规组 0.26±0.060.20±0.040.22±0.050.25±0.0438.92±5.2631.35±4.7832.43±4.6134.67±5.99 t 1.879 0.386 0.649 1.283 0.863 1.739 0.632 0.580 P 0.173 0.182 0.028 0.031 0.180 0.068 0.020 0.026
2.4 两组患者细胞免疫水平比较
术前两组CD3+、CD4+、CD8+、CD4+/CD8+水平无差异(P>0.05),术后1 d两组CD3+、CD4+、CD8+、CD4+/CD8+水平降至最低,术后4 、7 d逐渐升高。术后4 、7 d,免疫微生态肠内营养组患者CD3+、CD4+、CD4+/CD8+水平均优于常规组(P <0.05),组间C D 8+水平差异无统计学意义(P>0.05)(表5-6)。
表5 两组患者 CD3+、CD4+水平比较(±s,n=48)
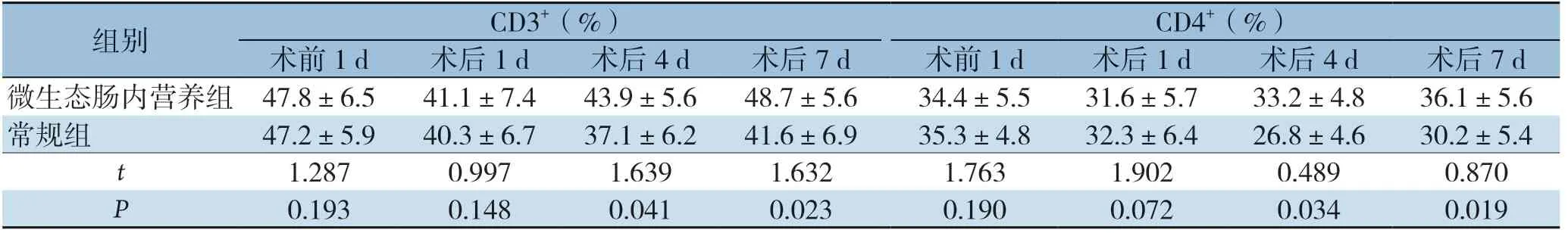
表5 两组患者 CD3+、CD4+水平比较(±s,n=48)
组别 CD3+(%) CD4+(%)术前1 d 术后1 d 术后4 d 术后7 d 术前1 d 术后1 d 术后4 d 术后7 d微生态肠内营养组 47.8±6.5 41.1±7.4 43.9±5.6 48.7±5.6 34.4±5.5 31.6±5.7 33.2±4.8 36.1±5.6常规组 47.2±5.9 40.3±6.7 37.1±6.2 41.6±6.9 35.3±4.8 32.3±6.4 26.8±4.6 30.2±5.4 t 1.287 0.997 1.639 1.632 1.763 1.902 0.489 0.870 P 0.193 0.148 0.041 0.023 0.190 0.072 0.034 0.019
表6 两组患者 CD8+、 CD4+/CD8+水平比较(±s,n=48)
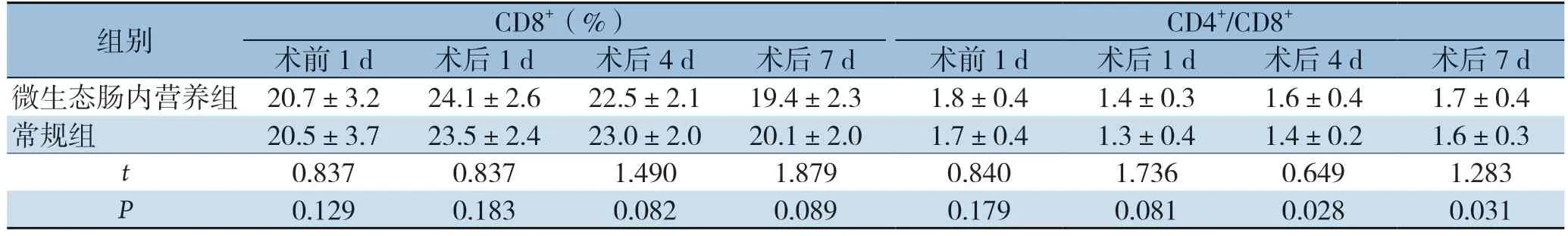
表6 两组患者 CD8+、 CD4+/CD8+水平比较(±s,n=48)
组别 CD8+(%) CD4+/CD8+术前1 d 术后1 d 术后4 d 术后7 d 术前1 d 术后1 d 术后4 d 术后7 d微生态肠内营养组 20.7±3.2 24.1±2.6 22.5±2.1 19.4±2.3 1.8±0.4 1.4±0.3 1.6±0.4 1.7±0.4常规组 20.5±3.7 23.5±2.4 23.0±2.0 20.1±2.0 1.7±0.4 1.3±0.4 1.4±0.2 1.6±0.3 t 0.837 0.837 1.490 1.879 0.840 1.736 0.649 1.283 P 0.129 0.183 0.082 0.089 0.179 0.081 0.028 0.031
3 讨 论
近年来我国结直肠癌的发病率和病死率呈上升趋势[18]。结直肠癌的年龄标准化发病率男性(20.6/10万例)高于女性(14.3/10万例)。75%的直肠癌患者诊断时年龄≥50岁,80%的结肠癌患者诊断时年龄≥60岁[19-20]。对于不伴有远处转移的患者,治疗的手段首选为手术切除。因此,寻找有效的围手术期治疗方案有积极意义。
手术创伤后的高分解状态使谷氨酰胺不足,导致肌肉蛋白质-能量营养不良、肠黏膜屏障破坏,免疫细胞和免疫球蛋白合成受损,出现细菌移位[21]。益生菌具有定植、排他及繁殖性,可改善肠道内环境,维护消化道屏障功能,保持肠黏膜的完整性,提高肠道耐受性。肠内营养混悬液为复方制剂,含有多种人体必须的营养素,可以满足机体营养需求。
由于结直肠癌术后并发症发生率高,与患者预后生存质量明显相关,因此有效降低并发症发生率具有重要的现实意义。本研究中,所有手术患者均采用ERAS策略[22-23],免疫微生态肠内营养组的出现首次肠鸣音的时间、首次排气时间、首次排便时间和住院时长均优于常规组(P <0.05);免疫微生态肠内营养组并发症发生率明显低于常规组,差异有统计学意义(P <0.05)。与康利民等[21]研究结果一致。可见免疫微生态肠内营养能改善患者的肠道耐受性,促进胃肠道蠕动,提高胃肠功能,缩短住院时间,降低并发症发生率。分析原因为肠道益生菌可显著限制致病性的肠道微生物与肠黏膜上皮接触、黏附或定植,有助于排出及杀灭病原微生物,且能起到促进消化的作用。
营养不良是患者最常见的潜在危险因素之一,也是术后预后不良的最强预测因素[24]。PA和ALB是反映患者营养状况的可靠、简便的指标[25-27]。彭婷婷等[13]对急性胰腺炎患者早期实施合理的免疫微生态肠内营养治疗,较好地了改善其营养及代谢需要。本研究中,术前两组PA、ALB含量无差异(P>0.05),术后1 d两组患者PA和ALB含量在降至最低,术后4 、7 d逐渐升高;术后4 d、7 d,免疫微生态肠内营养组患者PA和ALB含量均高于常规组(P<0.05)。由此可见,本研究也证实术前及术后的免疫微生态肠内营养治疗有助于提升患者术后的营养状态。这是由于肠内营养混悬液为机体补充了足够的能量以对抗机体损伤。
免疫细胞在调节肿瘤的生长、进展或消除中起着重要作用[28],本研究分析T细胞亚群,发现术前两组CD3+、CD4+、CD8+、CD4+/CD8+水平无差异(P>0.05),术后1 d两组CD3+、CD4+、CD8+、CD4+/CD8+水平降至最低,术后4 、7 d逐渐升高。术后4 、7 d,免疫微生态肠内营养组患者CD3+、CD4+、CD4+/CD8+水平均优于常规组(P<0.05),组间C D 8+水平差异无统计学意义(P >0.05)。邵峰等[29]在合并糖尿病的胃肠道肿瘤患者中也发现应用免疫微生态肠内营养能改善患者的免疫状态。这可能是因为谷氨酰胺是一种免疫营养素,可以增强机体免疫功能。
综上,免疫微生态肠内营养治疗中每种物质不仅有特定作用,而且可以相互促进,协同起效,比如益生菌的代谢产物可刺激机体的免疫应答,能够增强巨噬细胞的吞噬功能以及补体系统活性,增强机体免疫功能等[30-31]。本研究证实,免疫微生态肠内营养联合加速康复策略有助于促进结直肠癌患者术后肠蠕动的恢复,提高营养状态,并增强免疫水平,利于患者早日康复。
鉴于本研究病例数相对较少,在接下来的研究中我们将扩大样本量,深入挖掘可以改善结直肠癌患者围手术期身体状态的方法,以期更有效地降低术后并发症的发生率,提高患者术后生存率,改善患者生存质量。

