NIMA相关激酶2在胰腺癌中的表达及其临床意义
刘向梅,许达峰,王春玲,符于正,王丹,武金才
(海南省人民医院/海南医学院附属海南医院 肝胆胰外科,海南 海口 570000)
胰腺癌是消化系统常见的恶性肿瘤,在美国癌症病死率中排第四[1]。在我国,据2018年国家癌症中心发布的 2003—2013年居民癌症数据显示,胰腺癌发病率排第10位,病死率排第5位,其1年和5年生存率分别为26%和8%[2-5]。
由于其发病隐匿,多数患者在确诊时已处于晚期或转移,患者常在确诊后1年内死亡。手术仍是胰腺癌治疗的主要手段,但治疗效果并不佳。NIMA相关激酶2(NIMA-related kinases 2,NEK2)属于丝氨酸/苏氨酸激酶家族,其主要功能是调控与细胞有丝分裂有关的纺锤体组装和中心体复制[6]。在食管鳞癌[7]、前列腺癌[8]、肝癌[9]、 口腔鳞状细胞癌[10]及肾癌[11]中NEK2高表达,且NEK2高表达与预后差及肿瘤进展相关。然而,尚无研究探讨NEK2在胰腺癌组织中的表达及与预后的关系。本研究旨通过免疫组化研究NEK2在人胰腺癌组织中的表达,并阐明其临床意义及与预后的关系。
1 资料与方法
1.1 组织标本收集
收集海南省人民医院肝胆胰外科于2013年 1月—2014年12月接受胰腺癌切除术的患者组织标本,共108例。胰腺导管腺癌有83例、黏液癌 22例,鳞癌3例;TNM分期I期15例、II期29例、III期64例。纳入标准:(1) 按照NCCN指南[12]患者均接受胰腺癌切除术,其中59例患者接受胰十二指肠切除术,49例患者接受胰体尾切除术,且病理确诊为胰腺癌;(2) 患者临床及随访资料齐全。剔除标准:患者存在其他部位肿瘤,且不能行手术治疗者。经手术切除下来的胰腺癌组织,均保存于科室研究室-80 ℃冰箱,并经石蜡包埋,经组织切片切成4 μm的组织切片待做免疫组化检测。该研究经医院伦理委员会批准同意实施。
1.2 病历收集及随访
对108例胰腺癌患者的性别、年龄、吸烟、癌胚抗原(carcinoembryonic antigen,CEA)、肿瘤大小、肿瘤部位、糖类抗原199(carbohydrate antigen 199,CA19-9)、TNM分期、肿瘤分化程度、淋巴结转移等一般资料进行收集,术后随访每3个月随访1次,采用电话或门诊复诊的形式随访,随访内容包括患者生存及复发等。定义无瘤生存时间为胰腺癌术后至复发时间,定义总生存时间为胰腺癌术后至死亡时间,平均随访时间(55.3±6.7)个月,2020年1月为截止时间,6年为最长随访时间,108例患者共有4例失访, 失访病例在生存曲线上为截断值。
1.3 实验试剂
NEK2羊抗人单克隆抗体购自美国Abcam公司,兔抗羊二抗购自美国cell signaling Technology公司,两步法免疫组化试剂盒购自美国Invitrogen公司。
1.4 免疫组化和组化评分
对108 例石蜡组织标本切成约4 μm 厚的切片,按两步法行免疫组织化学染色,简要步骤如下:将组织切片在65 ℃烘片后,用二甲苯及酒精梯度脱蜡,采用3%双氧水室温灭活过氧化物酶15 min,柠檬酸钠行抗原修复,漂洗,3%胎牛血清蛋白封闭30 min后,加入NEK2羊抗人一抗(1:300),并在4 ℃下孵育过夜,漂洗3次,加入兔抗羊二抗(1:500),37 ℃下避光孵育2 h后加入显色剂,设立阳性及阴性对照,当浅黄色出现时终止染色,苏木素复染。免疫组化评分采用国际通用的评分规则,即总评分=染色强度评分+阳性细胞百分比评分,其中阳性细胞<5%计0分;阳性细胞5%~35%计1分;阳性细胞36%~65%计 2分;阳性细胞>66%计3分。不显色计0分;浅黄色计1分;棕黄色计2分;深褐色计3分。总分≥4分,为高表达组,共63例;总分<4分,为低表达组,共45例。
1.5 统计学处理
统计软件采用SPSS 19.0版本,以例数(百分比)[n(%)]表示计数资料,NEK2表达与临床病理因素的关系采用χ2检验,无瘤生存率及总生存率的差异采用Kaplan-Meier曲线和Log-rank比较,影响预后的单因素及多因素分析采用Cox风险比例模型,P<0.05为差异有统计学意义。
2 结 果
2.1 NEK2 在正常胰腺及胰腺癌组织中的表达
在正常胰腺组织中NEK2不表达,在胰腺癌组织中NEK2染色定位于细胞膜、细胞质,在胰腺癌组织中NEK2高表达组有63例,占58.3%,NEK2低表达组有45例,占41.7%,NEK2在正常胰腺及胰腺癌组织中的典型组化图见图1。
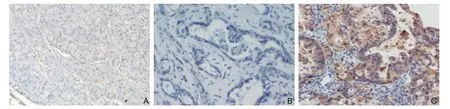
图1 免疫组化检测NEK2 表达(×200) A:NEK2 在正常胰腺组织中呈阴性表达;B:NEK2 在胰腺癌组织中呈低表达;C:NEK2 在胰腺癌组织中呈高表达Figure 1 Immunohistochemical staining for NEK2 expression (×200) A: Negative NEK2 expression in normal pancreas tissue; B: Low NEK2 expression in pancreatic cancer tissue; C: High NEK2 expression in pancreatic cancer tissue
2.2 NEK2 的表达与胰腺癌临床病理因素的关系
NEK2表达与患者性别、年龄、吸烟、CEA、肿瘤大小、肿瘤部位无明显关系(均P>0.05),而与CA19-9(P=0.015)、TNM分期(P=0.002)、肿瘤分化程度(P=0.034)、淋巴结转移(P=0.043)明显有关(表1)。
2.3 NEK2 的表达与胰腺癌预后的关系
NEK2高表达组1、3、5年无瘤生存率分别为60.5%、20.7%、5.2%,NEK2低表达组1、3、5年无瘤生存率分别为75.4%、50.6%、24.9%,NEK2 高表达组无瘤生存率低于NEK2 低表达组(P=0.000)。NEK2高表达组1、3、5年总生存率分别为75.6%、42.2%、15.3%,NEK2低表达组1、3、5年总生存率分别为85.7%、60.6%、30.1%,NEK2高表达组总生存率低于NEK2低表达组(P=0.000)(图2)。
2.4 影响胰腺癌无瘤生存率的危险因素分析
单因素分析示CA19-9、TNM分期、分化程度、淋巴结转移及NEK2高表达为影响无瘤生存率的危险因素,多因素分析示TNM分期(P=0.029)、淋巴结转移(P=0.016)及NEK2高表达(P=0.032)为影响无瘤生存率的危险因素(表2)。
2.5 影响胰腺癌总生存率的危险因素分析
单因素分析示TNM分期、分化程度、淋巴结转移及NEK2表达为影响总生存率的危险因素,多因素分析示TNM分期(P=0.035)、分化程度(P=0.042)、淋巴结转移(P=0.006)及NEK2高表达(P=0.000)为影响总生存率的危险因素 (表3)。
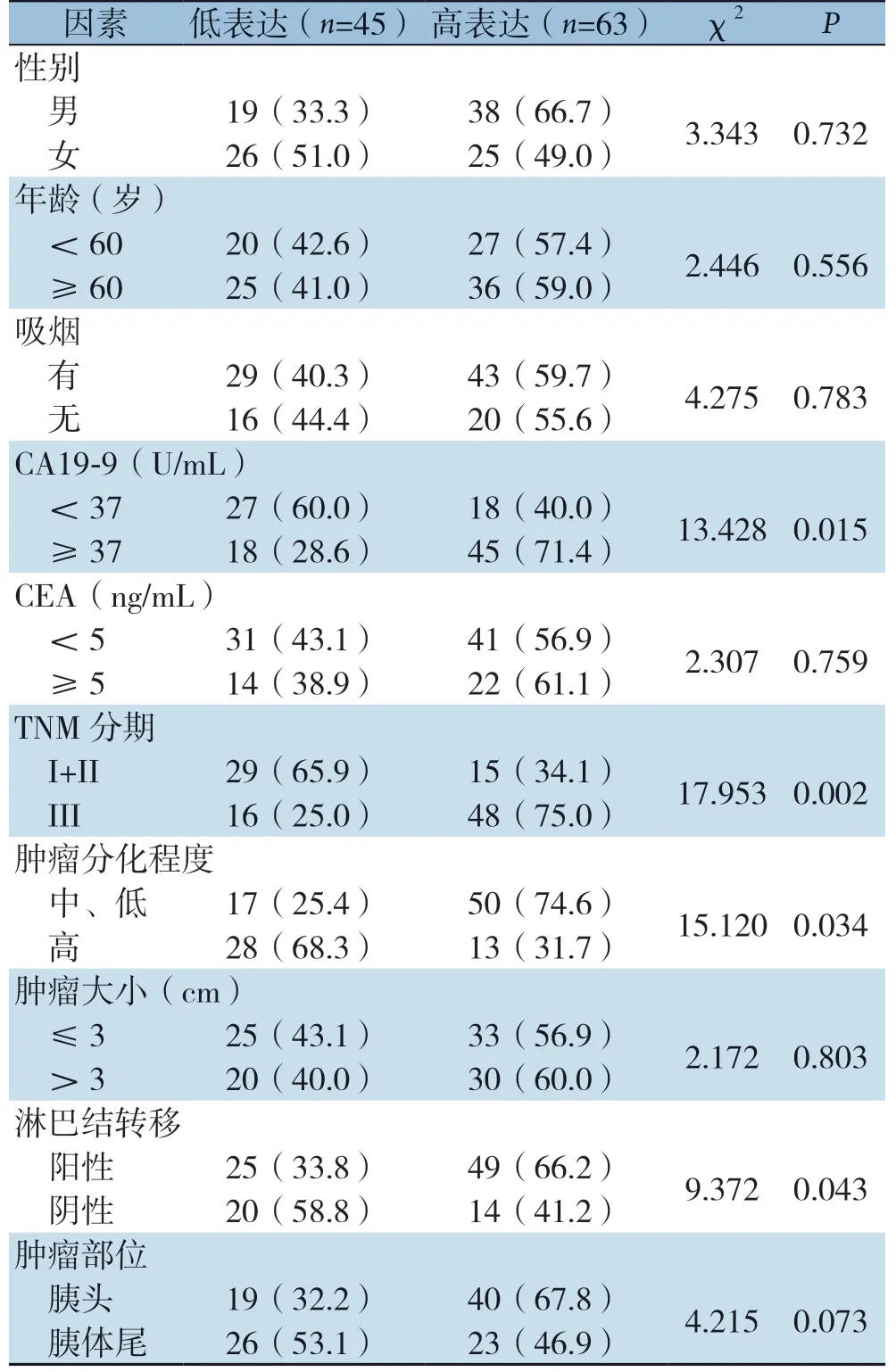
表1 NEK2 的表达与胰腺癌临床病理因素的关系[n(%)]Table 1 Relationship between NEK2 expression and clinicopathologic factors of pancreatic cancer [n (%)]
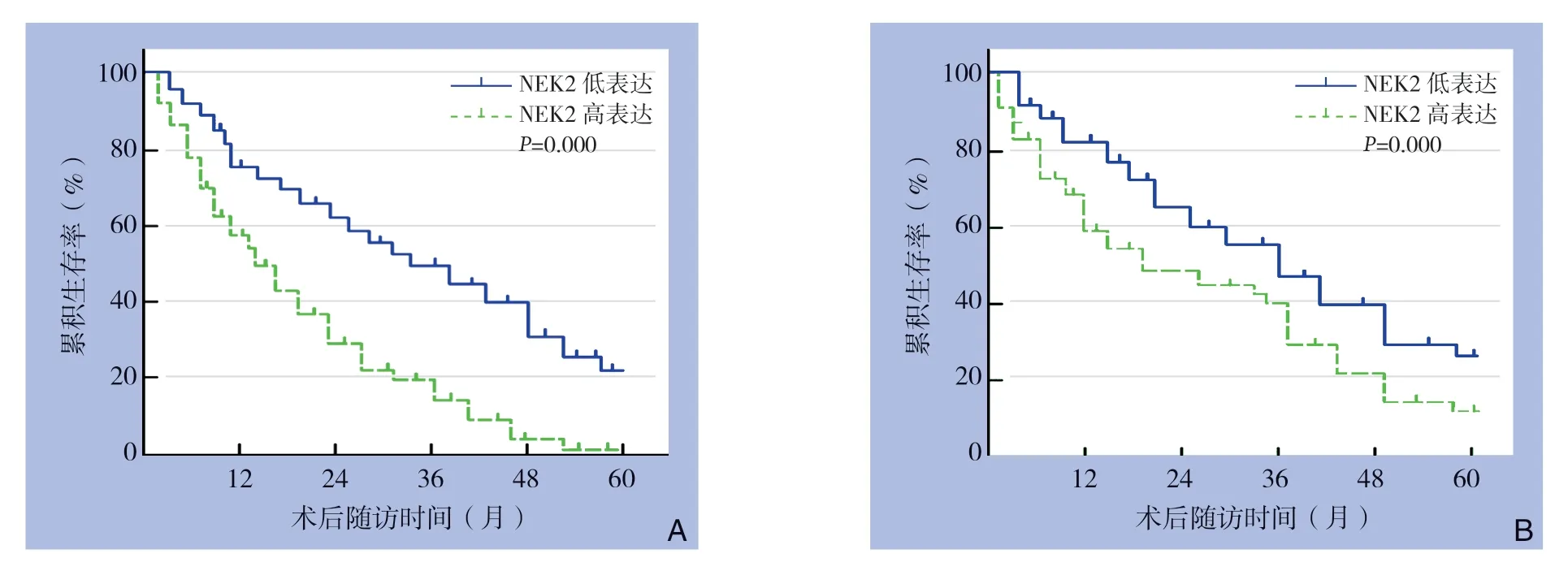
图2 不同NEK2 表达水平患者生存曲线 A:无瘤生存曲线;B:总生存曲线Figure 2 Survival curves of patients with different NEK2 expression levels A: Tumor-free survival curve; B: Overall survival curve
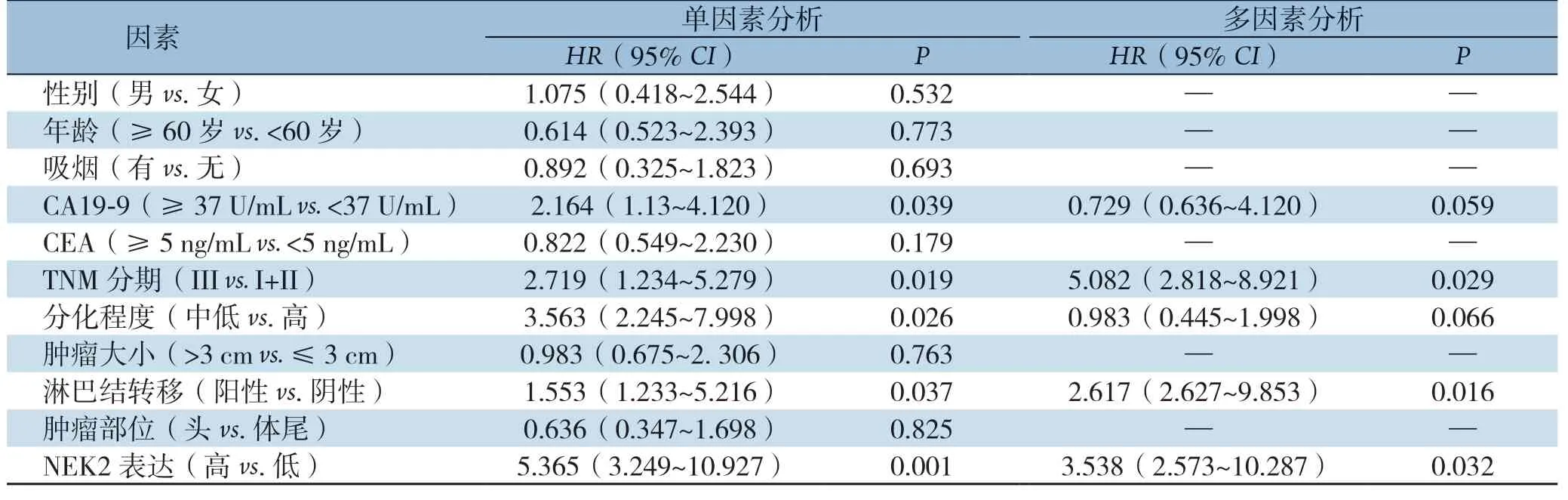
表2 影响胰腺癌患者无瘤生存率的危险因素分析Table 2 Analysis of risk factors influencing disease-free survival of pancreatic cancer patients
3 讨 论
胰腺癌病情进展快,恶性程度高,全球范围内发病呈逐渐增加趋势[13],虽然手术可延长患者总生存时间,但仅20%的胰腺癌可手术切除,15%~20%的胰腺癌患者在确诊时就是晚期不可切除状态,总生存率较低[14-17]。尽管已经有以手术为主、放化疗为辅的胰腺癌综合治疗策略,由于缺乏可靠的早期标志物,且容易发生血管浸润转移,在确诊时多数患者处于晚期,胰腺癌患者中位生存期也仅6~12个月[18]。深入研究胰腺癌的发病机制对靶向药物的研发,提升胰腺癌的治疗水平极其重要。
遗传不稳定性是肿瘤发生的常见机制,一方面由于DNA损伤修复异常导致突变增加。另外,非整倍体和染色体不稳定是常见的现象,这种现象的产生常是由于细胞有丝分裂失控、纺锤体形成异常所致[6]。染色体有丝分裂调控失常是多种恶性肿瘤发生的中心环节。NEK2是中心体的一个核心组成原件,在细胞分裂周期中发挥关键作用。NEK2能够在有丝分裂的初始阶段对多种蛋白磷酸化,导致中心体的正确分离,另外还可调节中心体中微管的结构[19]。已有研究发现NEK2作为丝氨酸/苏氨酸激酶参与调控细胞周期,且可通过与多态性蛋白复合体异常结合,导致细胞通过细胞周期检验点异常,最终形成非整倍体细胞,进而引起细胞结构和功能基因异常表达[20]。在乳腺癌中,NEK2及cyclin D1的异常高表达可能与中心体扩增而导致的癌症发展有关[21]。
文献[22]报道在乳腺癌细胞系中敲除NEK2基因会导致癌细胞增殖、迁移和克隆形成被抑制,同时侵袭和迁移能力也有相应削弱,另外癌细胞的凋亡显著增加。在胰腺癌细胞系中也有类似的现象,敲除NEK2可抑制胰腺癌细胞侵袭和迁移[23]。在本研究中,通过免疫组化对108例胰腺癌组织的NEK2表达进行分析,发现NEK2在胰腺癌组织中表达高于正常胰腺组织,这提示NEK2可能在胰腺癌发生发展过程中发挥促癌作用。临床病理相关性分析发现,NEK2高表达与CA19-9、TNM分 期、肿瘤分化程度及淋巴结转移相关。进一步行生存分析发现,NEK2高表达组无瘤生存率及总生存率均低于NEK2低表达组,表明NEK2高表达提示胰腺癌患者术后预后不佳。具体的分子机制尚不清楚,已有研究发现在肝癌中,NEK2可通过激活PP1/Akt及Wnt信号途径促进肿瘤发展[24]。PAKT/NF-кB和MMP也可被NEK2激活而促进肝癌细胞转移[25]。在胰腺癌中,本研究推测NEK2的高表达可能通过影响染色质稳定性及非整倍体诱导,而导致胰腺癌细胞恶性增殖及转移。
在尤文氏瘤和非霍奇金淋巴瘤中发现, NEK2 mRNA表达水平与此类肿瘤表达密切相关[26]。而在滤疱性淋巴瘤恶化成侵袭性更高的弥漫性大B细胞淋巴瘤中,NEK2高表达与肿瘤恶性程度相关,伴随着患者存活期缩短,对化疗反应性也减弱[27]。在肾乳头状癌中,NEK2高表达的患者预后较差,NEK2高表达可作为影响肾乳头状癌预后的独立危险因子[28]。本研究发现,TNM分期、淋巴结转移及NEK2表达为影响无瘤生存率的危险因素,TNM分期、分化程度、淋巴结转移及NEK2表达为影响总生存率的危险因子,NEK2高表达与患者预后差相关。这些结果提示NEK2可作为胰腺癌术后患者预后判断的分子标志物。
综上,本研究发现NEK2在胰腺癌中高表达,NEK2高表达与胰腺癌恶性临床病理特征及预后差相关,NEK2高表达为影响胰腺癌术后患者预后的独立危险因素,可作为胰腺癌术后患者预后判断的指标。

