宏基因组测序诊断吉伦伯不动杆菌脑室炎一例
王帝 韩冰莎 李娇 王瑞康 韩朋 冯光
患儿 男性,13岁,中学生,因头痛伴恶心、呕吐8小时,于2021年4月1日入院。患儿8小时前早自习时突发头痛,伴恶心、喷射状呕吐,随即出现意识障碍,呼之不应,无全身抽搐、口吐白沫、口角歪斜、大小便失禁等症状,急诊至当地医院就诊。头部CTA检查显示右侧枕叶出血破入侧脑室(图1),急诊行双侧侧脑室钻孔引流术,术后即刻患儿全身麻醉状态,双侧瞳孔直径约2 mm,对光反射迟钝,转入重症监护病房(ICU)。为求进一步治疗,当日转入我院神经外科重症监护病房。患儿既往身体健康,身高170 cm,体重50 kg,生长发育里程碑正常,父母非近亲婚配,均身体健康,家族中无类似疾病病史,无家族遗传性疾病病史。入院后体格检查:体温36.6℃,心率92次/min,呼吸24次/min,血压96/62 mm Hg(1 mm Hg=0.133 kPa),心、肺、腹部无明显异常;浅昏迷,双侧瞳孔等大、等圆,直径2 mm,对光反射迟钝;双侧侧脑室引流管通畅,可见血性液体,敷料包扎固定良好;左侧肢体肌力3级、右侧为4级,肌张力正常,共济运动和感觉系统检查无法配合,余神经系统查体未见异常。Glasgow昏迷量表(GCS)评分为6。实验室检查:血常规白细胞计数12.81×109/L[(3.50~9.50)×109/L],中性粒细胞计数11.70×109/L[(1.80~6.30)×109/L],中性粒细胞比例91.3%(40%~75%);降钙素原(PCT)0.58 ng/ml(<0.05 ng/ml);肝肾功能试验、电解质、凝血功能均正常。予质量分数20%的甘露醇125 ml/次、3次/d静脉滴注减轻脑水肿,头孢呋辛1.50 g/次、3次/d静脉滴注预防感染,并且控制脑脊液引流量于150~180 ml/d。病情稳定3日后(4月5日)DSA检查可见右大脑前动脉胼周段畸形(图2a),遂经Echelon10微导管(美国Echelon公司)释放弹簧圈(美国Microvention公司,1.50 mm×2.00 cm、1.50 mm×2.00 cm、1.50 mm×1.00 cm)形成“高压锅”,经Apollo微导管(美国Medtronic公司)注入Onyx-18胶后,颈动脉造影未观察到畸形团显影(图2b)。术后第2天(4月6日)出现发热,最高38.9℃,予物理降温后体温可降至正常,遂行腰椎穿刺脑脊液检查,白细胞计数为904×106/L[(0~8)×106/L],蛋白定量为1330 mg/L(150~450 mg/L),葡萄糖和氯化物均正常,细菌涂片和培养均呈阴性。4月8日复查脑脊液,白细胞计数2570×106/L,蛋白定量2650 mg/L,葡萄糖1.52 mmol/L(2.50~4.50 mmol/L)。由于患儿双侧侧脑室引流管留置时间长且引流管内可见絮状物,结合脑脊液检查和反复发热症状,考虑细菌性脑室炎,经验性予以美罗培南2 g/次、3次/d和万古霉素1 g/次、2次/d静脉滴注,并于4月9日拔除引流管。4月10日患儿病情突然加重,双侧瞳孔直径由2 mm扩大至4.50 mm,GCS评分为3,急行头部CT显示脑水肿严重,环池受压(图3a),遂行右侧额颞叶去骨瓣减压术,采取右侧扩大翼点入路,铣刀成形去除骨瓣,前方达额骨颧突,右侧上至顶结节前方、下至颧弓上缘和颞窝,脑组织张力高,瓣状剪开硬脑膜,打孔悬吊硬脑膜,皮下留置引流管。术中出血量约为100 ml,术后即刻体温为37.2℃,心率90次/min,血压120/90 mm Hg,双侧瞳孔等大、等圆,直径2 mm,对光反射迟钝,GCS评分为4,复查CT可见环池结构较前明显(图3b)。病程中患儿仍反复发热,多次复查脑脊液细菌涂片和培养均阴性。4月12日留取3 ml脑脊液送检北京金匙基因科技有限公司采用宏基因组第二代测序技术(mNGS)测序,结果回报显示,吉伦伯不动杆菌的序列数为583 094,相对丰度100%、覆盖度92.26%,检出耐药基因AAC(3)-Ⅱd、APH(3')-Ⅵ、AAC(6')-Ⅰh(氨基糖苷类抗生素耐药)、NDM-1(碳青霉烯类和β-内酰胺类抗生素耐药,表1)。遂停用万古霉素,改为舒巴坦1 g/次、2次/d静脉滴注,美罗培南剂量同前。治疗期间多次监测体温并复查脑脊液常规、生化和细菌培养(表2)。4月14日因脑脊液絮状物堵塞引流管,再次行左侧枕角脑室穿刺引流术,术中出血量10 ml,术后即刻体温38.3℃,心率80次/min,血压109/70 mm Hg,双侧瞳孔等大、等圆,直径2 mm,对光反射迟钝。4月15日脑脊液细菌培养+药敏试验显示为多重耐药琼氏不动杆菌,对阿米卡星、多黏菌素、复方磺胺、环丙沙星、左氧氟沙星、四环素敏感,余试验药物均耐药,遂改为复方磺胺甲唑0.96 g/次、4次/d口服,阿米卡星0.80 g/d和硫酸多黏菌素500×103U/次、2次/d静脉滴注,及多黏菌素20×103U/d鞘内注射。患儿体温及脑脊液检查结果较前好转(表2)。4月16日再次行脑脊液mNGS测序,吉伦伯不动杆菌序列数降至126,相对丰度58.75%、覆盖度0.25%。患儿自4月22日未再发热,而转为嗜睡,可遵医嘱动作,4月28日意识清楚,言语清晰,对答切题,四肢肌力4级,病情好转出院。共住院28天,后于当地医院继续上述抗感染治疗。出院1个月后随访,改良Rankin量表(mRS)评分为3,可在家人帮助下生活自理。目前仍在随访中。
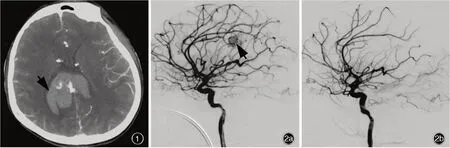
图1 急诊头部CTA检查(2021年4月1日)显示,右侧顶枕叶不规则高密度影,脑室系统高密度影(箭头所示),考虑出血破入侧脑室 图2 入院后DSA检查(2021年4月5日)所见 2a 侧位DSA显示右大脑前动脉胼周段不规则畸形血管团(箭头所示),大小约1.40 mm×1.60 mm×1.70 mm,经由胼胝体后静脉引流入横窦 2b 弹簧圈栓塞畸形血管团后,原异常信号区未见畸形团显影Figur e 1 Emergency head CTA(April 1,2021)showed irregular patchy high-density shadow in the right parieto-occipital lobe and high-density shadow in the ventricular system(arrow indicates),considering that hemorrhage ruptured into lateral ventricle. Figure 2 DSA findings of the patient(April 5,2021) Lateral DSA showed that irregular cerebrovascular malformation of pericallosal segment of right anterior cerebral artery(arrow indicates),about 1.40 mm×1.60 mm×1.70 mm in size,drained into the transverse sinus via posterior corpus callosal vein(Panel 2a).After embolization of the malformed vascular mass with coils,the malformed mass was not visualized in the original abnormal signal area(Panel 2b).
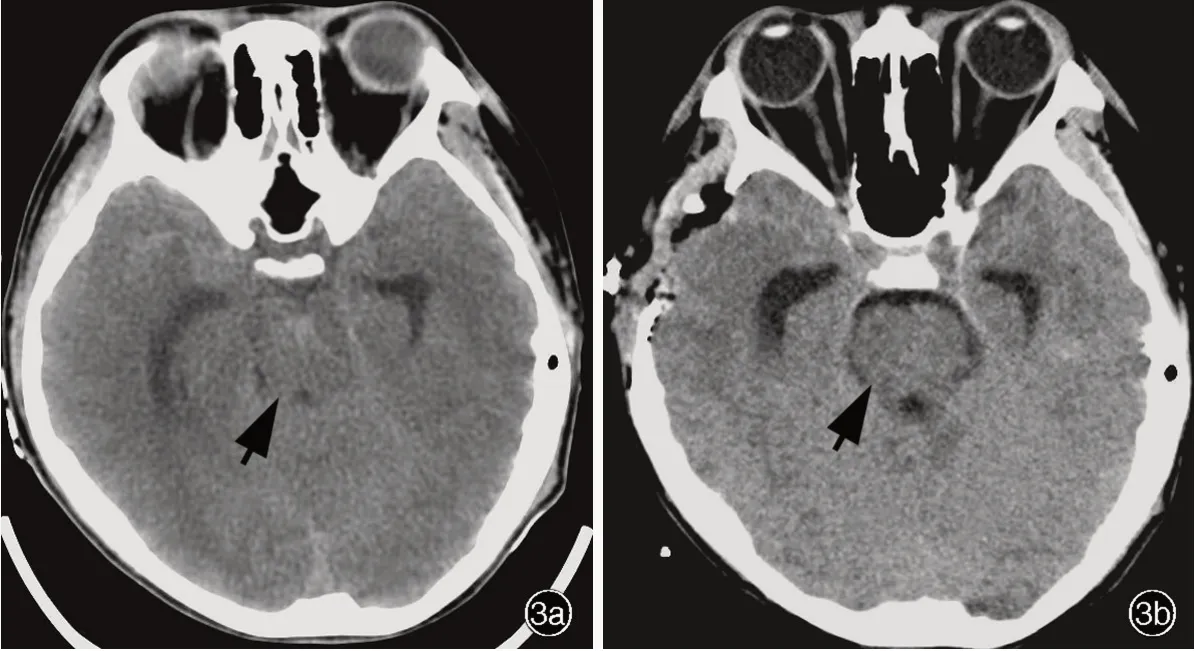
图3 去骨瓣减压术前后头部CT检查(2021年4月10日)所见 3a 术前横断面CT显示,环池受压明显(箭头所示) 3b 术后即刻横断面CT显示,右侧颞顶部骨瓣已去除,环池结构恢复正常(箭头所示)Figur e 3 Head CT findings before and after decompressive craniectomy (April 10,2021) Preoperative axial CT showed significant compression of cisterna ambiens (arrow indicates, Panel 3a).Immediate postoperative axial CT showed that the right temporoparietal bone flap had been removed,and the structure of cisterna ambiens returned to normal(arrow indicates,Panel 3b).
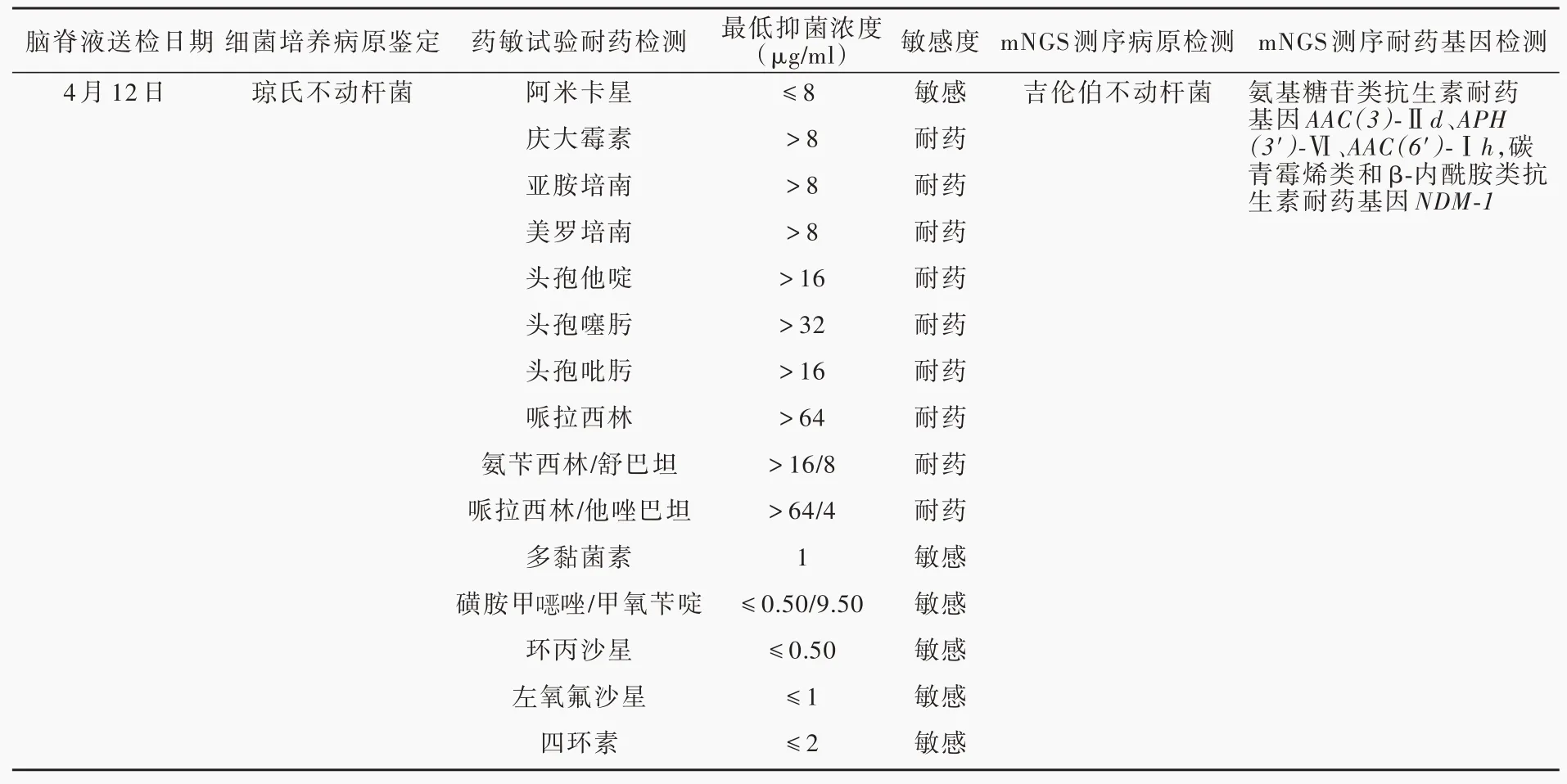
表1 脑脊液细菌培养+药敏试验与脑脊液mNGS测序的比对Table 1. Comparison of bacterial culture+drug sensitivity and mNGStesting of cerebrospinal fluid

表2 患儿体温及脑脊液动态变化Table 2. Dynamic changes of body temperature and cerebrospinal fluid of patient
讨 论
吉伦伯不动杆菌为革兰阴性杆菌,是严格需氧的球状杆菌,最早由Nemec等[1]于2009年从人类血液、尿液、痰液、阴道拭子、咽拭子标本中分离出来,可造成急性化脓性感染,是一种临床易忽视的机会性病原体,隶属不动杆菌属。不动杆菌是重要的医院感染病原体[2],最早由Brisou和Prevot于1954年提出[3],目前命名的菌种数量已达69种(The List of Prokaryotic names with Standing in Nomenclature:www.bacterio.net/acinetobacter.html)。其在自然界分布广泛,无论人类皮肤黏膜、动植物、水源、土壤等均可分离出[4]。不动杆菌生存能力顽强,最长可在外界环境中存活5个月以上,且可不断从外界捕获耐药基因并通过整合表达出新的耐药基因;此外,某些菌株可以附着在引流管表面形成生物膜而引起导管相关性感染;加之临床不规范应用抗生素,均是其产生耐药性和导致医院感染的重要原因[5]。现有研究多局限于鲍曼不动杆菌、琼氏不动杆菌等,而对其他不动杆菌的流行病学和临床意义知之甚少。吉伦伯不动杆菌临床罕见,并且临床常规检测方法无法检出,易误诊为其他菌种[6]。本文报道1例吉伦伯不动杆菌感染患儿,进而更全面认识不动杆菌属,避免临床不合理应用抗生素,减少医院感染的暴发流行,改善患者预后。
目前国内外仅报告1例吉伦伯不动杆菌感染病例,为1例白内障患者,术后第3天房水浑浊,房水常规检查提示大量白细胞,革兰染色为阴性杆菌,但细菌培养阴性,进一步行基因测序证实为吉伦伯不动杆菌,玻璃体内持续注射头孢他啶和阿米卡星9天,感染症状逐渐消退[7]。不动杆菌属中非鲍曼不动杆菌对大多数抗生素较为敏感,但本文病例显示吉伦伯不动杆菌具有多重耐药特性,对包括碳青霉烯类在内的重症感染常用抗生素均不敏感,提示临床应提高对少见、罕见细菌的认识,警惕导致医院感染和暴发流行的潜在菌种,增加更精准化的诊断方式并进行针对性治疗。吉伦伯不动杆菌对头孢菌素类天然耐药,且使碳青霉烯类抗生素的最低抑菌浓度(MIC)增加2~64倍[8],上述结论与本文病例的耐药基因检测结果和药敏试验结果相一致。本例患儿经历多次头部手术,且留置双侧侧脑室外引流管未皮下潜行,留置时间较长,均是引起脑室炎的危险因素[9],虽然无法确定吉伦伯不动杆菌的来源及传播途径,但可能与患儿年龄小、抵抗力差、血-脑屏障破坏、开颅手术、长时间重症监护病房住院、应用广谱抗菌药物等有关。为快速控制感染、改善预后,明确病原菌及耐药性后第一时间采取静脉滴注联合脑室内注射敏感抗生素的方案,治疗效果明显,提示脑室内联合静脉应用抗生素治疗脑室炎安全、有效[10]。
脑室炎是颅内感染中较难治的类型,尤其随着抗生素的广泛应用,多重耐药革兰阴性菌导致的脑室炎病例数逐年增加,病死率可达70%[11]。早期诊断、选择合理的抗生素、用药途径和疗程是影响预后的重要因素[12]。临床高度怀疑脑室炎时,应根据当地流行病学特点立即予以经验性抗感染治疗,并及时行脑脊液检查,根据细菌培养和药敏试验结果调整抗生素的应用。然而,常规脑脊液细菌培养阳性率仅30%~40%[13],且难以鉴定罕见或新发病原体,培养周期较长,均增加临床针对性治疗的难度。mNGS测序不依赖微生物群落培养,仅需少量样本提取的核酸,即可测定样本中所有微生物的核酸序列,检测出致病菌尤其是罕见菌和未知菌,敏感性较高[14]。Wilson等[15]报告1例脑膜炎患者,多次实验室检查均无法明确病原体,经脑脊液mNGS测序检出卡奇谷病毒,并经多重聚合酶链反应(PCR)和免疫组化染色进一步证实。Yao等[16]对3例脑脊液细菌培养阴性的脑膜炎患者采用mNGS测序,检出李斯特菌,随后的PCR结果与之相符。Wang等[17]通过对疑诊为结核性脑膜炎患者的脑脊液行mNGS测序,发现马尔尼菲青霉菌,并及时将抗结核药物更换为伏立康唑,经过3周治疗,病情显著好转。本文病例脑脊液细菌培养显示琼氏不动杆菌,但mNGS测序为吉伦伯不动杆菌,考虑原因为:(1)目前医院的临床微生物实验室是通过微生物分析仪器鉴别菌种,鉴定系统数据库内不包含吉伦伯不动杆菌。(2)菌种鉴定对检验科医师的检测经验要求较高,存在一定的主观性和经验性。(3)吉伦伯不动杆菌可能与其他不动杆菌属内菌种在菌落形态、理化特性、特征化学成分及典型差异上较为相似,易误诊。(4)常规微生物培养除受其自身遗传特性决定外还受外界多方面因素如培养基营养物质浓度、温度、水分等的影响,对实验条件依赖性较高,可能影响鉴定结果。虽然目前临床公认脑脊液培养是病原体鉴定的“金标准”,但在菌种鉴定时可能出现错误,尤其对于罕见菌种。而mNGS测序对病原体的鉴定更精准,可以准确鉴定病原菌种信息,尤其是对于同属内不常见的菌种。此外,mNGS测序还可检测耐药基因、毒力因子、基因组覆盖度等,对于指导诊断及抗感染治疗具有辅助作用。本文患儿调整抗感染治疗方案后基因组覆盖度由92.26%降至0.25%,同时结合菌种序列数的变化,可以为临床医师提供量化的疗效信息,从而更具体化的评估病情。提示mNGS测序可以有效弥补常规检查方法的不足,使抗感染治疗事半功倍[18-21]。
微生物基因组测序进行细菌耐药研究一直受到临床的关注,基于纯菌株全基因组测序(WGS)或临床标本mNGS测序的相关研究业已取得一定成果。Su等[22]和Boolchandani等[23]分别对此进行较全面的综述,总结耐药测序分析常用的软件、方法以及耐药基因和细菌耐药的数据库[22-23]。Nguyen等[24]针对非伤寒沙门菌,基于菌株基因组及其耐药表型数据,采用机器学习方法构建模型进行耐药表型预测,准确率达95%以上。然而,涉及临床检测转化应用层面,上述方法主要针对细菌行WGS测序,且受限于对病原菌的分离培养。目前耐药基因临床检测的应用主要集中于已探明耐药机制的有限靶基因上,通过检测目标菌种靶基因有无相应突变等特征进行耐药表型预测,如金黄色葡萄球菌甲氧西林耐药基因mecA、肠球菌万古霉素耐药基因VanA/B、肠杆菌碳青霉烯耐药基因KPC/NDM/VIM/IMP/OXA-48[25]、结核分枝杆菌(MTB)利福平耐药相关基因rpoB等,对于细菌耐药性的检测,尚缺乏一种更为广泛且有效的检测手段。而临床标本病原菌mNGS测序,除可以提供病原体的精准鉴定外,还可以进一步进行耐药基因分析,得出药敏预测信息,具有指导临床精准用药的潜在价值。本例患儿行脑脊液mNGS测序,既准确鉴定出少见病原菌,又检出与耐药关联度较高的产新德里金属β-内酰胺酶(NDM)基因、氨基糖苷类抗生素耐药基因AAC(3)-Ⅱd、APH(3')-Ⅵ、AAC(6')-Ⅰh,并与药敏试验具有较高的一致性(表1)。
神经外科手术后颅内感染发生率高,常规脑脊液细菌培养检出率低,难以明确病原菌,导致抗生素滥用,诱导细菌耐药,不利于临床结局。mNGS测序可以有效弥补传统检测方法的不足,帮助临床医师快速明确病原学诊断,且随着耐药基因检测技术研究热度的增高,未来基因测序在感染中的应用将越来越广泛,从而为患者带来更多福音。
利益冲突无
【点评】 该文报道1例脑血管畸形致出血经双侧侧脑室引流后发生中枢神经系统感染的青少年患者,采用宏基因组第二代测序技术(mNGS)诊断为吉伦伯不动杆菌脑室炎,并进一步检出耐药基因AAC(3)-Ⅱd、AAC(6')-Ⅰh、APH(3')-Ⅵ(氨基糖苷类抗生素耐药)、NDM-1(碳青霉烯类和β-内酰胺类抗生素耐药)。临床根据基因检测结果及时调整抗生素治疗方案,10天后体温恢复正常,病情趋于稳定,16天后病情好转出院。mNGS测序技术对快速明确病原体、合理选择抗生素以改善患者预后、减少医院感染具有重要意义。该例患者为国人吉伦伯不动杆菌脑室炎的首例报道,亦为全球第2例明确诊断的吉伦伯不动杆菌感染病例。吉伦伯不动杆菌最早由Nemec等于2009年自人类血液、尿液、痰液、阴道拭子、咽拭子标本中分离出来,隶属不动杆菌属,为革兰阴性、严格需氧的球状杆菌,可以造成急性化脓性感染,是一种临床易忽视的机会性病原体。自2014年mNGS测序技术应用于临床以来,对快速检出病原体、明确感染原因、指导临床诊断与治疗具有重要意义,是近年临床诊断的重大突破和进展。实际工作中既要重视新技术的应用,指导临床实践;也要正确应用新技术,结合临床进行合理解读。对于疑似急性中枢神经系统感染患者,在有条件的医疗机构,推荐抽取脑脊液的同时留存2 ml标本于-16~20℃冰箱,完成常规生化检查和培养,或者传统聚合酶链反应(包括基于探针的多重聚合酶链反应)后,若3天内未获得明确的病原学证据且经验性抗感染治疗无效,推荐对留存的脑脊液标本行mNGS测序;如果未留存脑脊液标本,应重新采集标本。对于慢性中枢神经系统感染及需要随访病原学证据的患者,可首选脑脊液mNGS测序。送检标本应直接从患者感染部位的体液或组织中采集(A级推荐,Ⅱ类证据),送检过程须严格遵守无菌原则,mNGS测序流程应进行严格的质量控制,其结果的解读和验证应密切结合临床表现和实验室检查,同时应注意排除检出病原体的定植。
下期内容预告本刊2022年第1期报道专题为炎症与神经系统疾病,重点内容包括:论自身免疫性脑炎责任抗体的致病性;中枢神经系统免疫性疾病单细胞组学研究进展;肠道微生物在神经系统自身免疫性疾病中研究进展;基于临床表型的神经系统自身免疫性疾病诊断与治疗策略;自身免疫性神经肌肉接头病致病抗原和抗体的检测方法及临床诊断意义;复发性脑炎和脑膜炎管理策略;视神经神经炎谱系病与妊娠;中枢神经系统炎性脱髓鞘疾病生物学标志物研究进展;缺血性脑卒中免疫学研究进展

