诱导肿瘤发生免疫原性细胞死亡的疗法研究进展
卞正颖,许卓,唐铁军,郭薇
(中国药科大学生命科学与技术学院,江苏 南京210009)

传统抗肿瘤化疗药物的设计,旨在抑制肿瘤生长、发育和增殖,通常具有较高的细胞毒性和较低的靶向性,易引起多种副作用,产生耐药性,对于一些恶性程度高的中晚期肿瘤治疗效果不佳。一些化疗药物引起的细胞死亡是非免疫原性的,死亡的肿瘤细胞可被机体清除而不激活免疫反应,是一种耐受性过程,从而无法产生长效的抗肿瘤效果[1-2]。然而,在临床研究中发现,某些化疗药物如蒽环类药物、奥沙利铂等不仅能够诱导肿瘤细胞凋亡,而且能够引起肿瘤患者瘤内细胞毒性CD8+T细胞增多、调节性T 细胞(T regulatory cells,Treg)减少[3-4],产生适应性免疫应答。动物模型研究显示,蒽环类药物或奥沙利铂在免疫完全小鼠中的抗肿瘤效果好于免疫缺陷小鼠,说明这种适应性免疫应答的激活依赖于机体免疫系统的作用[5-6]。蒽环类药物和奥沙利铂这类化疗药物,能够诱导肿瘤细胞死亡,并且激活机体免疫系统来对抗死细胞抗原,赋予死亡的肿瘤细胞免疫原性,这一过程称为免疫原性细胞死亡(immunogenic cell death,ICD)。当细胞发生ICD,将死的细胞产生新的抗原表位并释放损伤相关分子模式(damage associated molecular patterns,DAMPs),招募抗原呈递细胞,识别、吞噬死细胞抗原,并将其呈递给T 细胞,激活适应性免疫应答识别并清除肿瘤抗原,从而产生长效的抗肿瘤免疫效应[7]。因此,将ICD 诱导剂合理、安全地应用到肿瘤治疗中,对于激活机体抗肿瘤免疫,产生长远的抗肿瘤效果具有重要意义。本文就ICD 的分子标记以及目前临床前或临床研究中潜在的ICD 诱导剂研究进展进行综述,以期为新型ICD 诱导剂的研发及其临床应用提供参考。
1 免疫原性细胞死亡的分子标记
1.1 未折叠蛋白反应相关分子标记
内质网(endoplasmic reticulum,ER)是蛋白质合成、折叠、运输以及储存钙离子的主要场所。当ER 中蛋白质加工发生错误时,为了快速发现并准确应对这些错误,维持ER 稳态,产生进化保守的适应性机制,称为未折叠蛋白反应(unfolded protein response,UPR)[8]。适当的UPR 能够维持细胞稳态,促进细胞存活,而过度激活的UPR则会引起ER应激。ICD 是一种促炎性细胞死亡,发生ICD 的关键是产生持续的活性氧(reactive oxygen species,ROS)和ER 应激。ICD 引起的ER 应激伴随着免疫刺激因子以及DAMPs 的释放,与固有免疫细胞表面的模式识别受体(pattern recognition receptor,PRR)结合,刺激免疫系统产生肿瘤相关抗原特异性T 细胞,进一步诱导肿瘤细胞死亡以及免疫记忆的建立。
ICD 前期,ER 分子伴侣钙网蛋白(calreticulin,CRT)转位至细胞膜表面,作为“eat me”信号,被吞噬细胞表面的CD91 受体识别,并促进树突状细胞(dendritic cell,DC)成熟,刺激DC 吞噬将死的肿瘤细胞[9-10]。蒽环类药物和奥沙利铂诱导的ICD,其CRT 转位由蛋白激酶R 样内质网激酶(proteinkinase R-like ER kinase,PERK)磷酸化介导,随后引起真核细胞起始因子2α(eukaryotic initiation factor 2α,eIF2α)磷酸化,CRT 从ER 转运至高尔基体,最终以可溶性N-乙基马来酰亚胺敏感性因子附着型的蛋白受体(solubleN-ethylmaleimide-sensitive factor attachment protein receptor,SNARE)依赖的方式转位到细胞膜表面[10]。此外,其他胞质伴侣分子,如热 休 克 蛋 白70(heat shock protein 70,HSP70)、HSP90也可外翻至细胞膜表面,作为“eat me”信号[11]。
ICD 前期、早期、中期,将死的肿瘤细胞通过自噬途径分泌三磷酸腺苷(adenosine triphosphate,ATP)到胞外。ATP 作为一种“find me”信号,在细胞外环境中,与抗原递呈细胞(antigen presentation cells,APCs)上的离子型(P2X7)和代谢型(P2Y2)嘌呤受体结合,刺激APCs 成熟和趋化诱导[12-14]。细胞外ATP 可激活半胱天冬酶1(caspase1)依赖的炎症小体NLRP3 复合物促进白细胞介素-1β(interleukin-1β,IL-1β)分泌,进而促进CD8+T 细胞以及γδT 淋巴细胞产生IL-17,诱导抗肿瘤免疫反应[14]。
ICD 晚期,将死的肿瘤细胞释放高迁移率族蛋白1(high mobility group box,HMGB1),HMGB1是一种非组蛋白染色质结合蛋白。细胞凋亡晚期,HMGB1 从细胞核中释放出来与DC 上的Toll 样受体4(Toll-like receptor 4,TLR4)的结合,激活DC并促进DC 向T 细胞呈递抗原。TLR4 结合HMGB1后触发了TLR4/MyD88 信号通路,通过抑制吞噬体和溶酶体之间的融合来增强肿瘤抗原,并加速DC对抗原成分的吞噬[5,15]。
CRT 转位、HMGB1 释放和ATP 分泌被认为是ICD 发生的3 个必要条件[5,12,16]。此外,ER 应激引起的胞内相关信号通路激活,也可作为ICD 的分子标记。临床研究中发现,使用蒽环类药物治疗急性髓系白血病,促使肿瘤细胞需肌醇酶1α(inositolrequiring enzyme-1α,IRE1α)二聚化和磷酸化,产生核酸内切酶活性,剪切X 盒结合蛋白1(X-box binding protein 1,XBP1)形成XBP1 剪切体XBP1s和XBP1u,其中XBP1s 可作为急性髓系白血病患者预后良好的指标[17]。
1.2 干扰素相关分子标记
一些ICD 诱导剂还可以激活TLR3 信号通路,产生I 型干扰素(interferon,IFN),增加死亡细胞免疫原性,通过与肿瘤细胞上的IFN-α/β 受体结合,触发自分泌和旁分泌途径,导致趋化因子配体10(CXCL10)的释放,有助于抗肿瘤免疫应答[18]。
近年来,研究显示干扰素刺激基因(stimulator of interferon genes,STING)信号通路的激活,能够产生有效的抗肿瘤免疫应答。一些ICD 诱导剂能够通过激活STING 信号通路,诱导适应性抗肿瘤免疫。DNA 拓扑异构酶Ⅱ抑制剂替尼泊苷(teniposide)能够诱导肿瘤细胞ICD,并通过激活STING 依赖的固有免疫信号通路,增强抗程序性细胞死亡蛋白-1(programmed death-1,PD-1)免疫治疗的有效性[19]。
2 免疫原性细胞死亡诱导剂的分类及作用机制
目前,ICD 诱导剂分为Ⅰ型ICD 诱导剂和Ⅱ型ICD 诱导剂,目前临床和临床前研究中已报道的Ⅰ型ICD 诱导剂和Ⅱ型ICD 诱导剂如表1 所示。Ⅰ型ICD 诱导剂诱导肿瘤细胞非ER 靶向的凋亡,引起温和的ER 应激以及ICD 相关的免疫原性分子释放;Ⅱ型ICD 诱导剂选择性靶向ER,通过ROS 依赖的ER 应激释放危险信号和凋亡信号[8]。大多数临床抗肿瘤药物,如蒽环类药物、奥沙利铂、硼替佐米、环磷酰胺以及放射治疗(下称放疗),均属于Ⅰ型ICD 诱导剂。金丝桃素光动力疗法、溶瘤病毒疗法等属于Ⅱ型ICD 诱导剂。Ⅰ型和Ⅱ型ICD 诱导剂分别在细胞凋亡的不同阶段发挥作用。在细胞凋亡前期,Ⅱ型ICD 诱导剂相比于Ⅰ型ICD 诱导剂,能够引起更剧烈的ER 应激反应和高水平的ROS,并且释放更多的DAMPs,有助于抗肿瘤免疫应答[7]。但是,这一长期的持续性反应促进自身调节性炎症循环以及肿瘤基质降解,导致肿瘤细胞转移[20]。

表1 Ⅰ型和Ⅱ型肿瘤免疫原性细胞死亡诱导剂及其作用机制Table 1 Inducers of type I and type II Immunogenic cell death and their mechanisms
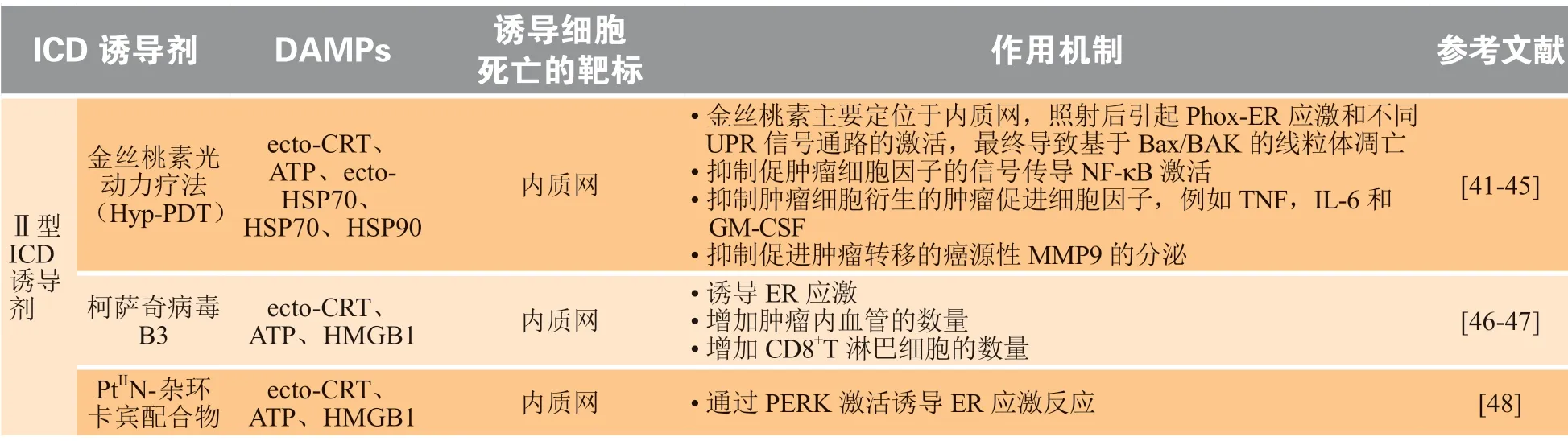
续表1
2.1 化疗药物
化疗药物对免疫系统的影响涉及免疫应答多个环节,其作用广泛、机制复杂。近年来研究显示化疗药物作为ICD 诱导剂的巨大潜力。下文对目前临床用作ICD 诱导剂的几种化疗药物进行介绍。
2.1.1 蒽环类药物蒽环类药物包括蒽二酮(米托蒽醌等)和蒽吡唑(阿霉素、表阿霉素、柔红霉素等)已经用于治疗小儿肉瘤、白血病等。蒽环类药物主要通过嵌入DNA 双链碱基、抑制DNA 拓扑异构酶Ⅱ发挥细胞毒性作用。2005 年,阿霉素作为首个ICD 诱导剂被报道[49],阿霉素诱导的有别于凋亡的细胞死亡表现出ICD 的特征,例如DAMPs 释放,包括凋亡前期CRT 转位、凋亡早期ATP 分泌、凋亡中晚期HSP70 释放以及凋亡晚期HMGB1 释放。
蒽环类药物诱导的ER 应激反应依赖于CRT 转位[10,41]和ATP 释放[50]。垂死的肿瘤细胞释放的ATP 与DC 上的嘌呤受体P2X7 结合,引起细胞内K+外流和炎症小体NALP3 活化,驱动caspase1 介导的IL-1 分泌。蒽环类药物处理的肿瘤细胞,通过自分泌和旁分泌途径产生Ⅰ型IFN,诱导细胞死亡[6]。此外,蒽环类药物诱导产生IL-17 的γδ T 细胞在肿瘤部位积累,先于细胞毒性T 细胞在肿瘤部位的聚集[51]。
有研究显示,阿霉素-脂质体-微泡复合物可增强阿霉素诱导的ICD。该复合物诱导肿瘤细胞凋亡增多,CRT 暴露和DAMPs 释放增加,同时进一步促进DC 成熟[52]。此外,有研究表明,阿霉素与DC 疫苗联合使用可增强抗肿瘤免疫应答。经DC 疫苗和阿霉素处理的小鼠转移瘤内CD8+T 淋巴细胞数量增加,血清IFN-γ 水平升高,肿瘤转移生长受到抑制[53]。
蒽环类药物是一类有效的ICD 诱导剂,但其因为副作用大而受限于临床应用。因此目前需要寻找能够诱导ICD 并且副作用小的治疗方案。
2.1.2 环磷酰胺环磷酰胺是最广泛使用的烷化剂之一,用于治疗血液系统和实体恶性肿瘤。环磷酰胺具有显著的免疫调节活性,最显著的是其抑制Treg的能力,从而消除肿瘤微环境中的免疫抑制[54]。环磷酰胺还可以诱导表现出ICD 的特征,包括细胞表面标记的改变和可溶性DAMPs 的释放[7],导致肿瘤特异性免疫反应的激活。
2.1.3 硼替佐米蛋白酶体抑制剂硼替佐米于2003 年被FDA 批准,并推荐作为多发性骨髓瘤患者的一线治疗药物。将硼替佐米处理的肿瘤细胞与DC 共孵育,负载抗原的DC 可以诱导T 细胞产生IFN-γ,在硼替佐米处理的肿瘤细胞中加入HSP90 抑制剂会减少产生IFN-γ 的T 细胞的数量[55]。硼替佐米作为一种ICD 诱导剂,其作用机制有待进一步研究。
2.1.4 基于铂的化疗药物基于铂的化疗药物,在肿瘤临床治疗中至关重要。奥沙利铂可直接诱导肿瘤细胞发生ICD,而顺铂则需要额外的诱导剂来激活其免疫原性[56]。2 种铂药物均可触发CRT 转位以及HSP70、ATP 和HMGB1 的释放,但奥沙利铂是已被确定的ICD 诱导药物。奥沙利铂通过靶向核DNA来阻止DNA 合成,抑制转录,并且抑制错配修复机制[57]。体外研究显示,将DC 与奥沙利铂共孵育会导致DC 细胞程序性死亡受体配体1(programmed death receptor ligand 1,PD-L1)表达增加,从而抑制T 细胞增殖[58]。这一现象表明将奥沙利铂与抗PD-L1 抗体联合用于癌症治疗,可以启动有效的抗肿瘤免疫应答。
近年来还发现其他基于铂(Pt)的化合物具有ICD 诱导剂的特征,PtⅡN-杂环卡宾配合物显示Ⅱ型ICD 诱导剂的特征,即诱导氧化应激、CRT 暴露以及HMGB1、ATP 释放,被鉴定为首个小分子免疫-化学治疗剂。Pt-NHC 是另一种独特的环金属复合物,它选择性地定位于ER,并通过PERK 诱导ER 应激反应[59]。最近发现新型铂基化合物R,R-1,2-环己二胺焦磷酸铂(Ⅱ)(PT-112)可诱发ICD,临床研究表明,PT-112 与PD-L1 免疫检查点抑制剂具有协同作用[60]。免疫原性或免疫刺激性Pt 候选化合物为基于铂的联合免疫化疗药物的研发提供可能。
2.1.5 天然药物化学成分强心苷(cardiac glycoside,CG)是一类天然衍生化合物大家族,其结构多样,但具有共同的母核结构。CG 是Ⅰ型ICD 诱导剂,在Na+/K+-ATP 酶的α 亚单位有一个主要靶点[61]。特定α 亚基的过表达与肿瘤细胞反应性之间存在相关性[62]。CG 抑制Na+/K+-ATP 酶,增加细胞内Na+和Ca2+水平,同时耗尽细胞内K+,细胞内高水平的Na+阻断了Na+/Ca2+交换器的逆向转运蛋白活性,有利于Ca2+在ER 和线粒体内的积累。这会导致轻微的ER 或线粒体应激反应,影响肿瘤细胞的增殖和活性。有证据表明,CG 参与了SRC 激酶-EGFRMAPK 通路(伴随着线粒体ROS 的产生),导致肿瘤细胞生长停滞[61]。此外,CG 抑制DNA 拓扑异构酶活性和糖酵解途径也证明CG 的促凋亡作用[34]。
紫草素是从中药紫草中分离出来的萘醌类化合物,是蛋白酶体活性的抑制剂。紫草素抑制蛋白酶体的20S 亚单位,导致多泛素化蛋白的积累,紫草素处理的肿瘤细胞通过诱导的线粒体应激触发ICD,诱导HSP70、HSP90 和HMGB1 的释放。紫草素处理的肿瘤细胞裂解物可促进DC 的分化和成熟[27]。紫草素处理的肿瘤细胞可以促进T 细胞向Th17 细胞的分化,这对于ICD 相关的抗肿瘤免疫十分重要;此外,紫草素恢复了自然杀伤细胞(natural killer cell,NK)的杀伤作用,有研究表明用负载紫草素处理的肿瘤细胞的DC 免疫小鼠脾细胞,该脾细胞中细胞毒性T 淋巴细胞(cytotoxic T lymphocyte,CTL)活性提高[63]。
汉黄芩素是黄芩中发现的一种黄酮类化合物。汉黄芩素已被证明通过触发ER 应激反应,导致依赖于PERK/AKT 的CRT 和膜联蛋白A1(annexin A1)暴露在细胞膜上,从而诱导ICD[64]。汉黄芩素通过诱导HMGB1 和ATP 的释放,随后激活DC 并诱导促炎细胞因子的释放,进而产生强大的抗肿瘤免疫效应[64]。
近年来,随着肿瘤免疫治疗在临床应用中取得重大突破,化疗药物与肿瘤免疫治疗的联合疗法也迎来了新的契机。
2.2 放疗
在临床应用中发现,放疗可诱导DNA 损伤和肿瘤细胞凋亡,也可诱导肿瘤细胞原位ICD 并刺激T 细胞介导的抗肿瘤效应。放疗可选择性杀死照射范围内的肿瘤细胞。越来越多的证据表明,放疗可以利用宿主的免疫系统攻击非照射部位的肿瘤细胞。这种免疫驱动作用不仅有助于消除疾病局部照射部位的肿瘤,也可以消除远端转移的肿瘤细胞,这一现象被称为远位效应(abscoapal effects)。放疗触发ICD,导致CRT 易位至细胞表面且释放HMGB1 和ATP 之类的DAMPs,并在体外和体内诱导T 细胞产生IFN-γ,促进CD8+T 细胞抗肿瘤作用[65]。
临床上,放疗以剂量依赖性方式诱导肿瘤细胞ICD,通常2 ~ 20 Gy 能够有效诱导ICD[66]。局部放疗联合免疫检查点抑制剂,例如抗细胞毒T 淋巴细胞相关抗原4(cytotoxic T lymphocyte antigen 4,CTLA4)或抗PD-1,能够利用放疗的促免疫原性作用。此外,放疗联合某些化疗药物也可有效诱导ICD,但是化疗药物可能抵消放疗的免疫原性,因此需要进一步评估这些药物在放疗中的具体作用。
放疗和抗肿瘤免疫的未来研究的目标是利用免疫系统完全消除肿瘤或使肿瘤细胞永久保持休眠[67]。目前研究着重于能激发ICD 的宿主、肿瘤类型与治疗相关的特征,有助于个体化治疗,并以合理的方式指导放疗与化学疗法,以及免疫检查点抑制剂或相关共刺激受体激动剂结合的治疗方案的选择。
2.3 光动力疗法
光动力疗法(photodynamic therapy,PDT)是一种微创治疗方法[68],可引起Ⅱ型ICD 免疫反应。PDT 是肿瘤组织选择性摄取光敏剂,并通过特定波长的光激活,产生氧化应激反应,导致位于光敏剂作用部位的肿瘤细胞被破坏[69]。
目前该领域研究最深入的能诱导ICD 的光敏剂是金丝桃素,是一种蒽醌衍生物,能靶向定位于ER,经照射后引起ER 应激和UPR 信号通路的激活,最终导致细胞死亡[42]。金丝桃素介导的光动力学疗法(hypericin-mediated photodynamic therapy,Hyp-PDT)还可以抑制肿瘤细胞核因子κB(nuclear factor kappa-B,NF-κB)活性。在一定剂量下,Hyp-PDT 可以下调肿瘤细胞衍生的肿瘤促进细胞因子;此外,Hyp-PDT 还能够抑制基质金属蛋白酶9(matrix metalloproteinase 9,MMP-9)的分泌,从而抑制肿瘤转移[43]。
目前已知的诱导ICD 的光敏剂有金丝桃素、5-丙氨酸[70]、孟加拉玫瑰醋酸酯[71]、糖结合氯[72]、酞菁类[73]等,许多光敏剂正被不断的开发和研究,因此基于PDT 的ICD 诱导剂具有广阔的研究前景。
2.4 溶瘤病毒疗法
病毒可以诱导和阻断多种细胞死亡途径。包膜病毒需要膜蛋白和脂质才能产生后代病毒。因此,病毒会诱发ER 应激和UPR。溶瘤病毒(oncolytic virus,OVs)可诱导细胞死亡,类似于化学疗法诱导的ICD。OVs 通过产生病原体相关分子模式(pathogen-associated molecular patterns,PAMPs)和释放肿瘤相关抗原(tumor associated antigens,TAAs)来产生促炎反应,因此可作为一种原位肿瘤疫苗。多种OVs 诱导的细胞死亡表现出ICD 的典型特征,包括CRT 的表面表达增加,细胞外ATP 和HMGB1 的水平升高。每种病毒与宿主UPR 之间的相互作用是复杂的,对此研究尚不完善,因此还需要更深入的研究。
Talimogene laherparepvec(T-VEC) 是 一 种1型单纯疱疹病毒,可表达粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF),目前在美国和欧洲被批准用于治疗黑色素瘤。研究表明,体外感染T-VEC 后,黑色素瘤细胞释放HMGB1、ATP 增加,CRT 的表面表达增加。同时发现,黑色素瘤细胞对T-VEC的敏感性与STING 表达呈负相关。研究表明,溶瘤性HSV-1 可以使STING 低表达的肿瘤消退。因此,T-VEC 有可能通过在STING 缺陷型肿瘤中表达STING 以介导抗肿瘤反应[74]。
此外,柯萨奇病毒B3[46-47]、牛痘病毒[75]均可诱导ICD。柯萨奇病毒B3 是一种RNA 病毒,它在宿主细胞的胞浆中复制,扰乱动态平衡,导致细胞死亡,大量未折叠或错误折叠的病毒被膜蛋白在ER积聚,诱导ER 应激。感染柯萨奇病毒B3 后,非小细胞肺癌(nonsmall cell lung cancer,NSCLC)细胞CRT 转位增加,ATP 和HMGB1 增加。柯萨奇病毒B3 还可以通过增加肿瘤内血管的数量、CD8+T 细胞的数量来增强肿瘤微环境的免疫原性,柯萨奇病毒B3 孵育后的裸鼠肿瘤的分析显示,肿瘤内巨噬细胞、DC、粒细胞和NK 细胞积聚,炎性免疫细胞在肿瘤部位的浸润增多,有助于肿瘤消退[46-47]。
OVs 是新型的免疫疗法,可在实体瘤内复制,并干扰免疫系统。OVs 优先在肿瘤细胞中复制,同时可以通过基因修饰,以灭活干扰病毒蛋白并且引起ER 应激或激活ROS 信号通路,以实现诱导ICD[76]。
2.5 新型ICD 诱导剂
近年来,研究发现了一些新的手段与ICD 诱导剂结合,以引发广泛的抗肿瘤反应,新型ICD 诱导剂如表2 所示。
低温等离子体(non-thermal plasmas,NTP)具有诱导ICD 的潜力,有研究显示,NTP 处理的CT26 结直肠癌细胞,主要组织相容性复合物Ⅰ类分子(major histocompatibility complex Ⅰ,MHC Ⅰ)和CRT 的表面表达增加。NTP 诱导细胞产生的ROS和一氧化氮可以迅速改变细胞的氧化状态,并诱导ER 应激。NTP 作为一种独特的ROS 和一氧化氮递送系统可成功诱导肿瘤细胞ICD,是一种潜在的癌症辅助疗法。NTP 诱导的ICD 的具体机制须深入研究,并进一步优化治疗方案。此外,免疫疗法是当今癌症治疗的重大突破,NTP 或可与化疗甚至治疗性癌症疫苗相结合[85]。纳米颗粒包裹的阿霉素、光敏剂二氢卟酚e6 可以有效刺激DC 细胞募集,有助于DC 更好地暴露和传播TAAs[86]。结合化疗、PDT与免疫疗法,为癌症治疗提供新的思路。
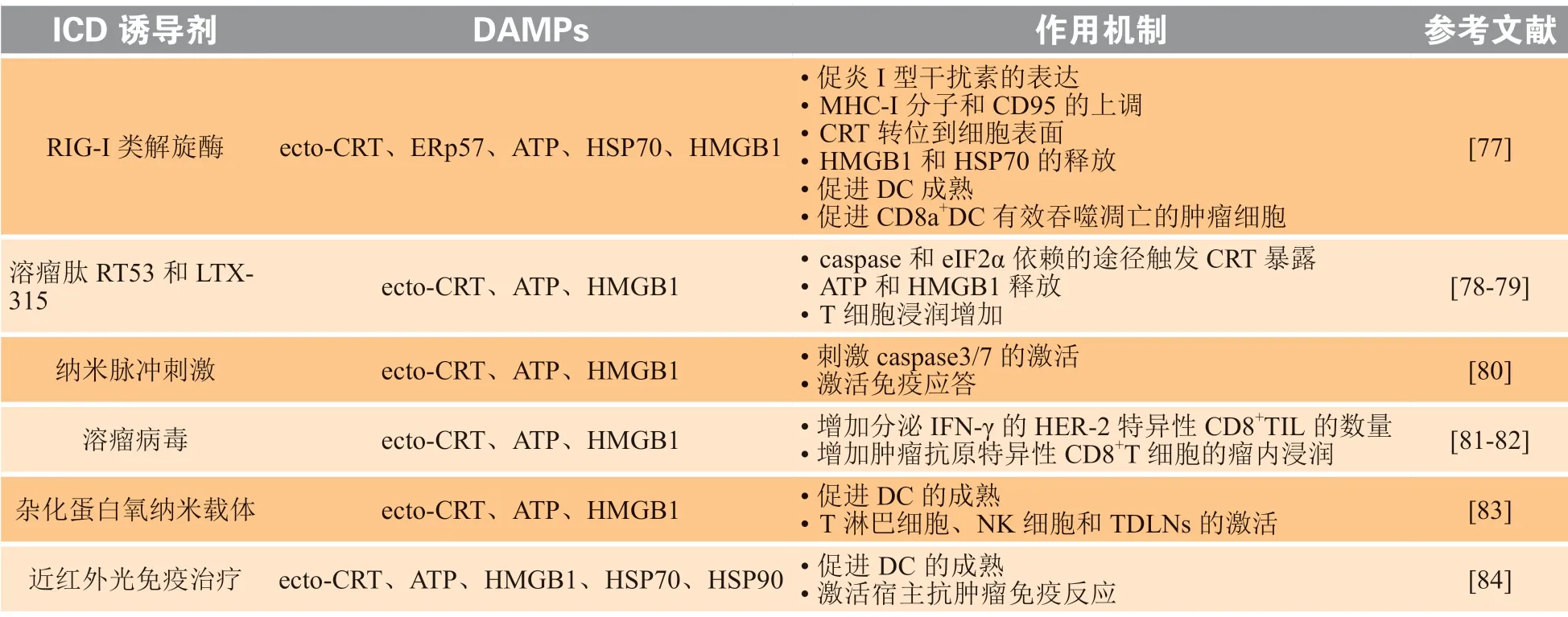
表2 新型肿瘤免疫原性细胞死亡诱导剂及其作用机制Table 2 Novel inducers of tumor immunogenic cell death and their mechanisms
维甲酸诱导基因Ⅰ类(retinoic acid inducible gene Ⅰ,RIG-Ⅰ)解旋酶可通过产生IFN 来诱导抗病毒应答程序,其激活的肿瘤细胞释放高水平的HMGB1,此外,其在肿瘤细胞中的信号传导可导致线粒体氧化应激[77]。
许多新型疗法也通过诱导肿瘤细胞产生ICD,促进抗肿瘤免疫反应。研究显示,LTX-315、RT53 等溶瘤肽可诱导肿瘤细胞产生ICD,释放大量DAMPs,这些DAMPs 类似于肿瘤原位疫苗,促进肿瘤消退以及T 细胞在肿瘤部位的浸润[78-79]。相较于传统放疗,纳米脉冲刺激(NPS)是一种有效的非热物理疗法,该疗法是用超短电脉冲刺激肿瘤细胞,抑制肿瘤生长,其作用机制是诱导肿瘤细胞caspase3/7 激 活,DAMPs( 包 括CRT、ATP 和HMGB1)释放增加[80]。杂化蛋白氧纳米载体疗法是一种氧自足光动力疗法,将光敏剂和氧气共同靶向递送至肿瘤细胞,诱导了肿瘤细胞ICD,并释放了DAMPs,在转移性乳腺癌模型中,杂化蛋白氧纳米载体疗法诱导抗肿瘤免疫,破坏原发性肿瘤并有效抑制远端肿瘤和肺转移瘤[83]。其他物理疗法,如近红外光免疫疗法,也显现出诱导ICD 的潜力[87]。
3 结语
目前,临床和临床前研究显示,传统放疗、化疗和免疫疗法等多种手段在临床应用中均可作为诱导ICD 的治疗方法,同时诱导ICD 的药物处理的肿瘤细胞可作为疫苗在体内诱发保护性的抗肿瘤免疫反应。判断一种分子/药物诱导肿瘤细胞ICD 的金标准是体内疫苗接种实验(vaccination assay),即在没有佐剂的情况下,ICD 诱导剂处理的肿瘤细胞注射到免疫完全小鼠体内,能够引起小鼠抗原适应性免疫应答,并能够保护小鼠免受同类型肿瘤的攻击[2]。此过程的关键是杀伤的肿瘤细胞能够引起机体产生抗原特异性抗肿瘤免疫反应。肿瘤细胞产生的DAMPs,如钙网蛋白、HSP70、HSP90、HMGB1、ATP 等能够促进DC 细胞激活及与T 细胞之间抗原呈递,从而激活适应性免疫应答。但是并不是所有的DAMPs 产生都能够引起适应性免疫应答。CRT 外翻、HMGB1 和ATP 的释放等,可以作为体外初步筛选ICD 诱导剂的标志。
当肿瘤细胞发出的ICD 信号被抑制,免疫系统对这些信号的感知受到阻碍,或CD8+T 细胞等免疫效应因子耗竭时,ICD 诱导剂产生的抗肿瘤疗效会失效。目前ICD 诱导剂的临床应用趋势,倾向于将其与免疫疗法或靶向药物联合用于抗肿瘤治疗[7]。Gao 等[87]发现,联合使用阿霉素和小分子吲哚胺2,3-双加 氧 酶1(indoleamine 2,3-dioxygenase 1,IDO1)抑制剂(NLG919)能显著抑制4T1 小鼠乳腺肿瘤细胞的体内生长。Fend 等[88]研究显示,工程化溶瘤牛痘病毒VVWR-TK-RR-Fcu1 通过I 型IFN 信号通路,可增加CD8+T 细胞在肿瘤部位的浸润,并改善肿瘤微环境中CD4+T 细胞与Treg 细胞的比例,这一工程化溶瘤牛痘病毒与免疫检查点抑制剂(ICB)或其他ICD 诱导剂联合使用,可以增强其抗肿瘤效果。ICD 诱导剂可以启动强大的抗肿瘤免疫,与免疫疗法联合使用可以增强这种免疫反应,因此将传统的化疗、放疗等ICD 诱导手段联合免疫疗法以及新型的递送手段用于癌症治疗,联合疗法为ICD 诱导剂的临床应用提供了无限的可能。

