腹腔镜直肠癌根治术治疗直肠癌的效果及对血清疼痛因子、miR-103、miR-21与肛肠动力学指标的影响*
李颖,连彦军,宋志岗,宋炳辉,李静
(河北省邢台市第三医院1.胃肠外科;2.腺体外科,河北 邢台054000)
直肠癌是由直肠组织细胞基因异常变化引起的恶性肿瘤,临床主要采用手术作为早中期患者的治疗方案。传统的开腹手术视野清晰,操作方便,但术后疼痛明显,影响患者术后恢复[1-3]。近年来,随着快速康复理念的普及和腹腔镜设备的更新,腹腔镜手术已成为微创外科发展的主流趋势,其具有入路清晰、视觉放大的优势,且对腹腔其他脏器损伤小,但切除直肠癌病灶对患者肛肠动力学有一定的影响[4]。此外,miR-103 和miR-21 等miRNA 在肿瘤的发生发展过程中具体重要调控作用,与肿瘤的发生及预后关系密切,可用于客观评估患者预后情况[5-7]。为进一步明确微创手术的预后效果,本研究选取本院直肠癌患者93例进行前瞻性随机对照研究,旨在从肛肠动力学、血清miR-103 和miR-21 等方面分析腹腔镜直肠癌根治术的应用价值。现报道如下:
1 资料与方法
1.1 一般资料
选取2017年9月-2019年12月本院直肠癌患者93 例进行前瞻性随机对照研究,简单随机化法分为观察组(n=46)和对照组(n=47)。两组患者性别、年龄、肿瘤直径、病程、病理类型、肿瘤位置和Dukes 分期比较,差异均无统计学意义(P>0.05),具有可比性。见表1。本研究经医院伦理委员会审批通过(No:2019-KY-33)。
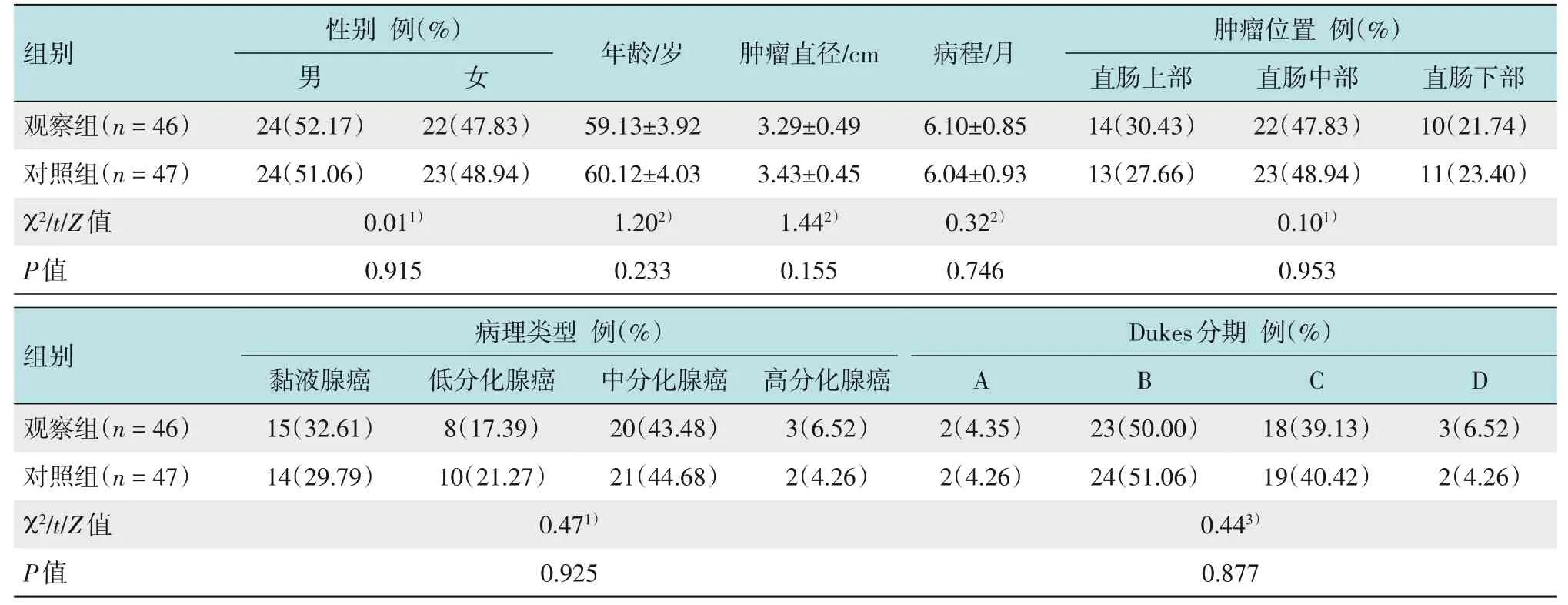
表1 两组患者一般资料比较Table 1 Comparison of general data between the two groups
1.2 病例选则标准
1.2.1 纳入标准①均符合直肠癌诊断标准[8];②经肠镜活检、内镜病理活检确诊;③肿瘤直径≤5.0 cm;④身体素质良好,可耐受手术;⑤患者或家属知情本研究并签署同意书。
1.2.2 排除标准①凝血功能异常者;②腹腔镜手术禁忌者;③术前行放化疗或内分泌治疗者;④合并溃疡性结肠癌、克罗恩病者;⑤术前合并肠梗阻、肠道穿孔或出血者;⑥肿瘤转移或扩散;⑦合并其他恶性肿瘤者;⑧术前存在明显感染者;⑨有腹部手术史者;⑩心、肝、肾重要脏器功能严重不全者。
1.3 手术方法
1.3.1 观察组采取腹腔镜直肠癌根治术。常规消毒铺巾,气管插管全麻。取改良截石位,于脐环上缘行2.0~3.0 cm 切口,建立压力为12~15 mmHg 的气腹,置入腹腔镜,于腹直肌外侧左右麦氏点做切口,置入超声刀、分离钳。按照全直肠系膜切除(total mesorectal excision,TEM)原则,采用超声刀切开结肠左侧腹膜,自根部离断解剖后肠系膜下动脉和静脉,锐性分离脏层、壁层直肠系膜。若肿瘤距肛门≤8.0 cm,于肿瘤远端3.0 cm 处划定预切缘;若肿瘤距肛门>8.0 cm,于肿瘤远端5.0 cm 处划定预切缘。助手以500 mL 无菌蒸馏水清洁远处肠腔,在预切缘位置切断肠腔,于乙状结肠区离断肠管后将肿瘤取出,清扫瘤体周围淋巴结,腹腔镜下经肛门置入吻合器,行低位或超低位结肠-原肛管吻合或结肠-直肠吻合,放置引流管,于右麦氏点引出。
1.3.2 对照组采取传统开腹手术。麻醉方式同观察组,取截石位。依据TEM 原则清扫直肠系膜静脉血管根部淋巴结,结扎血管根部,切除全直肠系膜;肿瘤远端3.0~5.0 cm 处采用棉线结扎,剔除肛门及近端肠管造瘘,采用碘伏经肛门冲洗肠腔,置入吻合器,行结肠-原肛管吻合。
1.4 检测方法
于早晨取空腹静脉血8 mL,室温凝固、离心(转速:3 500 r/min,离心半径:8.0 cm,离心时间:10 min),分离取上层血清,均分为两份,置于-80℃恒温箱待测。一份用美国贝克曼库尔特公司提供的全自动生化分析仪(AU5811)通过酶联免疫法检测神经肽Y (neuropeptide Y,NPY)、前列腺素E2(prostaglandin E2,PGE2)、神经生长因子(never growth factor,NGF),试剂盒购自上海康泰生物技术有限公司;另一份用QIAamp Viral RNA Mini Kit 试剂盒行实时荧光定量PCR检测,以检测血清中miR-103和miR-21 水平。所有操作均由检验科同一高年资医师按试剂盒说明书严格完成。
1.5 观察指标
①两组患者手术情况,包括:手术时间、淋巴结清扫数目、术中出血量、肛门排气时间、进食时间和住院时间;②两组患者并发症情况,包括:粘连性肠梗阻、吻合口瘘、切口感染和尿潴留;③两组患者术前、术后1 d和术后3 d血清NPY、PGE2和NGF水平;④两组患者术前、术后1 周和术后2 周血清miR-103和miR-21水平;⑤两组患者术前、术后4周和术后8周肛肠动力学指标,包括:肛管最长收缩时间(anal longest contraction,ALCT)、肛管最大收缩压(anal maximum contraction pressure,AMCP)、直肠静息压(rectal rest pressure,RRP)水平,采用合肥凯利光电科技有限公司提供的ZGJ-D3 型肛肠压力检测仪进行检测。
1.6 统计学方法
采用SPSS 22.0 软件统计分析数据,计数资料以例(%)表示,行χ2检验;等级资料行秩和检验;符合正态分布的计量资料以均数±标准差(-±s)表示,行t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者手术情况比较
两组患者手术时间和淋巴结清扫数目比较,差异均无统计学意义(P>0.05);观察组术中出血量少于对照组,肛门排气时间、进食时间和住院时间较对照组短,两组比较,差异均有统计学意义(P<0.05)。见表2。
表2 两组患者手术情况比较 (±s)Table 2 Comparison of surgery status between the two groups (±s)
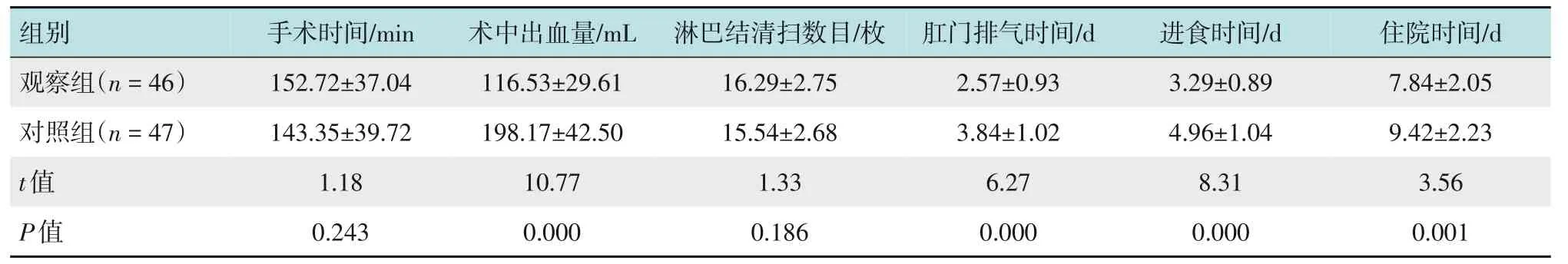
表2 两组患者手术情况比较 (±s)Table 2 Comparison of surgery status between the two groups (±s)
组别观察组(n=46)手术时间/min 152.72±37.04术中出血量/mL 116.53±29.61淋巴结清扫数目/枚16.29±2.75肛门排气时间/d 2.57±0.93进食时间/d 3.29±0.89住院时间/d 7.84±2.05对照组(n=47)t值P值143.35±39.72 1.18 0.243 198.17±42.50 10.77 0.000 15.54±2.68 1.33 0.186 3.84±1.02 6.27 0.000 4.96±1.04 8.31 0.000 9.42±2.23 3.56 0.001
2.2 两组患者并发症发生率比较
观察组术后并发症发生率(4.35%)低于对照组(19.15%),两组比较,差异有统计学意义(P<0.05)。见表3。

表3 两组患者并发症发生率比较 例(%)Table 3 Comparison of incidence of complications between the two groups n(%)
2.3 两组患者血清疼痛因子水平比较
两组患者术前血清NPY、PGE2和NGF水平比较,差异均无统计学意义(P>0.05);两组患者术后1 和3 d血清NPY、PGE2和NGF水平均较术前高,但观察组低于对照组,差异有统计学意义(P<0.05)。见表4。
表4 两组患者血清疼痛因子水平比较 (±s)Table 4 Comparison of serum pain factor levels between the two groups (±s)
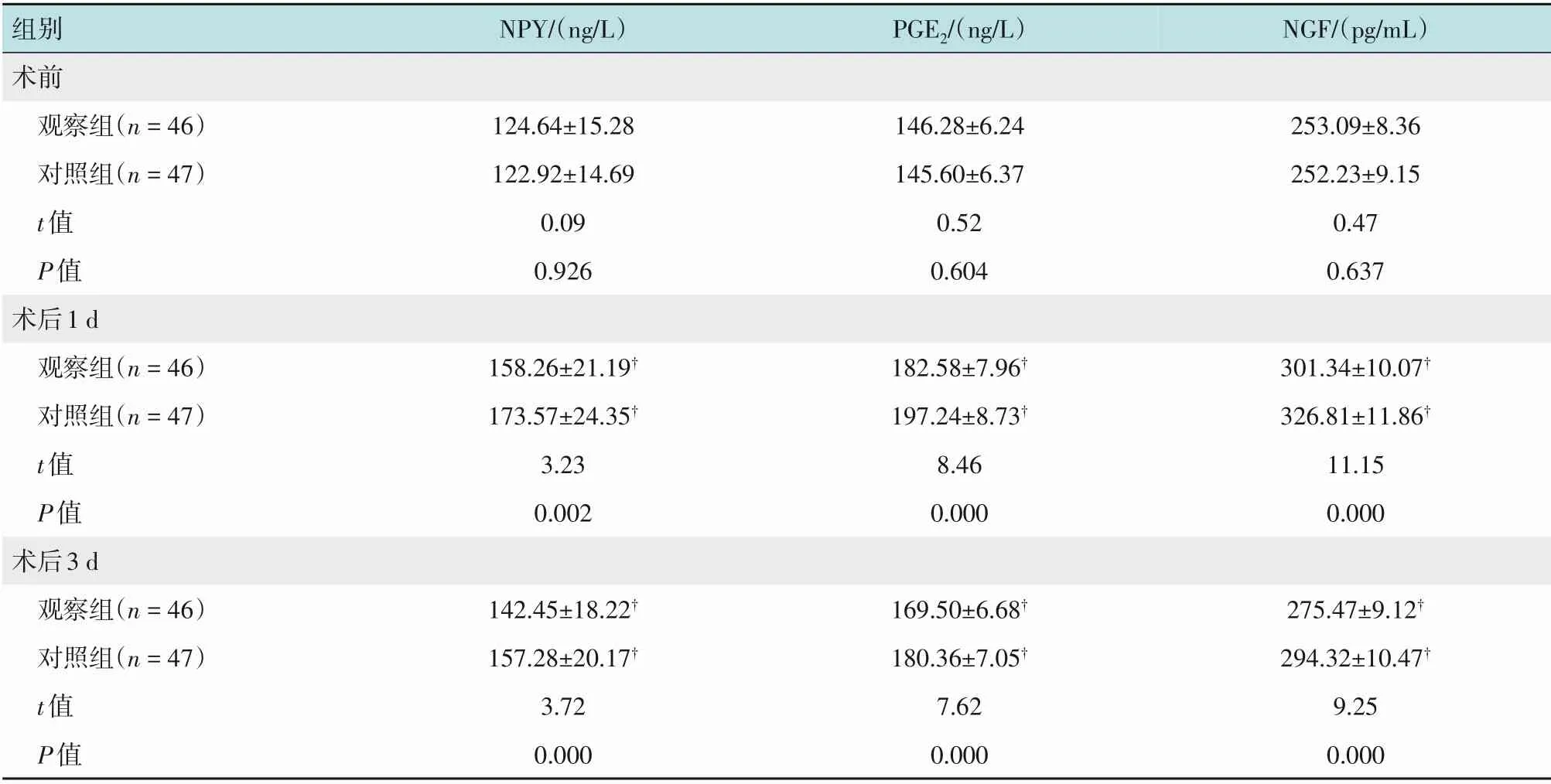
表4 两组患者血清疼痛因子水平比较 (±s)Table 4 Comparison of serum pain factor levels between the two groups (±s)
注:†与术前比较,差异有统计学意义(P <0.05)
组别术前观察组(n=46)对照组(n=47)t值P值术后1 d观察组(n=46)对照组(n=47)t值P值术后3 d观察组(n=46)对照组(n=47)t值P值NPY/(ng/L)PGE2/(ng/L)NGF/(pg/mL)124.64±15.28 122.92±14.69 0.09 0.926 146.28±6.24 145.60±6.37 0.52 0.604 253.09±8.36 252.23±9.15 0.47 0.637 158.26±21.19†173.57±24.35†3.23 0.002 182.58±7.96†197.24±8.73†8.46 0.000 301.34±10.07†326.81±11.86†11.15 0.000 275.47±9.12†294.32±10.47†9.25 0.000 142.45±18.22†157.28±20.17†3.72 0.000 169.50±6.68†180.36±7.05†7.62 0.000
2.4 两组患者血清miR-103和miR-21水平比较
两组患者术前血清miR-103和miR-21水平比较,差异均无统计学意义(P>0.05);两组患者术后1 和2周血清miR-103和miR-21均较术前降低,且观察组低于对照组,差异有统计学意义(P<0.05)。见表5。
表5 两组患者血清miR-103和miR-21水平比较 (±s)Table 5 Comparison of serum miR-103 and miR-21 levels between the two groups (±s)
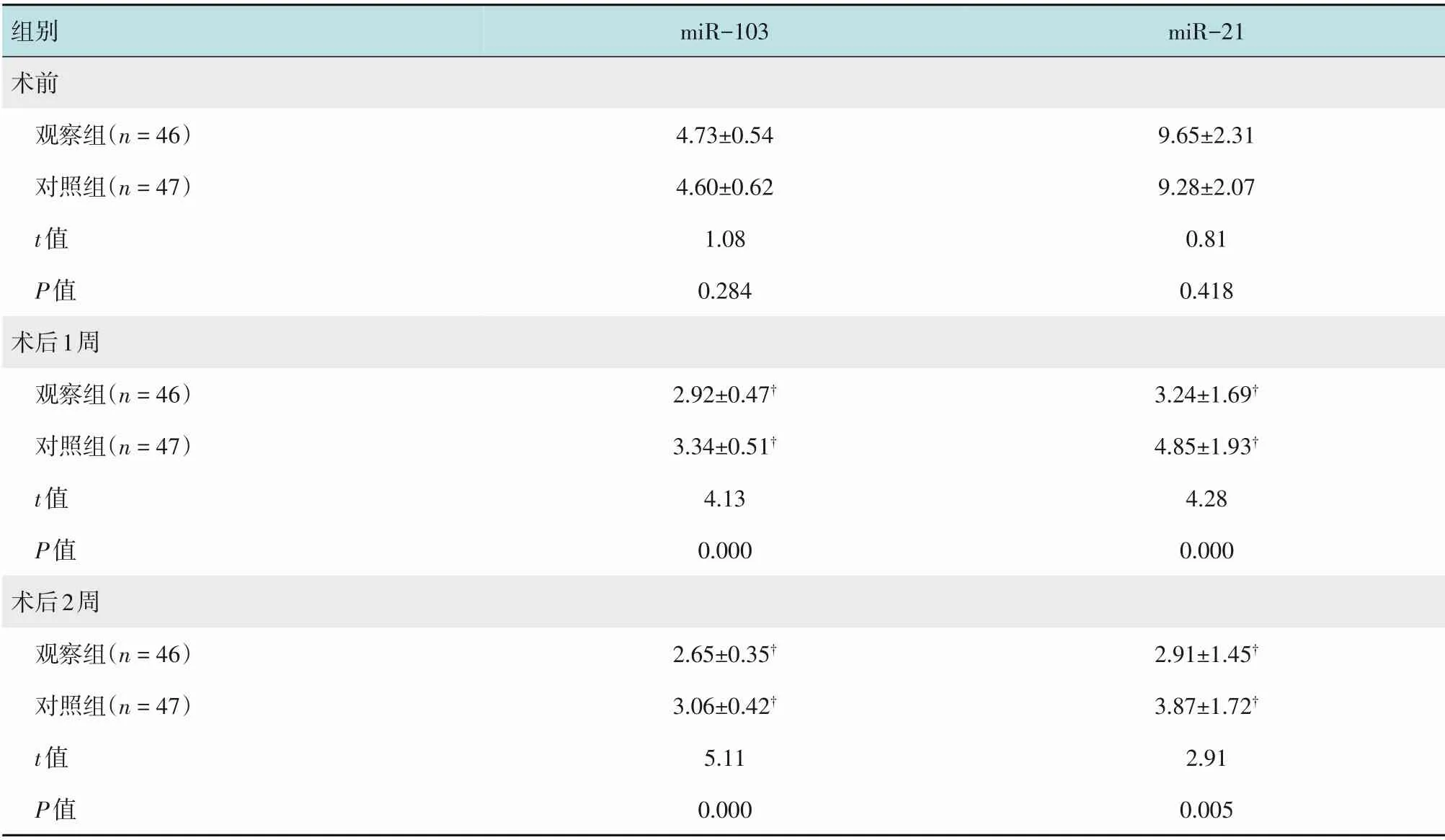
表5 两组患者血清miR-103和miR-21水平比较 (±s)Table 5 Comparison of serum miR-103 and miR-21 levels between the two groups (±s)
注:†与术前比较,差异有统计学意义(P <0.05)
组别术前观察组(n=46)对照组(n=47)t值P值术后1周观察组(n=46)对照组(n=47)t值P值术后2周观察组(n=46)对照组(n=47)t值P值miR-103 miR-21 4.73±0.54 4.60±0.62 1.08 0.284 9.65±2.31 9.28±2.07 0.81 0.418 2.92±0.47†3.34±0.51†4.13 0.000 3.24±1.69†4.85±1.93†4.28 0.000 2.91±1.45†3.87±1.72†2.91 0.005 2.65±0.35†3.06±0.42†5.11 0.000
2.5 两组患者肛肠动力学指标比较
两组患者术前ALCT、AMCP 和RRP 水平比较,差异均无统计学意义(P>0.05);两组患者术后4和8周ALCT、AMCP和RRP水平均较术前降低,但观察组高于对照组,差异有统计学意义(P<0.05)。见表6。
表6 两组患者肛肠动力学指标比较 (±s)Table 6 Comparison of anorectal dynamics indexes between the two groups (±s)
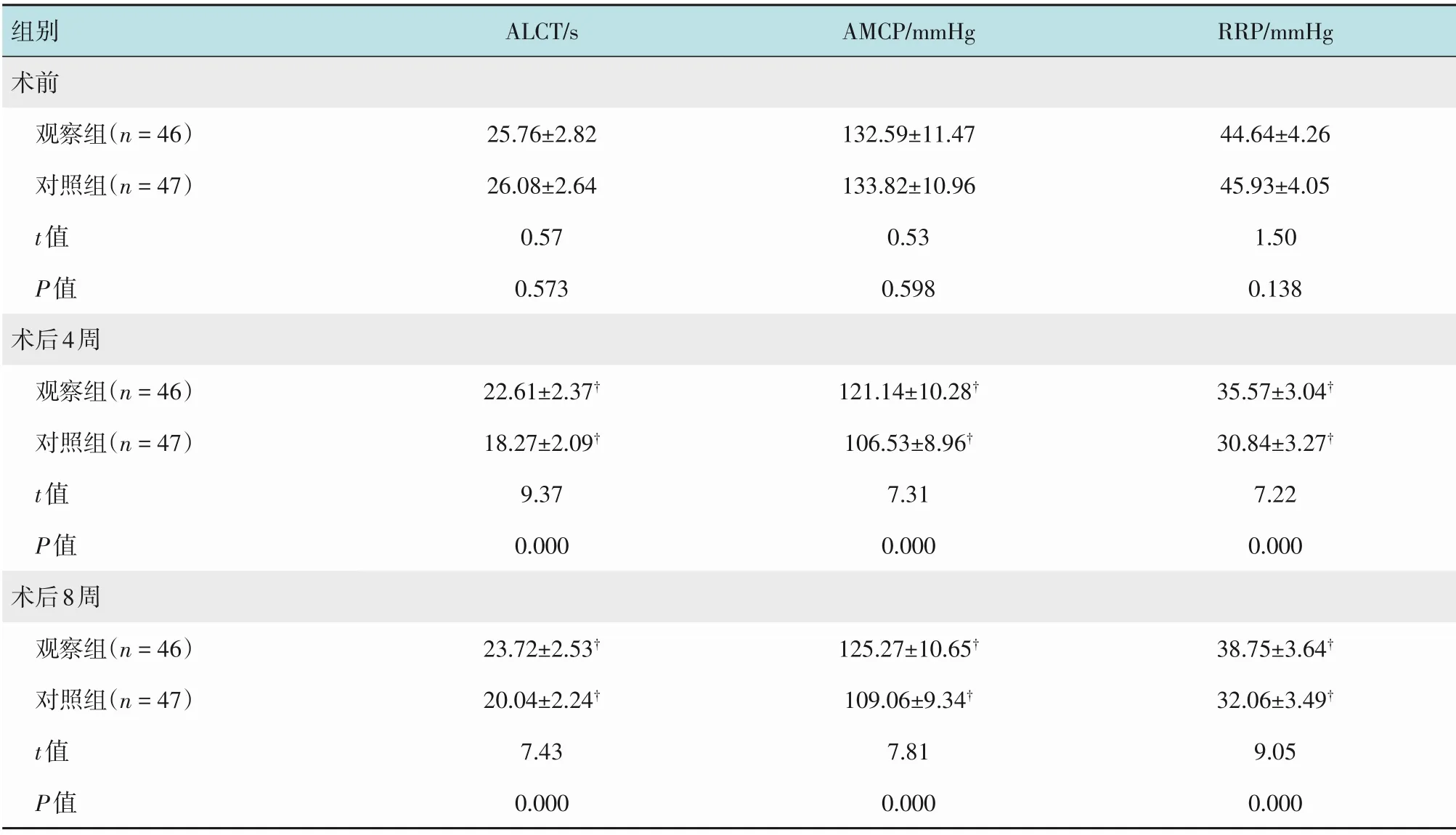
表6 两组患者肛肠动力学指标比较 (±s)Table 6 Comparison of anorectal dynamics indexes between the two groups (±s)
注:†与术前比较,差异有统计学意义(P <0.05)
组别术前观察组(n=46)对照组(n=47)t值P值术后4周观察组(n=46)对照组(n=47)t值P值术后8周观察组(n=46)对照组(n=47)t值P值ALCT/s AMCP/mmHg RRP/mmHg 25.76±2.82 26.08±2.64 0.57 0.573 132.59±11.47 133.82±10.96 0.53 0.598 44.64±4.26 45.93±4.05 1.50 0.138 22.61±2.37†18.27±2.09†9.37 0.000 121.14±10.28†106.53±8.96†7.31 0.000 35.57±3.04†30.84±3.27†7.22 0.000 38.75±3.64†32.06±3.49†9.05 0.000 23.72±2.53†20.04±2.24†7.43 0.000 125.27±10.65†109.06±9.34†7.81 0.000
3 讨论
直肠癌早期发病比较隐匿,且缺乏典型病理表现,多数患者就诊时已发展为进展期。若不能及时有效的控制,癌变细胞易扩散至全身各组织器官,使机体功能严重受损[9]。传统开腹手术为既往治疗直肠癌的金标准,能有效切除肿瘤、癌周围组织和直肠系膜,抑制病情进展,效果确切,但创伤较大,预后恢复效果欠佳。
腹腔镜直肠癌根治术为近年治疗直肠癌的主要微创术式,与传统开腹手术相比,具有微创、术后恢复快和安全性高等优势。为进一步明确腹腔镜直肠癌根治术的有效性及安全性,本研究对两种术式进行对比,结果显示,观察组术中出血量少于对照组,肛门排气时间、进食时间和住院时间短于对照组,术后并发症发生率(4.35%)低于对照组(19.15%),与徐平等[10]研究结果相似。笔者分析原因为:①腹腔镜手术切口更小,能有效减少对腹腔脏器的干扰,有利于术后胃肠功能恢复,且对降低切口感染风险有积极作用;②腹腔镜的视觉放大效应使手术视野更宽广、更清晰,术中几乎不存在视野盲区,可更为精细地选取Toldt's间隙和手术入路,医师能清晰辨认盆腔自主神经、血管和输尿管等,有效减少术中副损伤,降低并发症发生风险,促进患者术后恢复;③术中采用超声刀止血,效果确切,腹腔镜下精细操作使结肠-直肠吻合更为细致紧密,可预防吻合口出血,有利于降低术中出血量。直肠癌术后患者结肠、直肠及肛管的各种运动方式都会发生明显改变。本研究显示,两组患者术后4和8周ALCT、AMCP和RRP水平均较术前降低,但观察组高于对照组,表明:腹腔镜直肠癌根治术对患者肛肠动力学的影响更轻微,有助于患者胃肠功能恢复,这主要与腹腔镜手术无需开腹损伤肠道、可减少对肠黏膜组织结构的破坏有关。但当肿瘤直径>5.0 cm时,可能会造成肿瘤挤压、破裂,增加切口种植风险,故术前应准确评估肿瘤大小、手术适应证等,术中如遇肿瘤破裂则应及时中转开腹手术,以确保患者安全[11]。
术中麻醉和建立气腹等操作会引起机体应激,加上肿瘤本身及手术创伤的影响,使相关疼痛因子过度表达。本研究中,两组患者术后1和3 d的血清NPY、PGE2和NGF 水平较术前提高,但观察组低于对照组(P<0.05)。NPY是神经调节因子,对手术创伤和感染导致的疼痛非常敏感[12];PGE2与肌肉收缩有关,可增强肌肉痛觉敏感性[13];NGF对神经元的功能、发育及分化均具有积极作用,在机体受到不良刺激时,可调控机体痛觉过敏作用[14]。上述结果表明,腹腔镜直肠癌根治术可通过降低疼痛因子表达来减轻患者疼痛程度,这主要与该术式操作精细有关,腹腔镜术中对脏器牵拉较少,可减少对病灶周围组织的损伤,能有效缓解术后应激反应,减轻患者术后疼痛感。
直肠癌不断增殖、局部浸润为其最根本的恶性生物学行为,常导致术后复发和转移,该恶性生物学行为由多种miRNA 调控和肿瘤本身合成的多种生长因子介导[15-16]。miR-21 为致癌小分子非编码RNA,能调控基因蛋白的表达,其表达水平与肿瘤细胞增殖、分化、侵袭与转移相关[17]。miR-103在患者结直肠组织中异常高表达,特异性抑制肿瘤转移抑制基因DAPK 和KLF4 的表达,能促进癌细胞与胞外基质黏附和侵袭的能力,降低细胞间黏附和上皮标志因子的表达[18]。本研究中,两组患者术后1 和2 周血清miR-103 和miR-21 水平均较术前降低,且观察组低于对照组(P<0.05),表明:腹腔镜直肠癌根治术能有效切除病变组织,且应激反应较轻,术中使用超声刀还有利于预防血液、淋巴液内肿瘤细胞播散,有效抑制患者血清miR-103 和miR-21 的表达,但能否降低患者术后复发率仍需延长随访时间进一步深入探究。
综上所述,腹腔镜直肠癌根治术应用于直肠癌治疗,能有效减少术中出血量,缩短患者术后恢复时间,抑制疼痛因子表达,调节血清miR-103 和miR-21水平,促进患者肛肠动力学恢复。

