胃早癌患者内镜黏膜下剥离术前后血清实验室相关指标水平及其意义*
杨兰勤,庞路人,叶慧,张铭光
[1.四川大学华西医院 消化内科,四川 成都610000;2.成都市双流区第一人民医院
(四川大学华西空港医院) 急诊科,四川 成都610000]
胃早癌(early gastric cancer,EGC)指无论是否伴有淋巴结转移,肿瘤细胞都仅局限于胃黏膜或黏膜下层的胃癌。EGC通过手术切除和常规淋巴结清扫即可获得良好的治疗效果,治愈率高达95.00%,但早期检出率仅为20.00%[1-2]。近年来,内镜技术在胃癌诊断和治疗中的应用范围逐渐扩大。内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)由内镜下黏膜切除术(endoscopic mucosal resection,EMR)发展而来,利用电刀等分离工具将位于黏膜层的病灶与基层进行分离并完整切除。将ESD 用于EGC 手术可达到肿瘤根治的效果,有效减少术后肿瘤残留和复发,同时ESD还具有创伤小、经济实用和术后恢复快等优势[3]。有文献[4-5]报道,血清胃蛋白酶原(pepsinogen,PG)、胃泌素-17(gastrin 17,G-17)和幽门螺杆菌抗体(Helicobacter pylori IgG antibody,Hp-IgG)均为胃癌早期筛查的常用实验室指标,在EGC 鉴别诊断中具有重要参考价值。本文主要研究EGC 患者ESD 手术前后血清PGⅠ、PGⅡ、G-17 和Hp-IgG的表达水平及其意义。现报道如下:
1 资料与方法
1.1 一般资料
选取2013年2月-2015年2月在本院行ESD治疗的326 例EGC 患者作为研究对象。其中,男179 例,女147例,年龄35~82岁,平均(51.43±10.64)岁,病灶位置分别为胃窦部158 例、胃体部103 例和胃贲门部65例,病灶最大径为0.6~5.4 cm,平均(1.92±0.61)cm,浸润层次为M1 层298 例、M2 层20 例和M3 层8 例。另选取本院同期健康体检者80 例进行对照。其中,男41例,女39例,年龄30~80岁,平均(50.86±10.29)岁。两组患者年龄和性别比较,差异均无统计学意义(P>0.05),具有可比性。见表1。

表1 两组患者一般资料比较Table 1 Comparison of general data between the two groups
1.1.1 纳入标准①病理组织活检证实为EGC;②年龄≥18岁;③病灶局限于胃黏膜层且未见淋巴结或远处转移;④患者基础健康状况良好且能配合完成相关研究;⑤患者及家属均完全了解ESD治疗和本研究内容,并签署知情同意书。
1.1.2 排除标准①合并其他部位恶性肿瘤者;②伴严重感染或凝血障碍者;③伴精神疾病或认知障碍者;④合并心、肺或肾等重要器官功能不全者。
1.2 研究方法
分别采集患者入院1 d 和ESD 术后3 个月的空腹外周静脉血3 mL于EDTA-K2抗凝管中,以4 000 r/min离心10 min 后取上清,于-80℃保存备用。采用ELISA法分别检测血清PGⅠ、PGⅡ和G-17水平,并计算胃蛋白酶原比值(pepsinogen ratio,PGR)(PGR=PGⅠ/PGⅡ),所用仪器为罗氏Modular P800全自动生化仪,试剂盒均购自武汉明德生物科技股份有限公司;采用胶体金法(试剂盒由上海朗顿生物科技有限公司生产)检测血清Hp-IgG 表达水平。健康对照组人群统一在体检时采集空腹外周静脉血3 mL,并检测血清PGⅠ、PGⅡ、G-17 和Hp-IgG。以上操作均严格按照说明书要求完成。
所有EGC患者术后随访5年,每年复查1次胃镜以检查肿瘤复发情况,诊断标准为胃镜病理活检发现癌细胞或高级别不典型增生。根据随访结果将患者分为复发组(n=21)和对照组(n=305),比较两组的血清PGⅠ、PGⅡ、G-17 和Hp-IgG 水平,同时分析各指标对肿瘤复发的影响及预测价值。
1.3 统计学方法
选用SPSS 22.0 软件进行统计分析,计数资料以例(%)表示,组间比较采用χ2检验,符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验,手术前后比较采用配对样本t检验,采用二元Logistic 回归分析PGⅠ、PGⅡ、G-17 和Hp-IgG 水平对EGC 患者ESD 术后复发的影响,通过受试者工作特征曲线(receiver operating characteristic curve,ROC)来分析上述指标对肿瘤复发的诊断价值。P<0.05为差异有统计学意义。
2 结果
2.1 EGC 患者与健康人群血清PGⅠ、PGⅡ、G-17和Hp-IgG水平比较
EGC患者PGⅠ和PGR水平低于健康人群,G-17水平和Hp-IgG 阳性率高于健康人群,两组比较,差异均有统计学意义(P<0.05)。见表2。
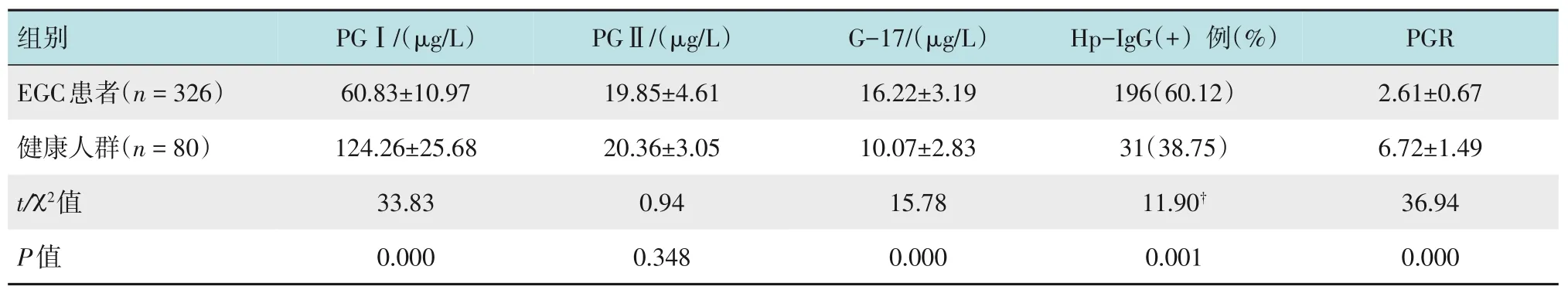
表2 EGC患者与健康人群血清PGⅠ、PGⅡ、G-17和Hp-IgG水平比较Table 2 Comparison of serum PGⅠ,PGⅡ,G-17 and Hp-IgG levels between EGC patients and healthy people
2.2 复发组与对照组患者手术前后血清PGⅠ、PGⅡ、G-17和Hp-IgG水平比较
复发组与对照组患者术后3 个月血清PGⅠ和PGR 水平明显升高(P<0.05),G-17 水平明显降低(P<0.05)。复发组手术前后Hp-IgG 阳性率高于对照组,术后血清PGⅠ和PGR 水平低于对照组,血清G-17 水平高于对照组,两组比较,差异均有统计学意义(P<0.05)。见表3。
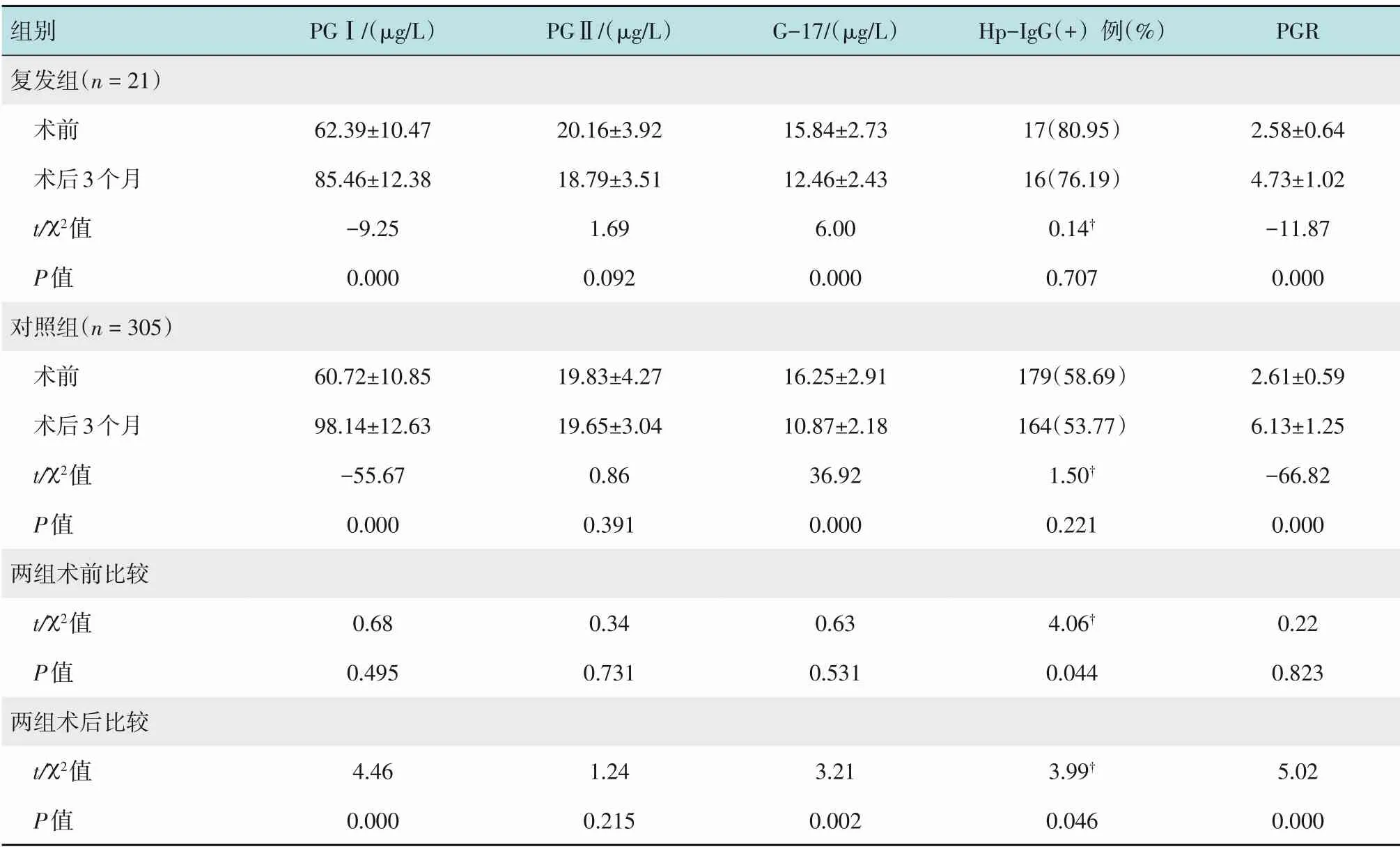
表3 复发组与对照组手术前后血清PGⅠ、PGⅡ、G-17和Hp-IgG水平比较Table 3 Comparison of serum PGⅠ,PGⅡ,G-17 and Hp-IgG levels between recurrence group and control group before and after surgery
2.3 影响EGC患者术后复发的多因素分析
二元Logistic 回归分析(术后复发=1,未复发=0)显示,PGⅠ、Hp-IgG 和PGR 为影响EGC 患者术后复发的重要因素(P<0.05)。见表4。
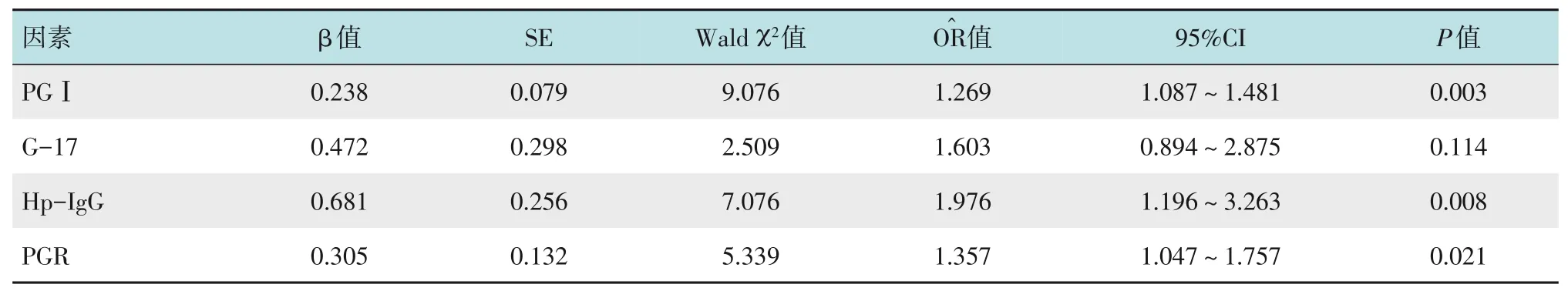
表4 影响EGC患者术后复发的Logistic回归分析Table 4 Logistic regression analysis of the factors influencing the postoperative recurrence of patients with EGC
2.4 PGⅠ、Hp-IgG 和G-17 对EGC 患者术后复发的预测价值
PGⅠ、Hp-IgG和PGR预测EGC患者术后复发的ROC 曲线下面积(area under curve,AUC)分别为0.772、0.612 和0.835,3 项指标诊断价值比较,差异无统计学意义(P>0.05)。见表5和附图。

表5 PGⅠ、Hp-IgG和G-17对EGC患者术后复发的预测价值Table 5 Predictive value of PGⅠ,Hp-IgG and G-17 on postoperative recurrence in patients with EGC

附图 PGⅠ、Hp-IgG和G-17预测EGC患者术后复发的ROC曲线Attached fig.ROC curves of PGⅠ,Hp-IgG and G-17 in predicting postoperative recurrence of patients with EGC
3 讨论
胃癌是全球常见的消化道恶性肿瘤之一。2018年全球发病率和死亡率在男性中分别为第4 位和第3位,在女性中则均为第5位。我国肿瘤登记中心数据显示:国内2015年新增和死亡患者数量分别为67.9万和49.8万,死亡率仅次于肺癌,居第2位,在严重威胁患者身心健康的同时,给患者家庭和社会带来巨大的负担[6-8]。胃癌早期诊断和干预对改善预后具有重要意义,随着内镜技术的发展,EGC及癌前病变的检查和治疗水平均获得明显提升,其中ESD已在临床获得广泛应用。
血清胃功能检查是评估胃黏膜状态和诊断胃部疾病常用的方法,其安全无创、简便易行,且可重复性良好,其中又以PGⅠ、PGⅡ和G-17 的应用最为广泛[9]。PGⅠ和PGⅡ是PG的两种亚型,前者主要由胃底腺分泌,而胃底腺、胃窦幽门腺和十二指肠Brunner腺均可参与PGⅡ的合成。因此,当胃黏膜因病变发生萎缩时,血清PGⅠ水平明显降低,PGⅡ水平则保持稳定或升高,从而导致PGR 明显减少[10]。G-17 主要由胃窦G 细胞产生,是促进胃酸分泌的重要激素,胃窦部病变可导致G 细胞数量和G-17 表达降低,而胃体部病变则可引起G-17 水平反馈性升高[11]。涂宏飞等[12]研究认为,胃底腺息肉和胃癌患者血清PGⅡ、PGR和G-17水平存在明显变化,对胃癌早期筛查具有重要参考意义。李世杰等[13]研究表明,血清PGⅠ、G-17 及PGR 与胃癌发生发展关系密切。因此,监测PG、G-17及PGR的变化,可用于胃癌筛查和病情动态评估。幽门螺杆菌(helicobacter pylori,Hp)感染是引发胃癌的重要危险因素,检测Hp-IgG阳性率有利于判断胃黏膜炎症状态,并预测胃癌发病风险,与PG 联合应用可明显提升预测准确率[5]。本研究显示,EGC患者血清G-17水平和Hp-IgG阳性率均明显高于健康人群,PGⅠ和PGR 均明显低于健康人群,表明EGC 患者PGⅠ、G-17 和Hp-IgG 表达存在明显异常,且部分患者术后未完全恢复正常。因此,利用EGC 患者手术前后PG、G-17 和Hp-IgG 变化可为判断肿瘤复发和预后提供参考依据。另外,本研究中EGC 患者手术前后血清PGⅡ水平未见明显变化,且与健康人群比较,差异无统计学意义,其原因可能与EGC 对胃黏膜损伤程度较轻、胃窦幽门腺和十二指肠Brunner腺代偿性分泌增加有关。
ESD技术用于EGC治疗已较为成熟,既往研究[14]认为,其完整切除率可达94.90%~97.70%,且术后5年生存率约为83.10%~97.10%,与外科手术效果相当,且术后并发症明显减少,对促进患者康复具有明显优势。本研究对326例经ESD治疗的EGC患者术后随访5年,结果显示,肿瘤复发21 例(6.44%),进一步比较PG、G-17 和Hp-IgG 变化显示,复发组和对照组术后3个月血清PGⅠ和PGR水平均明显升高,血清G-17水平均明显降低,且复发组PGⅠ和PGR明显低于对照组,G-17 明显高于对照组,但复发组手术前后Hp-IgG 阳性率均高于对照组,提示PGⅠ、PGR和G-17与术后复发关系密切。
EGC患者因胃黏膜腺体破坏导致PGⅠ分泌减少,G-17 水平可代偿性升高,ESD 术中将肿瘤病灶完整切除,有利于胃壁生理结构恢复正常,使PGⅠ合成增加和G-17 缓慢下降,但部分患者因致癌因子持续作用导致胃底腺基因受损,从而无法完全恢复[15-16]。本研究采用二元Logistic 回归分析影响EGC 患者术后复发的因素,结果显示,PGⅠ、Hp-IgG和PGR均为影响患者术后复发的重要因素,对预测肿瘤复发具有一定的参考价值。胃体和胃底均有可分泌G-17 的腺体,G-17 分泌存在代偿机制,受肿瘤的影响相对较小,本研究结果也表明血清G-17水平与EGC术后复发无明显关系。
本研究分析PGⅠ和PGR 预测EGC 患者术后复发的价值,AUC 分别为0.772 和0.835,灵敏度分别为85.71%和76.19%,特异度分别为63.61%和83.61%,可见PGⅠ和PGR预测EGC患者术后复发均具有较高的灵敏度,可为评估EGC 术后复发风险提供重要参考依据,同时特异度相对偏低,可能与术后其他疾病对PGⅠ分泌造成干扰有关,PGR兼有PGⅠ和PGⅡ水平的变化,其预测EGC 术后复发的准确率更高。张君儒等[17]报道显示,Hp 感染是胃癌复发的主要致病因素,本研究EGC 患者经ESD 治疗后,Hp-IgG 未见明显变化,提示患者术后仍持续存在Hp 感染,并导致肿瘤复发风险增加。本研究显示,血清Hp-IgG 阳性率预测EGC术后复发的AUC为0.612,灵敏度和特异度分别为76.19%和46.23%,表明监测EGC 患者术后Hp 感染状态,对及时发现肿瘤复发并进行有效干预具有重要意义。
综上所述,ESD是治疗EGC的有效方法,监测手术前后PG、G-17 和Hp-IgG 变化,可为预测肿瘤复发提供参考依据。

