深圳湾浮游植物群落结构特征及其与环境因子的关系
陈思, 陈海刚, 田斐, 李艺彤, 张林宝, 张喆, 王学锋, 蔡文贵, *
深圳湾浮游植物群落结构特征及其与环境因子的关系
陈思1, 2, 3, 陈海刚2, 田斐2, 李艺彤2, 张林宝2, 张喆2, 王学锋4, 蔡文贵2, *
1. 上海海洋大学水产与生命学院, 上海 201306 2. 中国水产科学研究院南海水产研究所, 广东省渔业生态环境重点实验室, 农业部南海渔业资源环境重点野外科学观测实验站, 广东珠江口生态系统野外科学观测研究站, 广东, 广州 510300 3. 广州彭加木纪念中学, 广东, 广州 510430 4. 南方海洋科学与工程广东省实验室(湛江), 广东, 湛江 524025
为研究深圳湾海域浮游植物的群落结构及其与水环境的关系, 分别于春夏秋冬(2013年8月至2014年4月)四个季度对深圳湾进行采样分析, 并对调查区域内的浮游植物及其主要环境因子进行了相关性分析。结果表明, 深圳湾海域共鉴定出浮游植物111种(包括变种和变型):硅藻35属86种, 甲藻4属15种, 绿藻6属6种, 蓝藻3属4种, 其中硅藻门是主要的优势类群, 占总种数的77.5%, 其次是甲藻门, 占总种数的13.5%, 绿藻门和蓝藻门分别占总种数的5%和4%。浮游植物种类组成以广温广盐种和暖水种为主, 中肋骨条藻(Skeletonema costatum)是该海域常年优势种。深圳湾海域浮游植物细胞丰度年波动范围为28.64—462.46×104cells·m–3, 平均值为156.43×104cells·m–3, 其季节变化趋势为秋季>夏季>冬季>春季。浮游植物多样性指数和均匀度指数变化范围分别为0.11—4.06和0.04—0.90, 多样性指数和均匀度指数均偏低, 群落结构趋于单一化, 稳定性差。浮游植物细胞丰度与环境因子的相关性关系在不同季节有显著差别, 其中无机氮与浮游植物细胞丰度之间呈现正相关关系。
深圳湾;浮游植物; 群落结构; 环境因子
0 前言
深圳湾为珠江口伶仃洋东侧中部的一个内宽外窄的半封闭浅水海湾, 位于深圳经济特区和香港特别行政区之间, 海湾水域面积90.8 km2, 平均水深不超过2.9 m, 最大水深不超过5 m[1]。深圳湾生态系统是华南地区具有国际意义的最重要的湿地生态系统之一。近20年来, 深圳湾两岸的经济快速发展, 给深圳湾海域带来了极大的环境压力, 深圳湾海湾富营养化[2]、赤潮频发[3]、细菌污染[4]等问题不断出现, 海湾生态系统遭受到严重的破坏, 严重影响到市民的生产生活。
浮游植物作为海洋生态系统中的初级生产者, 其群落结构变化与环境因子密切相关, 浮游植物可对环境条件变化迅速做出响应, 其种类组成、数量和优势种在不同的水环境中变化很大[5–7]。深圳湾海水富营养化程度很高, 高度富营养化的水体使得深圳湾海域赤潮频发[8]。对深圳湾浮游植物的重视源于1988年春季环节环沟藻赤潮的研究, 王朝晖等[9]分析了深圳湾环节环沟藻赤潮发生的原因。孙金水[10]等(2006)分析了深圳湾海域浮游植物的分布情况, 发现深圳湾浮游植物细胞丰度呈明显双周期变化, 平面分布表现为由海湾中部向湾口递减的格局。温度和营养盐是限制浮游植物生长的重要环境因子[11–12]。张才学[12]研究了2008年深圳湾海域浮游植物和营养盐间的关系, 从优势种的种类数和多样性指数分析, 深圳湾浮游植物的群落结构已趋于单一化, 生态系统抗干扰能力极为脆弱。本文根据2013—2014年4个季度航次的现场浮游植物资料, 分析了深圳湾海域浮游植物的种类组成、丰度季节分布特征、生物多样性和群落结构, 探讨了海洋环境因子与浮游植物群落关系, 为进一步研究该海区浮游植物群落生态变化积累资料, 并为深圳湾生态环境保护和海洋资源可持续利用提供科学依据。
1 材料与方法
1.1 采样时间与站位
在深圳湾海域设置了15个调查站位, 于2013年8月到2014年4月对深圳湾海域浮游植物群落的季节变化进行研究, 调查分4个航次进行, 分别为2013年8月(夏季)、2013年11月(秋季)、2014年1月(冬季)和2014年4月(春季)。
1.2 样品的采集、测定和鉴定
1.2.1 样品的采集与分析
定性样品用使用浅水Ⅲ型浮游生物网, 采用垂直拖网方式采样, 样品用中性甲醛溶液(浓度为采集样品的 4%—5%)固定, 定性样品沉淀24 h后, 摇匀后取中间层水样制作临时封片, 在显微镜 (Olympus CX31)下观察浮游植物形态特征并对浮游植物进行定性鉴定。浮游植物定量样品用有机玻璃采水器取水样1 L装入聚乙烯瓶中, 水样采集后, 立即用鲁哥氏液固定。水样经过48 h两次沉淀后被浓缩至20—30 mL, 取0.1 mL均匀样品在光学显微镜下进行种类鉴定和细胞计数。样品处理方法依照《海洋调查规范第6部分:海洋生物调查》(GB 12763.6—2007)要求进行。

图1 深圳湾调查站位
Figure 1 Locations of sampling sites in Shenzhen Bay
对同步环境要素进行监测, 监测内容包括温度、盐度、溶解氧、无机氮和活性磷酸盐等, 监测方法按照《海洋监测规范第4部分:海水分析》(GB17378.4—2007)的要求进行。
1.2.2 生物多样性分析
(1)浮游植物优势度()应用以下公式计算:
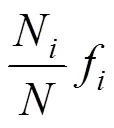
式中:n为第种的个体数;f是该种在各站中出现的频率;为所有站每个种出现的总个体数, 定义值大于 0.02 的种类为本次调查的优势种。
(2)采用Shannon—Weaner指数[13]测定浮游植物的多样性指数, 其计算公式为:
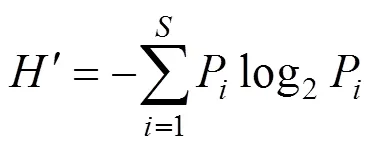
式中:′为种类多样性指数;为样品中的种类总数;为第种的个体数与总个体数的比值。
(3)采用Pielou[14]均匀度测定浮游植物的均匀度, 其公式为:
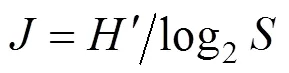
式中:为均匀度;′为种类多样性指数;为样品中的种类总数。
浮游植物与环境因子的Pearson相关性分析采用SPSS软件; 细胞丰度分布图采用ArcGIS软件完成; 其余插图用Origin2017完成; 此外, 采用马建新[15]提出的浮游植物多样性评判阈值对深圳湾海域浮游植物多样性水平进行评价。
2 结果与分析
2.1 浮游植物的种类与组成
深圳湾海域共鉴别出浮游植物111种, 其中, 硅藻35属86种, 甲藻4属15种, 绿藻6属6种, 蓝藻3属4种。深圳湾海域浮游植物的主要类群是硅藻, 占总种数的77.5% ; 其次是甲藻, 占总种数的13.5%, 其他种类占总种类数9%。硅藻门中以角毛藻属()种类最多(18种), 占硅藻总种数的20.9%, 其次为圆筛藻属()(13种)和菱形藻属()(8种), 分别占硅藻总种数的15.1%和22.9%。甲藻门中以角藻属()(9种)为主, 占甲藻总种数的60%。4个季节的调查中, 浮游植物种类季节变化明显, 冬季种类数最高, 为59种, 其次是春季, 为57种, 夏季、秋季各为27和25种。浮游植物的群落组成以沿岸广布种为主, 同时出现较多咸淡海种类。浮游植物种类组成及分布见图2。
2.2 浮游植物细胞丰度
浮游植物细胞丰度季节性变化显著, 波动范围为28.64—462.46×104cells·m–3, 平均为156.43×104cells·m–3。秋季的平均细胞丰度最高, 为462.46×104cells·m–3, 夏季和冬季平均细胞丰度较接近, 分别为76.32×104和58.29×104cells·m–3, 春季细胞丰度最小, 仅为28.64×104cells·m–3。深圳湾海域浮游植物细胞丰度在秋季出现了明显的峰值, 在春季细胞丰度达到最低值, 属于单峰型。总体上, 深圳湾浮游植物细胞丰度呈现西岸(深圳一侧)高于东岸(香港一侧), 湾内高于湾口的趋势。
深圳湾海域春夏秋冬四个季节, 硅藻门的平均丰度远高于其他浮游植物, 分别占相应季节的95.99%、93.12%、91.20%和98.86%, 甲藻门和蓝藻门所占比例均低于硅藻门, 深圳湾海域主要浮游植物为硅藻门。
2.3 浮游植物的优势种和季节演替
调查结果显示, 深圳湾海域共出现浮游植物优势种14种, 其中春季7种; 夏季4种; 秋季2种; 冬季3种(表3)。4个季度均为优势种的种类没有, 中肋骨条藻在三个季度都是优势种。优势度最高的是秋季的中肋骨条藻, 占细胞总量的83.99%; 其次是夏季的小型月牙藻(), 占细胞总量的42.64%; 冬季第一优势种为中肋骨条藻, 其优势度为0.565, 占细胞总量的56.46%; 春季以冕孢角毛藻()优势度最高(0.122)。四个季度中, 硅藻门占所出现优势种比例最大。这一结果与袁超[11]2010—2011年深圳湾浮游植物调查结果一致。

表1 浮游植物多样性程度评判阈值
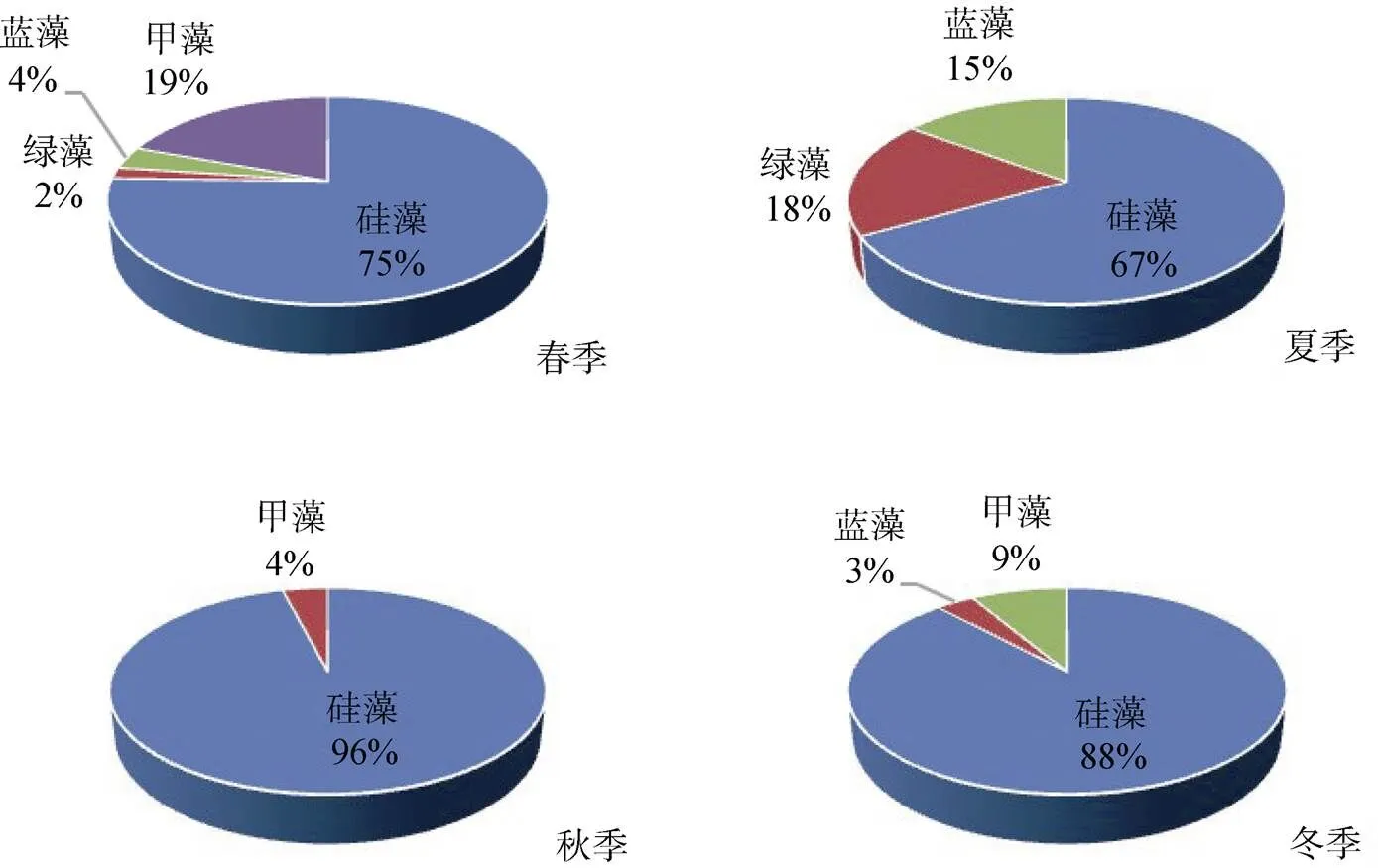
图2 物种类组成和数量的季节变化
Figure 2 Seasonal changes of species composition and phytoplankton density
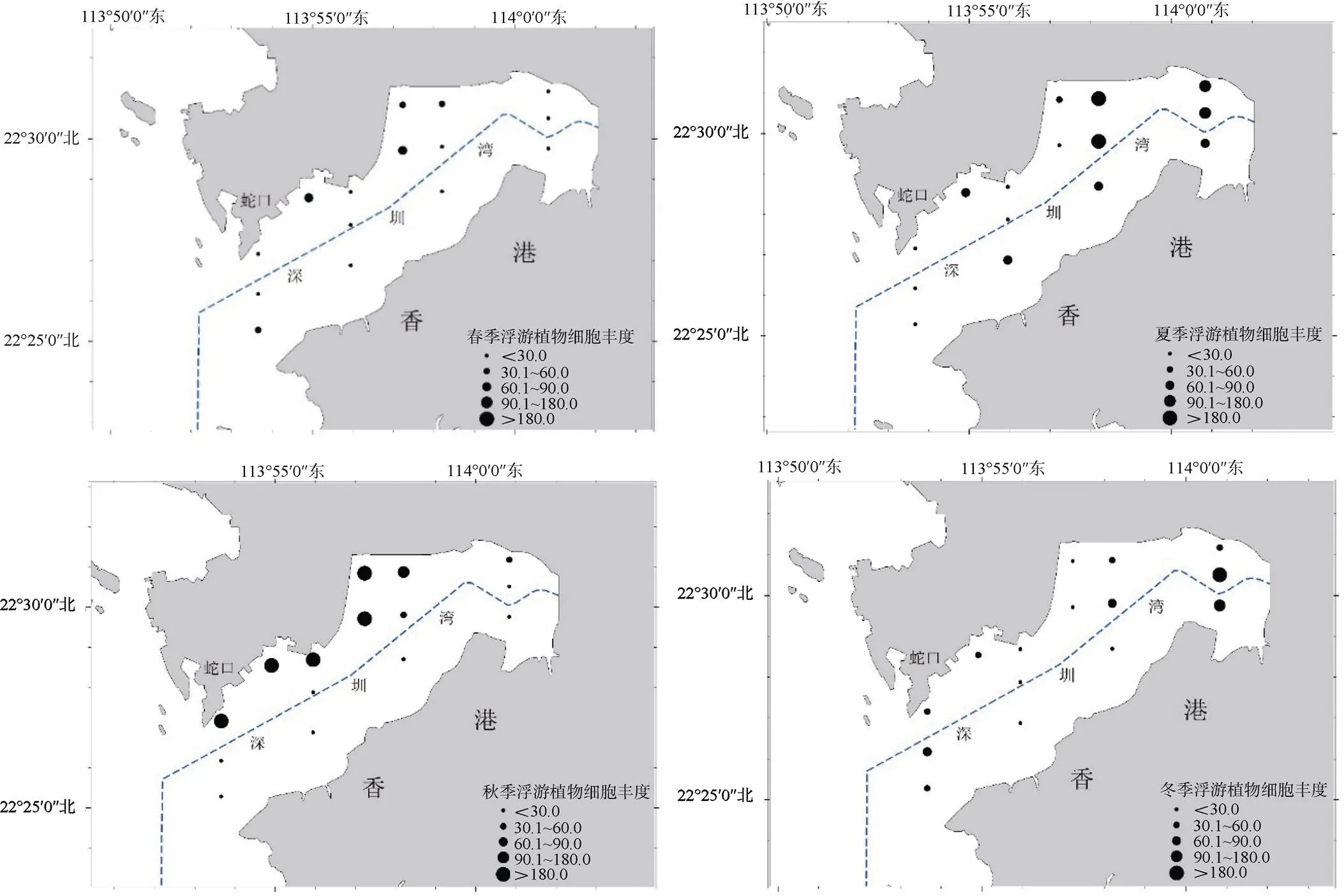
图3 深圳湾浮游植物平面分布和季节变化
Figure 3 Horizontal distributions and seasonal changes of densities of phytoplankton in Shenzhen Bay
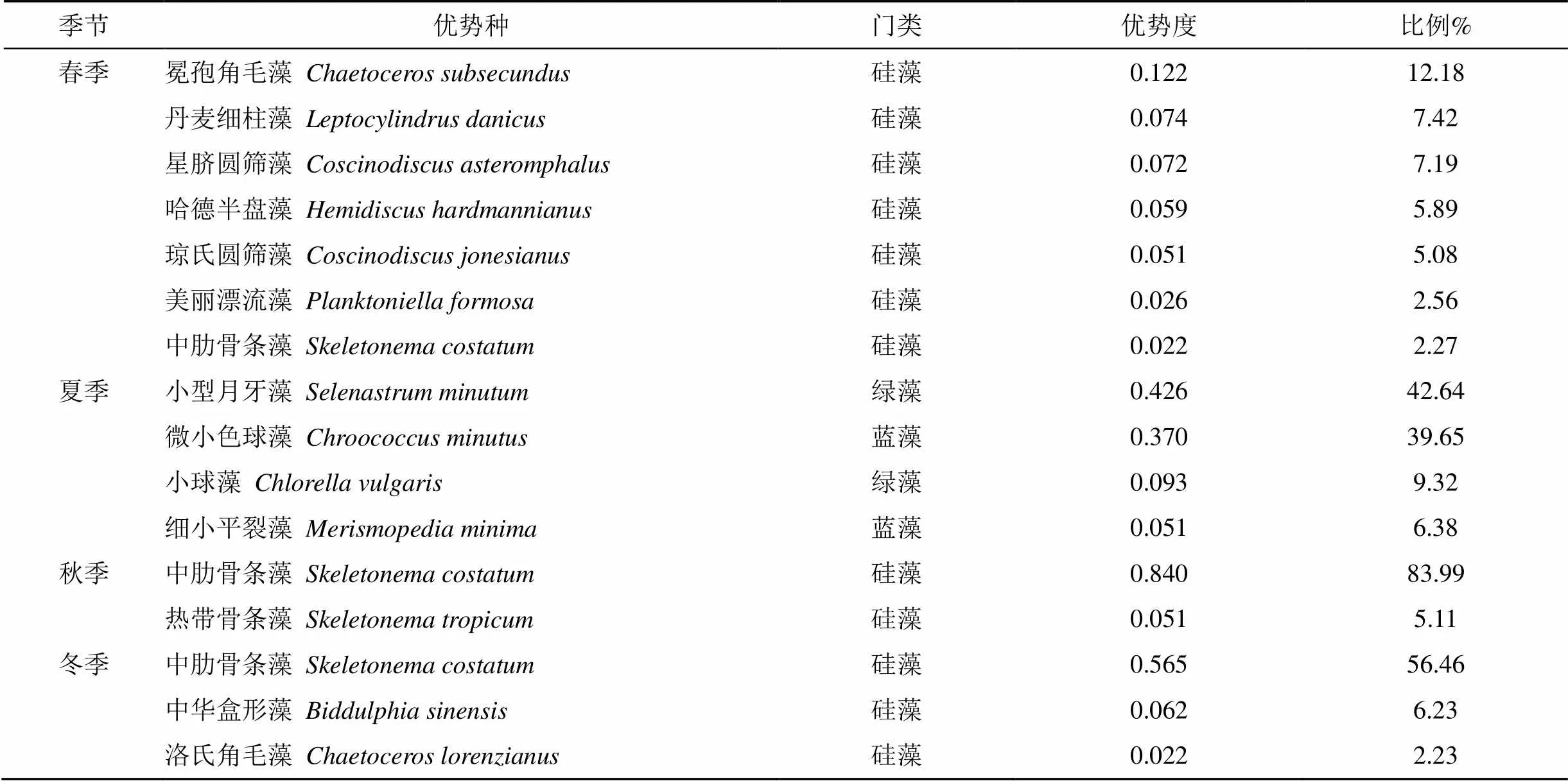
表 2 浮游植物的优势种及在各站的细胞丰度占比(优势度Y>0.02)
注:细胞丰度单位:×104cells·m–3。
2.4 浮游植物多样性指数和均匀度的变化
深圳湾各站位浮游植物多样性指数变化范围为0.11—4.06, 在平面分布上, 深圳湾呈现湾口处浮游植物物种多样性较高, 而湾中部和湾内处多样性水平较低。在季节变化上, 春季最高, 平均为2.80, 夏季次之, 平均为2.00, 秋季最小, 平均仅为1.50。在春季, 多样性指数由湾口向湾内逐渐减小; 在夏季, 湾口处多样性指数较高, 而湾中部较小; 在秋季, 呈现西岸(深圳一侧)高于东侧(香港一侧); 在冬季, 湾中部较高, 湾口和湾内多样性指数较低均匀度变化范围为0.04—0.90, 平均是春季较高(0.80), 其余季节次之, 均为0.50。
2.5 浮游植物丰度与环境因子关系
深圳湾海域水温季节变化表现为夏季最高(28.65 ℃), 春季次之(28.59 ℃), 秋季(26.9℃)冬季最低(17.6 ℃)。盐度季节变化表现为秋季(23.46)>冬季(23.28)>夏季(14.44)>春季(12.38), 春季海水盐度平均值显著低于其他季节, 仅为12.87。pH值和盐度各站位差异较小, 其变化趋势表现为从湾内到湾口呈逐渐升高趋势。总氮、总磷、无机氮和磷酸盐等表现为湾内到湾口逐渐降低趋势。将浮游植物细胞丰度与pH、盐度、溶解氧、和水温等主要环境因子进行Pearson相关回归系数分析(表4), 从表中可以看出, 夏季、秋季浮游植物细胞丰度和无机氮显著正相关, 冬季浮游植物细胞丰度和盐度显著负相关, 和总氮、总磷和无机氮显著正相关(p<0.05), 而其他环境因子与浮游植物细胞丰度相关性不大。
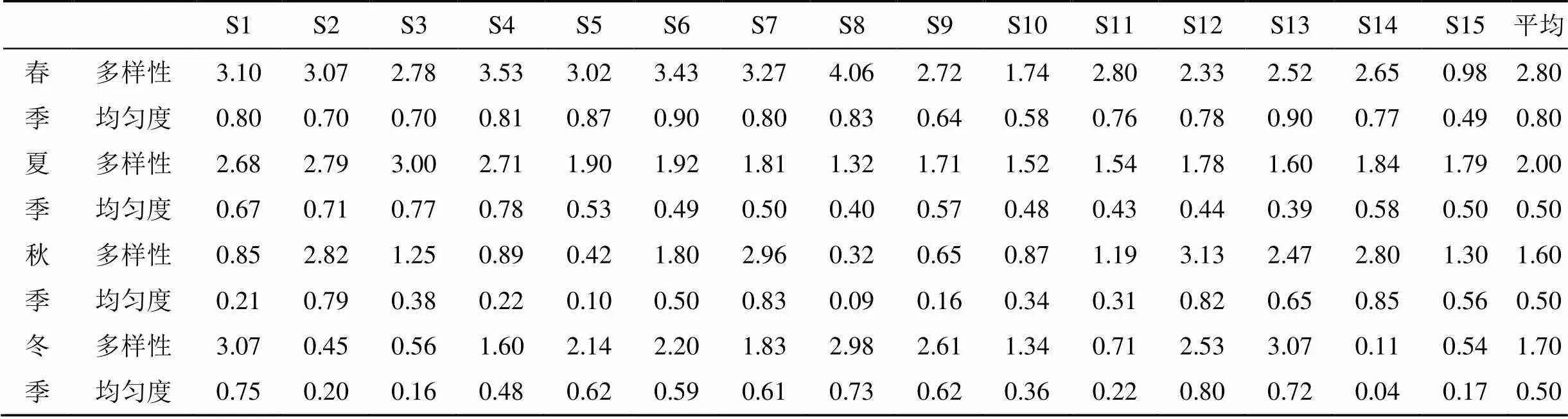
表 3 各季节浮游植物多样性指数及均匀度

表4 浮游植物细胞丰度与环境因子的相关性
注:*.<0.05; **.<0.01。
3 讨论
3.1 浮游植物群落结构
深圳湾地处亚热带, 水温较高, 湾口水域宽阔, 是咸淡水的交汇处, 盐度较低, 营养盐较高, 适合浮游植物的生长繁殖[1]。该海域浮游植物一般以广温广盐种和沿岸性种类为主。本次调查中, 深圳湾海域共鉴定出浮游植物111种, 以硅藻门为主。这与胶州湾[16]大亚湾[17]莱州湾[18]等其他海湾情况一致。与2006年孙金水[10]的调查结果相比, 深圳湾海域硅藻门总种类数所占比例下降, 甲藻门所占比例呈现明显上升趋势。
优势种在群落中起着主导作用, 决定着群落结构中的能量传递和物质循环的途径和方式, 支配着群落结构的演替方向。深圳湾海域主要优势种是中肋骨条藻、冕孢角毛藻、小型月牙藻和微小色球藻()。其中冕孢角毛藻为春季主要优势种, 优势度达0.12, 所占比例12.5%。大量研究表明, 春季是角毛藻的多发季节[19-21]。在春季盐度较低且温度适宜的环境下大量繁殖成为优势种群。夏季优势种有小型月牙藻、微小色球藻、小球藻和细小平裂藻。其中小型月牙藻、微小色球藻优势度较高分别为0.426和0.370, 所占比例为42.64 %和39.65%。冬季和秋季主要优势种为中肋骨条藻, 优势度分别为0.840和0.565, 所占比例为83.99%和56.46%。中肋骨条藻在春秋冬三个季节均为优势种, 这可能与深圳湾无机氮和活性磷酸盐含量较高相关[22]。研究表明, 中肋骨条藻是中国近海常见赤潮藻类, 是富营养化海域常见的优势种[23](表5)。
Shannon—Weaner多样性指数通常反映群落结构的复杂程度, 多样性指数越高, 其群落结构越复杂, 水质越好; 多样性指数减小, 群落结构趋于简单, 稳定性变差, 水质下降[12]。浮游植物物种多样性和均匀度指数季节变化明显, 分别为0.11—4.06和0.04—0.90, 深圳湾海域大部分处于中度污染的状态, 均匀度指数差异较大, 群落结构趋于单一化, 群落稳定性较差。

表5 深圳湾浮游植物群落结构历史资料对比
3.2 浮游植物细胞丰度
浮游植物细胞丰度最高值和最低值分别出现在秋季和春季, 这与袁超等[11]2010—2011年对深圳湾浮游植物的研究相一致。与历史资料相比, 本次调查中浮游植物细胞丰度明显偏低, 这可能与深圳湾水生态系统近年来受到人类活动的破坏相关。深圳湾浮游植物细胞丰度呈现西岸(深圳一侧)高于东岸(香港一侧), 湾内高于湾口的趋势。这可能与深圳湾陆源污染影响相关。人类活动所造成的大量陆源污染物进入深圳湾, 引起富营养化, 促使藻类大量生长繁殖[12]。陆源输入是影响深圳湾海域浮游植物细胞丰度的重要因素。在一般亚热带海域, 浮游植物细胞丰度周年变化曲线呈现双周期变动形式, 春季为最高峰秋季为次高峰[24]。而在本次调查中, 深圳湾浮游植物细胞丰度的季节变化呈单峰型, 秋季浮游植物的平均细胞丰度远大于其余3个季节, 春季细胞丰度最低, 其季节变化趋势为秋季>夏季>冬季>春季。夏秋季降水丰富, 陆源径流较大, 给该海域带来了大量营养物质, 在适宜的水温和光照的作用下, 夏秋季浮游植物大量繁殖。相反, 春季是枯水期, 所需的营养物质较少, 浮游植物生长受限, 细胞丰度降低。
3.3 影响深圳湾浮游植物分布的环境因子
浮游植物的生长繁殖与海水透明度、温度、盐度、pH以及营养盐含量等环境因子密不可分[25–27]。海水中无机氮和磷酸盐等营养盐是浮游植物生长繁殖必不可少的营养元素, TEELING等[28]研究表明, 浮游植物细胞密度与水体内氮磷含量成正相关关系, 在一定的范围内且其他影响因子一致的情况下, 氮磷含量越高, 浮游植物细胞密度越高。对深圳湾各季节浮游植物细胞丰度与其对应的环境因子进行相关性分析发现, 在夏季深圳湾浮游植物细胞丰度与总氮呈极显著正相关关系(<0.01), 在冬季, 深圳湾浮游植物细胞丰度与总氮和无机氮呈极显著相关关系(<0.01), 与总磷呈显著正相关关系(<0.05)。与珠江口的开放性水域不同, 深圳湾属于一个半封闭的水体, 水动力条件差, 水体交换较弱[29], 且受人类活动干扰明显。深圳一侧由于经济高速发展, 营养盐入海负荷量一直处于较高水平, 香港一侧入海通量主要来自元朗, 元朗地区人口稠密, 工商业和养殖业较发达[30]。大量的陆源输入且与外海水域的水体交换能力较弱, 导致深圳湾中平均的氮磷含量居高不下, 无机氮和无机磷含量全年高于四类海水标准。
4 结论
(1)本次调查深圳湾浮游植物共鉴定出111种, 大部分隶属于硅藻门, 占种类总数的77.5%, 甲藻门占13.5%, 绿藻门和蓝藻门分别占5%和4%。中肋骨条藻为深圳湾海域的常年优势种, 且优势度较高。
(2)浮游植物细胞丰度变化范围为28.64—462.46× 104cells·m–3范围内, 平均为156.43×104cells·m–3。秋季的平均细胞丰度远大于其余3个季节, 其季节变化趋势为秋季>夏季>冬季>春季; 其空间变化趋势为湾内高于湾口, 西侧高于东侧。
(3)深圳湾浮游植物物种多样性指数和均匀度指数变化范围分别为0.11—4.06和0.04—0.90, 多样性指数和均匀度指数均偏低, 群落结构趋于单一化, 稳定性差。
(4)浮游植物细胞丰度与环境因子的相关性关系在不同季节有显著差别, 其中营养盐和盐度与浮游植物细胞丰度之间呈现显著的相关性关系。
[1] 王琳, 陈上群. 深圳湾自然条件特征及治理应注意的问题[J]. 人民珠江, 2001, (06): 4–7.
[2] 张瑜斌, 章洁香, 张才学, 等. 赤潮多发区深圳湾叶绿素a的时空分布及其影响因素[J]. 生态环境学报, 2009, 018(5): 1638–1643.
[3] 冷科明, 江天久. 深圳海域近20年赤潮发生的特征分析[J]. 生态科学, 2004, 23(2): 166–170.
[4] 陈淑文, 宋俊廷, 类成龙, 等. 深圳湾浮游细菌生物量的时空动态及影响因素[J]. 海洋学研究, 2016, 34(4): 84– 91.
[5] PADISÁK J, CROSSETTI L O, Naselli-Flores L. Use and misuse in the application of the phytoplankton functional classification: a critical review with updates[J]. Hydrobiologia, 2009, 621(1): 1–19.
[6] RODRIGUES L, SIMÕES N, BOVO-SCOMPARIN V, et al. Phytoplankton alpha diversity as an indicator of environmental changes in a neotropical floodplain[J]. Ecological Indicators, 2015, 48: 334–341.
[7] CUNLIFFE M, SALTER M, MANN P, et al. Dissolved organic carbon and bacterial populations in the gelatinous surface microlayer of a Norwegian fjord mesocosm[J]. FEMS Microbiology Letters, 2009, 299(2): 248–254.
[8] 桓清柳, 庞仁松, 周秋伶, 等. 深圳近岸海域氮、磷营养盐变化趋势及其与赤潮发生的关系[J]. 海洋环境科学, 2016, 035(6): 908–914.
[9] 王朝晖, 齐雨藻, 尹伊伟, 等. 1998年春深圳湾环节环沟藻赤潮及其发生原因的探讨[J]. 海洋科学, 2001, 25(05): 48–51.
[10] 孙金水, WING-HONG WO, 戴纪翠, 等. 深圳湾海域浮游植物的生态特征[J]. 环境科学研究, 2010, 31(1): 63– 68.
[11] 袁超, 徐宗军, 张学雷. 2010-2011年深圳湾浮游植物季节变化及其与环境因子关系[J]. 海洋湖沼通报, 2015, (1): 114–122.
[12] 张才学, 周凯, 孙省利, 等. 深圳湾浮游植物的季节变化[J]. 生态环境学报, 2010, 19(10): 2445–2451.
[13] 中华人民共和国国家标准. 海洋监测规范, 第7部分:近海污染生态调查和生物监测[S]. 北京:中国标准出版社, 2007: 84-85.
[14] PIELOU E C. Species-diversity and pattern-diversity in the study of ecological succession[J]. Journal of theoretical biology, 1966, 10: 370–83.
[15] 马建新, 郑振虎. 莱州湾浮游植物分布特征[J]. 海洋湖沼通报, 2002(4): 63–67.
[16] 杨世民, 王丽莎, 石晓勇. 2009年春季胶州湾浮游植物群落结构特征[J]. 海洋与湖沼, 2014, 45(6): 1234–1240.
[17] 魏雷. 大亚湾海域浮游植物群落结构调查—以2011—2012年为例[J]. 农业与技术, 2017, 37(16): 243–244.
[18] 张晓举, 赵升. 莱州湾西部浮游植物群落与环境因子关系的研究[J]. 大连海洋大学学报, 2018, 33(04): 122–128.
[19] 张冬鹏, 黎晓涛, 黄远峰, 等. 深圳沿海浮游植物组成及赤潮发生趋势分析[J]. 暨南大学学报:自然科学与医学版, 2001, 022(5): 122–126.
[20] 张雪, 徐晓甫, 戴媛媛, 等. 天津近岸人工鱼礁海域浮游植物群落及其变化特征[J]. 渔业科学进展, 2018, 039(6): 1–10.
[21] BODE A, ÁLVAREZ-OSSORIO M T, GONZÁLEZ N, et al. Seasonal variability of plankton blooms in the Ria de Ferrol (NW Spain): II. Plankton abundance, composition and biomass[J]. Estuarine Coastal and Shelf Science, 2005, 63(1–2): 285–300.
[22] 张静, 张瑜斌, 周凯, 等. 深圳湾海域营养盐的时空分布及潜在性富营养化程度评价[J]. 生态环境学报, 2020, 19(2): 7–15.
[23]霍文毅, 俞志明, 邹景忠, 等. 胶州湾中肋骨条藻赤潮与环境因子的关系[J]. 海洋与湖沼, 2001, 32(3): 311–318.
[24] 罗璇, 孙晓霞, 郑珊, 等. 2011年胶州湾网采浮游植物群落结构及其环境影响因子[J]. 海洋与湖沼, 2016, 47(5): 915–923.
[25] HAN Boping, XIAO Lijuan, HU Ren, et al. Succession of phytoplankton functional groups regulated by monsoonal hydrology in a large canyon-shaped reservoir[J]. Water research: A journal of the international water association, 2011, 45(16): 5099-5109.
[26] BERGE T, DAUGBJERG N, Andersen B, et al. Effect of lowered pH on marine phytoplankton growth rates[J]. Marine Ecology Progress Series, 2010, 416(12): 79–91.
[27] MUHID P, DAVIS T W, BUNN S E, et al. Effects of inorganic nutrients in recycled water on freshwater phytoplankton biomass and composition[J]. Water Research, 2013, 47(1): 384–394.
[28] TEELING H, FUCHS B, BECHER D, et al. Substrate- Controlled Succession of Marine Bacterioplankton Populations Induced by a Phytoplankton Bloom[J]. Science (New York, N. Y. ), 2012, 336(6081): 608–611.
[29] HE B, DAI M, ZHAI W, et al. Distribution, degradation and dynamics of dissolved organic carbon and its major compound classes in the Pearl River estuary, China[J]. Marine Chemistry, 2010, 119(1–4): 52–64.
[30] 赵晨辰, 张世彦, 毛献忠. 深圳湾流域TN和TP入海年通量变化规律研究[J]. 环境科学研究, 2014, 35(11): 4111–4117.
Community structure of phytoplankton and its relationship to environmental factors in Shenzhen Bay
CHEN Si1, 2, 3, CHEN Haigang2, TIAN Fei2, LI Yitong2, ZHANG Linbao2, ZHANG Zhe2, WANG Xuefeng4, CAI Wengui2, *
1. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China 2. South China Fisheries Research Institute, Guangdong Provincial Key Laboratory of Fishery Ecology and Environment, Scientific Observation and Research Field Station of Zhujiang Estuary Ecosystem, Guangdong Province, Key Field Scientific Experimental Station of South China Fishery Resource and Environment, Ministryof Agriculture, Guangzhou 510300, China 3. Guangzhou Peng Jia Mu Memorial Secondary School, Guangzhou 510430, China 4. Southern Marine Science and Engineering Guangdong Laboratory(Zhangjiang), Zhanjiang 524025, China
In order to investigate the phytoplankton community structure and its relationship with the aquatic environmental factors in the Shenzhen bay, samples were collected and analyzed in four quarters from August 2013 to April 2014, and the correlation between phytoplankton and its main environmental factors was analyzed. Results showed that a total of 111 species (including varieties and forma) were identified, of which the most abundant group was, with 35 genera and 86 species that accounted for 77.5% of total species, followed by(4 genera and 15 species, 13.5%),(6 genera and 6 species, 5%) and(3 genera 4 species, 4%).was the dominant species. The abundance of phytoplankton cells varied from (28.64-462.46)×104cells·m–3, with an average of 156.43×104cells·m–3. The maximum cell abundance appeared in the autumn, followed in summer, spring and winter The diversity index of the phytoplankton ranged from 0.11 to 4.06; the evenness of phytoplankton ranged from 0.04 to 0.90.The diversity and evenness of phytoplankton community were rather low, indicating that phytoplankton community was not steady. Better relationship was found between phytoplankton abundance and inorganic nitrogen.
Shenzhen Bay; phytoplankton; community structure; environmental factors
陈思, 陈海刚, 田斐, 等. 深圳湾浮游植物群落结构特征及其与环境因子的关系[J]. 生态科学, 2021, 40(1): 9–16.
CHEN Si, CHEN Haigang, TIAN Fei, et al. Community structure of phytoplankton and its relationship to environmental factors in Shenzhen Bay[J]. Ecological Science, 2021, 40(1): 9–16.
10.14108/j.cnki.1008-8873.2021.01.002
Q178
A
1008-8873(2021)01-009-08
2020-03-03;
2021-03-08
南方海洋科学与工程广东省实验室(湛江)资助项目( ZJW-2019-06) ; 中国水产科学研究院南海水产研究所中央级公益性科研院所基本科研业务费专项资金项目(2021SD17); 广东省科技计划项目(2019B121201001)
陈思(1994—), 女, 黑龙江双鸭山人, 硕士研究生,主要从事海洋生态学研究, E-mail: xiaochensi2@163.com
蔡文贵(1965—), 男, 研究员, 主要从事渔业生态环境方面研究, E-mail: cai-wengui@163.com

