脑脊液、血清免疫球蛋白及脑脊液寡克隆区带在诊断自身免疫性脑炎中的应用价值
付 璐,王子燚
(1.吉林市人民医院神经内科,吉林 吉林 132000;2.吉林大学白求恩第一医院神经内科,吉林 长春 130021)
自身免疫性脑炎(autoimmune encephalitis, AE)属于一种因免疫系统对中枢神经系统抗原发生反应所引起的疾病类型,典型特点为精神症状、认知障碍及癫痫(亚急性或者急性发作)等[1]。若无法早期明确病因,延误最佳治疗时机,可导致患者致残、致死率升高。因AE抗体检测费用高,故难以广泛开展。在整个机体免疫系统当中,免疫球蛋白为其基本构成,其中,免疫球蛋白G(IgG)有着最小的分子量,易通过血脑屏障,并且脑脊液(CSF)中的免疫细胞,同样会产生大量的IgG,从而成为CSF中的重要抗体。所谓CSF寡克隆区带(OCB)是指在γ球蛋白区带中出现的一个不连续的区带,此乃神经系统当中能够实现IgG合成的基本标志,对AE患者CSF中免疫球蛋白的实际含量进行测定,且分析其含量变化与检测CSF中OCB,对于明确AE病因与预后判断有着积极的意义。有研究指出,在诊断AE时选用CSF、血清免疫球蛋白等指标,且与CSF中OCB相联合,可获得理想的诊断效能[2]。当前关于此领域研究报道仍较少,相关理论依据不足。因此本研究探讨CSF、血清免疫球蛋白及CSF中OCB 在诊断AE中的应用价值,现报道如下。
1 资料与方法
1.1 一般资料 以回顾性分析展开本次研究,选取2019年2月至2020年2月吉林市人民医院收治的16例AE患者,其中男性7例,女性9例;年龄20~62岁,平均(40.28±10.16)岁;学历:高中及以下5例,大专及以上11例;体质量55~84 kg,平均(68.25±3.61)kg。另选取同期收治的20例多发性硬化(multiple sclerosis,MS)患者和32例病毒性脑炎(viral encephalitis,VE)患者,MS患者中男性12例,女性8例;年龄20~60岁,平均(40.57±9.80)岁;学历:高中及以下7例,大专及以上13例;体质量55~85 kg,平均(68.41±3.68)kg。VE组患者中男性20例,女性12例;年龄21~60岁,平均(40.15±9.52)岁;学历:高中及以下13例,大专及以上19例;体质量55~84 kg,平均(68.54±3.69)kg。3组患者一般资料相比,差异无统计学意义(P>0.05),具有可比性。纳入标准:符合《神经病学》[3]中的相关诊断标准;初诊患者;无免疫制剂治疗史者等。排除标准:其他因素引起的脑炎;恶性肿瘤、精神疾病;严重脏器功能障碍(如心、肾等);中途退出者等。本研究经院内医学伦理委员会批准。
1.2 方法 所有患者均采用腰椎穿刺的方法,对CSF进行收集,并分为4管(2 mL/管);另于患者空腹状态下,抽取其静脉血(4管:3 mL/管);将血液进行离心处理(转速为3 500 r/min,时间为15 min),分离血清。①用BN-Ⅱ特种蛋白分析仪(SIEMENS公司),采用免疫散射比浊法对CSF中的IgG以及血清IgG、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)浓度进行测定。②用电泳分析仪(SEBIA HYDRAGEL公司),采用琼脂糖等电聚焦法对CSF与血清中的OCB进行检测。严格依据说明书进行操作。
1.3 观察指标 ①对比3组患者血清IgG、IgA、IgM水平及IgG指数、CSF-IgG水平。IgG指数=(脑脊液IgG/血清IgG)/(脑脊液白蛋白/血清白蛋白),临床医师开展腰椎穿刺采集CSF,穿刺后,医师做压力测定,然后把CSF置入无菌试管中,可形成不溶性蛋白盐而下沉,产生白色浑浊或沉淀,CSF白蛋白正常值为0.15~0.45 g/L;血清白蛋白则通过离心处理,分离血清而得。若IgG指数>0.7,即表明IgG鞘内合成有明显增加。②对比3组患者OCB阳性率,OCB结果的判定标准,在CSF电泳图谱当中,若有≥2条的IgG出现,即阳性;如果在血清与CSF当中均出现有≥2条的IgG条带,而血清与CSF当中出现的条带位置相同,即阴性,若不同,即阳性;CSF与血清当中均未出现,即阴性;若CSF当中未出现,血清样本当中出现,即阴性[4]。③分析各组患者MR影像学特征。
1.4 统计学方法 采用SPSS 21.0统计软件分析数据,计数资料用[例(%)]表示,采用χ2检验;计量资料用(±s)表示,采用t检验,多组间计量资料比较采用重复测量方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 血清IgG、IgA、IgM、IgG指数、CSF-IgG水平 AE组患者IgG、IgG指数、CSF-IgG水平均显著高于VE组、MS组,血清IgM水平显著低于VE组;其中VE组患者IgG、IgG指数、CSF-IgG水平均显著低于MS组,血清IgM水平显著高于MS组,差异均有统计学意义(均P<0.05),见表1。
表1 3组患者血清IgG、IgA、IgM、IgG指数、CSF-IgG水平比较(±s)
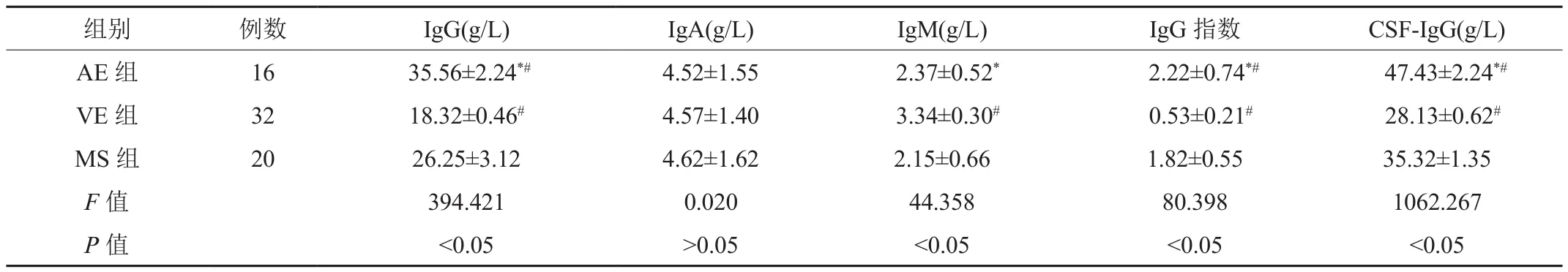
表1 3组患者血清IgG、IgA、IgM、IgG指数、CSF-IgG水平比较(±s)
注:与VE组比,*P<0.05;与MS组比,#P<0.05。AE:自身免疫性脑炎;VE:病毒性脑炎;MS:多发性硬化;IgG:免疫球蛋白G;IgA:免疫球蛋白A;IgM:免疫球蛋白M;CSF:脑脊液。
组别 例数 IgG(g/L) IgA(g/L) IgM(g/L) IgG指数 CSF-IgG(g/L)AE 组 16 35.56±2.24*# 4.52±1.55 2.37±0.52* 2.22±0.74*# 47.43±2.24*#VE 组 32 18.32±0.46# 4.57±1.40 3.34±0.30# 0.53±0.21# 28.13±0.62#MS 组 20 26.25±3.12 4.62±1.62 2.15±0.66 1.82±0.55 35.32±1.35 F值 394.421 0.020 44.358 80.398 1062.267 P值 <0.05 >0.05 <0.05 <0.05 <0.05
2.2 OCB阳性率 AE组患者OCB阳性率显著高于VE组,VE组患者OCB阳性率显著低于MS组,差异均有统计学意义(χ2值=18.053、10.921,均P<0.05),见表2。

表2 3组患者OCB阳性率比较[例(%)]
2.3 MR表现 在MR表现特点上,AE患者多累及侧脑室旁、海马、枕叶、顶叶,VE患者多累及额叶、颞叶,MS多累及侧脑室旁、枕叶,3组患者双侧广泛病变占比均显著高于50%;AE组患者累及患者侧脑室旁、岛叶、顶叶的占比均显著高于VE组,累及基底节、颞叶、额叶的占比均显著低于VE组;VE组患者累及脊髓、侧脑室旁、枕叶的占比均显著低于MS组,差异均有统计学意义(均P<0.05),见表3。图1-A:AE患者,男,30岁,双侧颞叶呈双侧对称性,磁共振液体衰减反转恢复序列(FLAIR)显示为高信号;图1-B:VE患者,男,47岁,头MR显示累及额、颞叶,FLAIR显示为高信号;图1-C:MS患者,男性,64岁,扩散加权成像(DWI)显示左颞叶呈高信号。
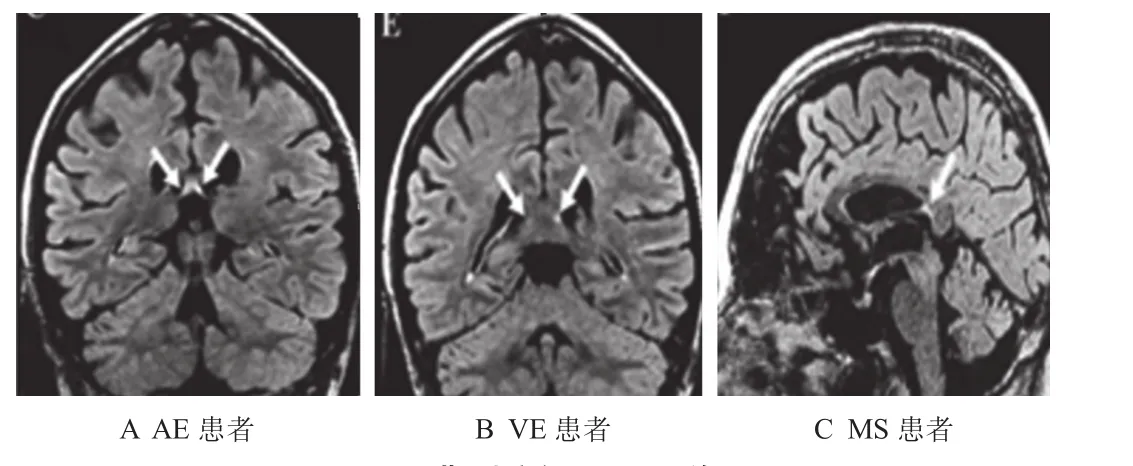
图1 典型病例MR图像

表3 3组患者MR影像学病变部位出现频次比较[例(%)]
3 讨论
脑炎的发病率较高,但多数诱因尚不明确,在原因未明的这部分患者中,有许多患者在接受免疫调节(如血浆置换、糖皮质激素等)治疗后可康复;伴随当今免疫学科的持续发展和完善,许多免疫抗体被成功发现,而且在临床中得到广泛应用,一些患者的病因被明确[5]。
免疫球蛋白为机体免疫系统的关键构成部分,在正常的CSF中,免疫球蛋白含量最高的是IgG,其次为IgA,最少的是IgM;CSF中的免疫细胞能够产生IgG,能够形成CSF当中免疫球蛋白的主要抗体,同时因IgG分子量最小,其极易通过血脑屏障;而IgM主要由脾脏大单核细胞所产生,有着比较大的分子量,难通过血脑屏障,所以,CSF当中有着较少的IgM;IgA尽管有着较大的分子量,难穿透血脑屏障,但CSF中的免疫细胞能够产生一定的IgA,因此,CSF中的IgA含量多于IgM;当机体处于正常状态下,CSF当中的IgG、IgA、IgM易受血清水平的影响[6]。本研究中,AE组患者血清IgG、IgG指数水平、CSF-IgG水平均显著高于VE组、MS组,提示AE组存在鞘内IgG合成与体液免疫应答增强的情况;VE组患者血清IgM显著高于AE组、MS组;究其原因可能与VE组因早期病毒感染造成IgM异常升高相关。CSF中的浆细胞、淋巴细胞能加速CSF中免疫球蛋白合成量的增加,而且还会升高鞘内免疫球蛋白,尤其是CSF中的IgG等,所以,CSF中出现免疫球蛋白增加时,其升高的程度与患者炎症程度相关,提示此类患者对免疫抑制剂、一线激素治疗比较敏感[7]。OCB为神经系统内部可以合成IgG的基本标志。本研究结果显示,AE组患者OCB阳性率显著高于VE组,VE组患者OCB阳性率显著低于MS,提示OCB在诊断AE方面也有着较高的应用价值。本研究中,3组患者的MR图像均存在各种病变部位的累及情况,提示临床仍需加强对此类患者的监测,以促进患者病情改善。
综上,AE患者鞘内蛋白合成增加,CSF、血清免疫球蛋白及CSF中OCB在AE的早期诊断中应用价值突出。但需要指出的是,因本次研究病例数选取较少,故在研究数据上与现实情况可能存在一定偏差,因此需要进一步深入研究。

