中/ 低危前列腺癌近距离照射联合雄激素阻断治疗与根治术联合雄激素阻断的疗效比较
魏德超,冯 涛,李乾坤,郭朋举,王永兴,赵佳晖,李明川,韩毅力,姜永光,罗 勇
(首都医科大学附属北京安贞医院泌尿外科,北京 100029)
前列腺癌(prostate cancer,PCa)位居全球男性恶性肿瘤发病率的第2位,占全球男性新发恶性肿瘤的13.5%[1],目前我国PCa的发病率也呈显著上升趋势。早期局限性PCa的根治性治疗包括近距离照射治疗(brachytherapy,BT)、外放射治疗(external beam radiotherapy,EBRT)和PCa根治术(radical prostatectomy,RP)。其中,前列腺BT在微创性方面的固有优势及其对肿瘤的治疗效应已经得到广泛认可。美国抗癌协会及欧洲泌尿外科协会均建议,前列腺BT单用或联合EBRT和(或)雄激素阻断治疗(androgen blockade therapy,ADT)可应用于不同肿瘤分期及危险程度分级的一线治疗[2-3]。但在中/低危PCa治疗中,BT及RP的生存及预后尚缺乏对照研究资料。本文将对比分析接受BT+ADT或RP+ADT两组患者在生存预后及PSA动力学方面的差异,现将结果报告如下。
1 资料与方法
1.1 研究对象回顾性分析2015年1月至2019年1月间在首都医科大学附属北京安贞医院就诊的所有PCa患者的临床资料,选取中/低危PCa患者(Gleason评分≤7,术前PSA≤20 ng/mL,影像学或术后病理证实肿瘤局限于单侧叶、无淋巴及远处转移,如患者接受根治术则其Gleason评分以术后病理为准)进行随访,随访结束时间为2020年1月。符合标准的患者共153例,根据患者接受的治疗方案分为BT+ADT组(68例)和RP+ADT组(85例)。
治疗方案:BT治疗方式为I125前列腺间质内永久性植入,放射处方剂量145 Gy,如术前前列腺体积>50 mL,给予ADT治疗3个月后再行BT治疗。ADT治疗方式为LHRH-α联合抗雄激素药物持续4~6个月。所有手术患者均接受腹腔镜RP。
1.2 随访内容PSA动力学资料:详细回顾患者术前PSA基线水平,术后第1年每3个月复查PSA,术后第2年起每6个月复查PSA,记录患者接受治疗后的PSA最低值、降至最低值的时间及PSA最大降幅。
终点事件:分析患者无病生存率(disease free survival,DFS)和总生存率(overall survival,OS)。PSA生化复发、影像学变化或出现转移相关症状,可认定为疾病进展。

2 结 果
2.1 两组患者的临床基线资料两组患者的发病年龄、腺体体积、肥胖情况、是否吸烟、糖尿病并发情况等临床资料比较差异无统计学意义(P>0.05),详见表1。

表1 两组患者临床基线资料比较[例(%)]
2.2 两组患者生存预后的比较纳入的153例患者中,术后生化复发11例,其中RP+ADT组8例(8/85),BT+ADT组3例(3/68)。两组患者DFS无显著差异(P=0.299,图1A)。入组患者随访过程中共死亡7例,其中RP+ADT组4例(4/85),BT+ADT组3例(3/68)。两个治疗组OS无明显差异(P=0.906,图1B),中位DFS及OS暂未达到。
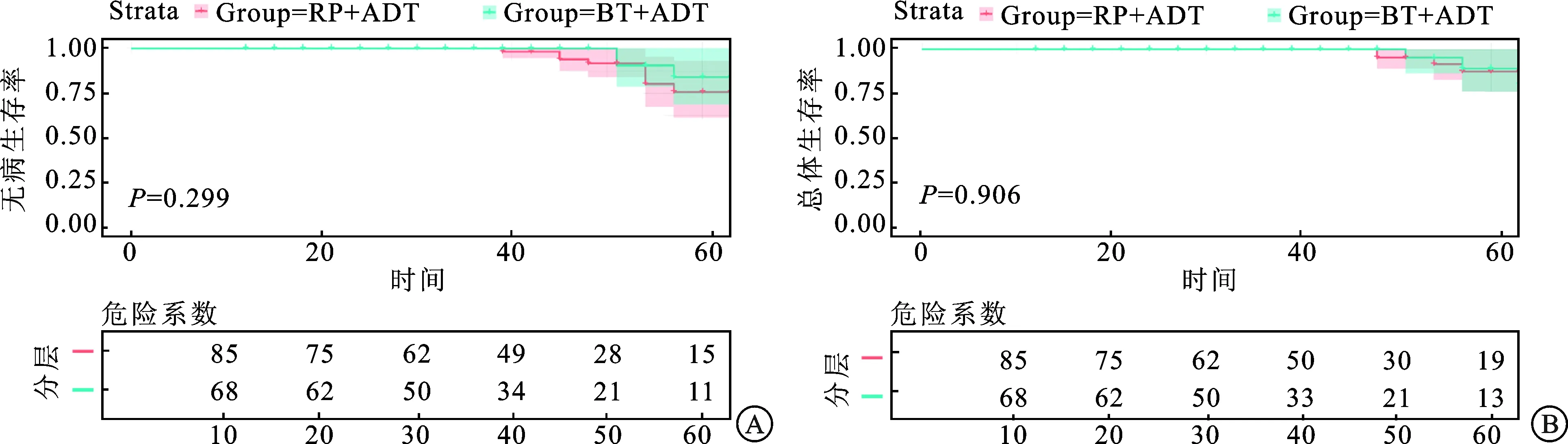
A:RP+ADT与BT+ADT组无病生存率比较;B:RP+ADT与BT+ADT组总体生存率比较。
2.3 两组患者PSA动力学变化的比较治疗后两组患者PSA降幅、PSA最低值、PSA最低值<0.2 ng/mL的比例、降至PSA最低值时间(time to nadir,TTN)PSA动力学变化的比较差异无统计学意义(P>0.05),详见表2、图2。

表2 两组患者PSA动力学资料比较[中位数(范围)]

A:PSA降幅分布;B:PSA最低值分布;C:治疗后降至最低值的时间分布。
3 讨 论
1914年PASTEAU和DEGRAIS首次报道了近距离放射治疗前列腺癌[4],自此前列腺近距离放射疗法已逐渐发展成为一种安全有效的治疗手段。美国近距离治疗协会(American Brachytherapy Society,ABS)[5]和欧洲放射治疗协会(European Society for Therapeutic Radiology and Oncology,ESTRO)指南建议在不同危险程度分级的前列腺癌中均可应用BT[6]。目前认为对于拒绝或无法主动监测的低危PCa患者来说,单用BT是一种很好的治疗方案。而对中危PCa患者,是否在联合EBRT或ADT的基础上应用BT,仍存在不同观点。因为中危PCa存在临床隐匿的前列腺外侵犯(如前列腺外浸润、精囊浸润或淋巴结转移)可能,单用BT具有治疗不足的潜在风险[7-8]。术后病理综合分析显示,肿瘤在前列腺外的径向延伸很少超过5 mm[5,9-12],术前计划中适当调整放射范围可提高BT的治疗效果,进而降低上述风险。高危PCa存在非器官局限性的风险,预后最差,一般推荐综合治疗方案,联合BT可以提高放射剂量、改善EBRT治疗效果,增强对高危PCa的局部控制。与单用EBRT或基于手术的综合方案相比,包含BT的多模式综合治疗在生存预后方面具有优势[13-14]。
另一方面,RP在PCa治疗中地位非常重要,也是泌尿外科医师更青睐的治疗方案。研究发现,与术后病理结果相比,前列腺穿刺活检病理存在不同程度的低估,穿刺诊断为低危的PCa患者尤其应当警惕这种风险[15-16]。RP可获得完整的肿瘤标本,以术后标本为依据的病理分期、Gleason评分、淋巴结侵犯情况评估最为精确可靠。医师可依据术后准确的病理分期、分级结果调整治疗策略,使PCa患者获得更好的肿瘤、生存效益。BT患者无法获取完整的病理标本,资料显示前列腺癌患者术后Gleason评分升级从低危升高至中危发生率在30%~45%[16],接受BT治疗的患者理论上存在治疗不足的风险,需要更加积极和严密的随访。此外,在T1b、T1c、T2a或T2b期,PSA≤20 ng/mL的前列腺癌患者中,放疗前和放疗期间使用ADT 4个月可显著降低疾病特异性死亡率和提高总生存率[17],为了最大程度的降低因活检穿刺低估导致的治疗不足,我们对穿刺诊断为低/中危的PCa给予BT+ADT治疗。另一方面,2014年之后,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南建议中/低危PCa患者如术后出现可测及的PSA等不利特征时应给予ADT治疗[2],但目前对于“可测及的PSA”并无精确定义[18],为了尽可能改善患者的生存预后,我们对这一部分患者也同样给予了ADT治疗,考虑到ADT对患者生活质量的影响,我们将治疗周期控制在4~6个月。
在安全性方面,BT手术创伤小,对患者尤其是高龄患者的心肺功能等基础条件要求较低,经适当选择的患者围手术期并发症的发生率非常低(<5%),常见并发症包括感染、出血、麻醉相关并发症及需置管的一过性膀胱出口梗阻[13]。由于放射源毗邻膀胱和直肠,BT的远期并发症主要表现为消化系统和泌尿生殖系统毒性。大宗回顾研究显示,BT的2、3级毒性反应的发生率在3%~10%左右[19],与RP相比可以更好地保留患者的控尿及勃起功能,对维持患者生活质量具有明显的优势[20-21]。
目前,暂无可评估PCa患者治疗后生存获益的明确手段。但是,治疗后PCa患者的PSA动力学变化,作为一种预测方法,已得到普遍认可。治疗后早期PSA正常化被认为可以有效延缓肿瘤进展,治疗后3个月内PSA能否降至<4 ng/mL比病理Gleason评分更能预测肿瘤进展[14]。RP术后PASDT>11.7个月的PCa患者临床进展风险较低[22]。如EBRT治疗后患者PAS最低值<0.4 μg/L或PSAD>12.6个月,则系统性复发率更令人满意[23]。由于随访时间较短,两组患者长期的生存资料还需要后续随访完善,但是作为一种受到广泛认可的预测因素,两种治疗方案的PSA动力学在本研究中也没有观察到差异,在后续的随访中我们也将对患者生存情况与PSA动力学的关系进行观察。
本研究中,我们回顾对比了我中心诊治的中/低危前列腺癌患者的临床基线资料及治疗后PSA动力学和生存资料,结果显示,在患者的生存预后(OS及DFS)和PSA动力学方面,RP+ADT和BT+ADT两种治疗方式并无显著性差异。BT具有微创、并发症少的优势,BT+ADT可以作为高龄、无法主动监测或不宜行前列腺根治性切除患者的治疗选择。