浅谈矛盾的辩证原理在离子极化理论教学中的应用
王红艳,王凯,焦桓,刘志宏,*
1陕西师范大学化学化工学院,西安 710119
2中国人民解放军空军勤务学院科研处,江苏 徐州 221000
大学教育注重培养学生的科学思维,旨在教学实践过程中,通过构建系统的知识框架,渗透科学的学习方法,帮助学生完善自学能力。对于化学专业的本科生,无机化学是他们进入大学接触的第一门专业基础课,承载着帮助学生转变思维、适应大学教育的重要职责。然而,习惯于传统应试教育的大一新生,虽有着强烈的学习动力与目标,以及对大学生活的憧憬与规划,但对于较快的教学节奏有诸多不适。尤其是一些抽象的概念与理论容易导致思考难、理解难及巩固难等问题,往往让学生认为无机化学冗杂、无序、没有规律,厌学情绪油然而生。因此,如何将高中阶段的教学方法与大学教学模式相互渗透衔接,在潜移默化中加深学生对抽象化学理论的认知与理解,进而熟练掌握与应用,最终养成自主学习的习惯是无机化学教师不断研究、探索与实践的课题[1]。
高中教学中,教师常采用对立统一的矛盾辩证规律解释某些化学现象,起到了良好的效果[2]。例如判断酸式盐如NaHSO3溶液酸碱性问题时,可将盐的解离与水解视为矛盾,比较解离与水解平衡常数不难发现前者大于后者,电离产生H+是主要矛盾,因此NaHSO3呈酸性。然而,NaHCO3溶液显碱性是由于水解转化为主要矛盾所致。可见,将矛盾分析法渗透到教学过程中,不仅可教会学生学习化学的本质,还可培养学生思维的灵活性与科学性。
根据辩证唯物主义的观点:矛盾分析法主要包括把矛盾一分为二的观点、矛盾的普遍性与特殊性观点、具体矛盾问题具体分析观点和矛盾“两点论”与“重点论”相统一的观点[3,4]。矛盾存在于一切事物中,化学也不例外。纵观无机化学的发展史和整个内容,充满着各种矛盾[5]。例如:弱电解质溶液中存在着电离与结合的矛盾,难溶物质存在沉淀与解离的矛盾,化学反应存在旧键断裂与新键形成以及吸收能量与放出能量的矛盾等等。近年来,针对大一学生,我们将矛盾分析方法渗透在抽象概念与理论的教学过程中,对促使学生建立系统、全面和创新的学习方法与科学思维起到了显著效果。下面以离子极化作用的教学过程为例,讨论与总结我们在无机化学课程教学中运用矛盾的辩证原理对该概念实施教学措施的一些认识和体会(图1)。

图1 矛盾辩证原理在离子极化中的应用
1 离子极化的定义、发展及影响因素——认识矛盾的两个对立面是利用矛盾辩证法的基础
早期人们在研究离子化合物性质时,发现一些与经典离子键理论相悖的事实。作为离子键理论的重要补充,波兰化学家 Fajans于 1923年首次提出了离子极化理论。他认为离子相互作用时能引起离子外层电子云的变形:阴离子在阳离子的电场中电子云会发生收缩,阳离子在阴离子电场中电子云会发生膨胀。这种离子在外电场中的变形称为离子极化。他认为影响极化的因素有两点:1)起极化作用离子的极化能力;2)被极化离子的可变形性。同时将有利于极化的三种条件:正离子半径小;负离子半径大;离子的电荷数大总结为“法扬斯规则”[6]。
现今离子极化理论逐步完善,现行使用教材将离子极化表述为:“离子自身电场的作用使周围其他离子的正、负电荷重心不重合,产生诱导偶极的过程。”“阳离子带正电荷,半径一般较小,它对相邻的阴离子起到诱导作用。因此,阳离子的主要作用是极化周围的阴离子。”“离子极化的强弱决定于该离子对周围离子施加的电场强度。”“离子极化可使异电荷离子的电子云变形。阴离子半径一般较大,外层有较多的电子,容易变形,在诱导过程中产生临时的诱导偶极,因此离子的变形性主要指阴离子[7]。”离子极化的结果使电子云发生强烈的变形,阴阳离子之间部分电子云密度重叠,引起离子化合物中离子键成分减少,共价性增加,从而产生一定的结构效应,导致同族或同周期化合物的溶解度、熔沸点、颜色、晶型和热稳定性等产生系列变化或显著差异。
此外,教材总结了阳离子极化力强弱与其结构之间的关系[7]:
(1)电荷:阳离子电荷越高,极化力越强;
(2)半径:电荷数相等,价电子结构等相同的离子,半径越小,极化力越强;
(3)电子层结构不同的阳离子,极化力顺序为:18e,2e,18+2e>9-17e>8e;
同时,离子变形性也与离子结构密切相关:
(1)价电子层结构相同的离子,随着负电荷数目的减小和正电荷数目的增加,变形性减小;
(2)价电子层结构相同的离子,电子层越多,离子半径越大,变形性越大;
(3)18e和9-17e电子构型的离子,其变形性比半径相近、电荷数相同的8电子构型离子大得多;
(4)复杂阴离子的变形性不大,而且复杂阴离子中心离子氧化数越高,变形性越小。
这些描述看似清晰明确,但对大一学生来说过于抽象。学生经常会有疑问:既然阳离子是极化的主要原因,是不是就不用关注阴离子,那为什么又提阴离子变形性;是不是阳离子只极化不变形,阴离子只变形不极化;极化和变形是什么关系等等,这些问题常常困扰学生,引发教学难度。我们尝试利用矛盾分析法剖析离子极化理论,找出此概念中矛盾的两个方面。离子极化可理解为:排列在离子晶体晶格中的阴阳离子可相互为对方提供电场,离子在电场中导致自身原子核与电子云发生相对位移,产生诱导偶极,发生了与分子极化类似的离子极化作用。离子产生电场使周围异电荷离子受到极化而发生变形的能力称为该离子的极化力,离子作为被极化对象被异电荷离子极化而发生电子云变形的性质称为该离子的变形性。同种性质的离子电荷越集中,半径越小,极化力越强,不容易变形;反之则极化力弱,更容易变形。因此,极化和变形互为矛盾,两者相互对立又相互依存。阴阳离子均可极化和变形,只是阳离子极化能力强,阴离子变形性强。极化是变形的原因,变形是极化的结果,变形抵消和平衡极化,极化引起的变形也可反过来影响极化。
2 阳离子的极化力与阴离子的变形性——离子极化作用中的主要矛盾
认识离子极化中矛盾的两个方面——极化与变形,这为利用矛盾分析法发现问题、分析问题和解决问题提供了前提。那为什么阳离子的极化能力强,阴离子的变形能力强?早期Fajans提出的极化理论只是一种定性的规则,随后,国内外不少科学家试图通过建立定量关系,准确比较和评估极化理论,特别是我国温元凯等人经过十几年离子极化理论的定量研究工作,初步建立起离子极化的定量与半定量理论[8]。虽然这些理论在基础无机化学中没有推广,也具有一定的局限性,但对于学生理解极化理论却大有裨益。离子极化可用偶极距和极化力衡量。偶极矩是极化率与电场强度的乘积,代表着离子的变形。极化力与离子势(离子电荷数平方与半径的比值)成正比。表 1列出了利用普遍采用的晶体折射度求得的离子极化率的平均值,不难发现,阳离子的极化率普遍较小,而阴离子的极化率较大,即阴离子的变形性大。而阴离子半径较大使得其离子势较之价态相同的阳离子小很多[9]。因此,极化力主要与阳离子有关,变形性主要由阴离子体现。
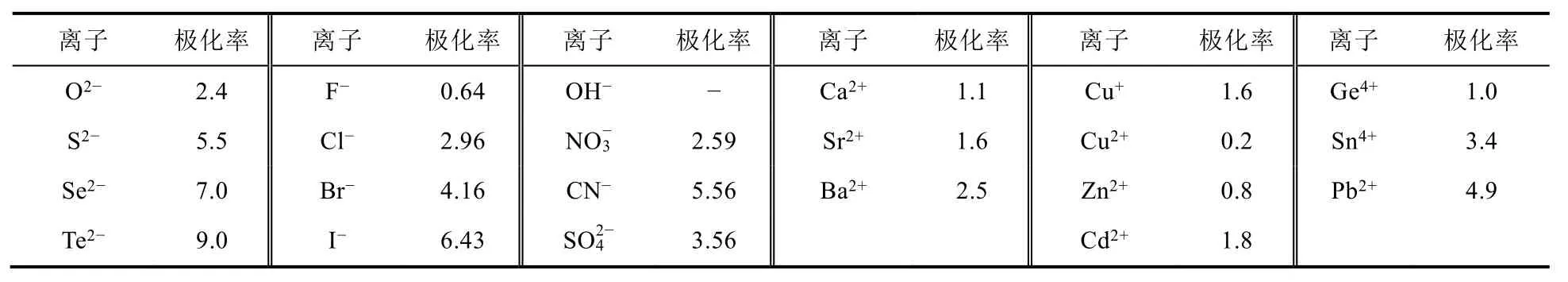
表1 离子的极化率(×106 pm3)[9]
唯物辩证法认为:在复杂事物的发展过程中有许多矛盾同时存在,其中必有一种是主要矛盾,它的存在决定和发展、规定或影响着事物复杂矛盾体系中其他矛盾的存在和发展,而非主要矛盾则处于从属的、对事物发展不起决定作用的地位,即所谓的次要矛盾[3]。离子极化运动中的主要矛盾是阳离子的极化与阴离子的变形之间的竞争、对弈与统一。由于离子极化的结果是离子键中离子性成分的缺失,温元凯等[8]将离子晶体的晶格能与纯离子模型晶格能之间的差值定义为离子极化能。通过研究多种非标准离子晶体的极化能发现:同种阳离子盐的离子极化能与阴离子的极化率成正比,同种阴离子盐的离子极化能与阳离子的极化力成正比。表2是卤化银的晶格能,可以看到,玻恩-哈伯循环确定的晶格能实验值系统大于理论计算值,这表明在离子晶格中有明显的共价键能的贡献,共价成分越多,玻恩-哈伯热化学循环计算所得的晶格能的实验值与理论计算值之差也就越大[10]。这是极化作用依次增强的直接证据。
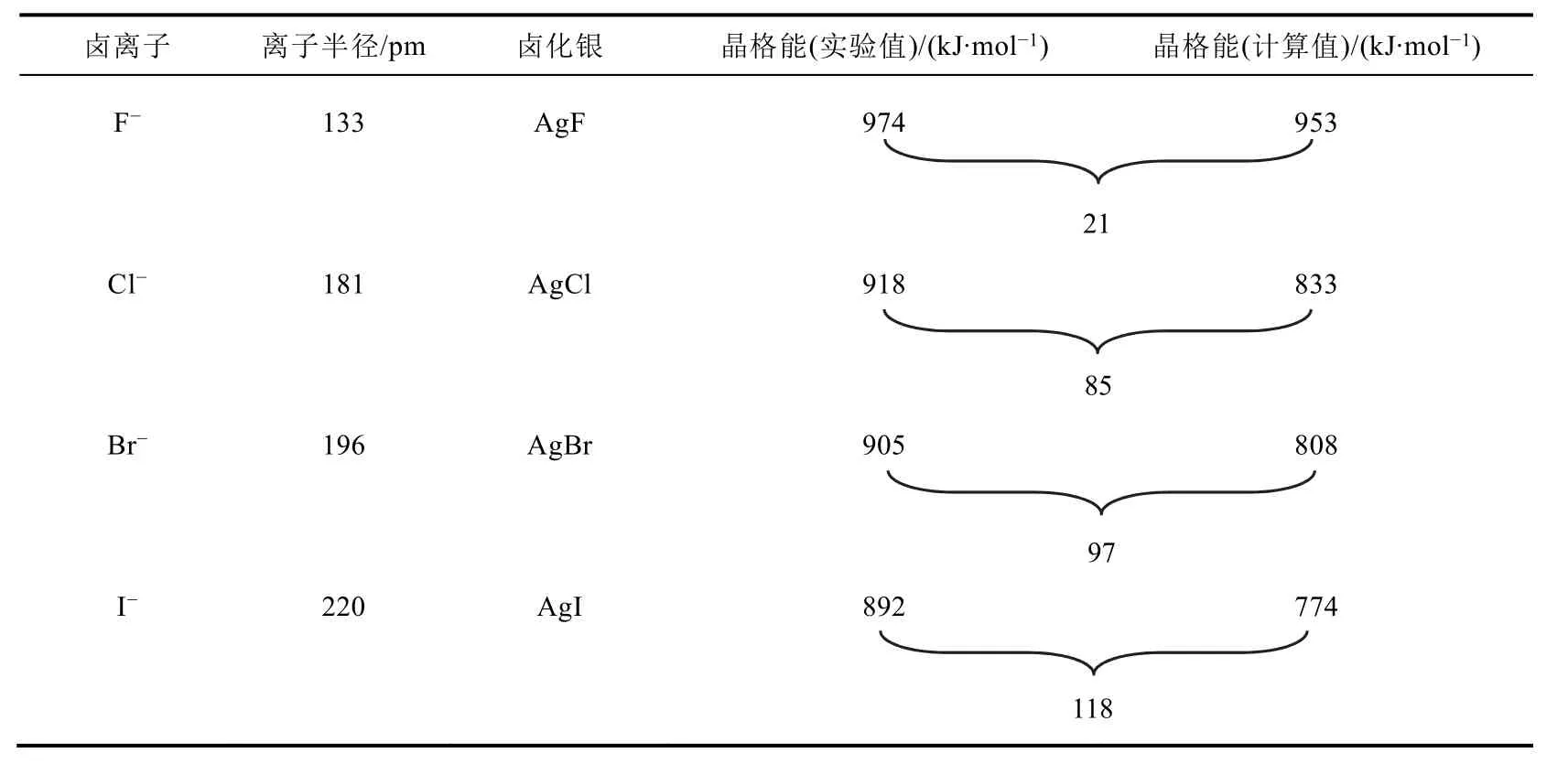
表2 卤化银的晶格能[10]
3 离子极化的本质是核电荷吸引——抓住主要矛盾的主要方面
辩证唯物主义观点认为:事物的性质主要取决于取得支配地位矛盾的主要方面,因此找出阳离子极化与阴离子变形这一主要矛盾的主要方面,许多问题便可迎刃而解。阳离子对阴离子的核电荷吸引是引起阴离子感应偶极的产生导致离子极化的原因。因此,阳离子的电荷和半径是影响矛盾的主要方面,阳离子电荷越高,半径越小,极化力越强。当阳离子相同时,阴离子的变形性是离子极化作用矛盾的主要方面。负电荷数、离子半径,以及复杂阴离子的中心氧化数均对阴离子的极化率产生影响,进而影响阴离子的变形性。
典型举例1:利用离子极化解释熔沸点变化规律。
离子晶体的熔化或气化可认为是克服离子间静电引力的过程。一般而言,离子半径越小,电荷数越高,离子晶体的熔沸点越高。然而,NaCl、MgCl2和AlCl3的熔沸点却依次降低。这一现象可用离子极化加以解释。由于第二周期主族元素的阳离子从左至右随核电荷数的增加半径依次减小,而电荷依次升高,因此离子极化作用增强,化学键离子性成分降低,晶格能的降低,导致化合物熔沸点下降。同理,碱土金属离子从上到下离子半径逐渐增大,阳离子极化力减弱,化学键离子性成分逐渐增多,晶格能增大,导致熔点升高(表3)。

表3 碱土金属氯化物的熔点[11]
典型举例2:利用离子极化解释相同元素同价态Co(II)氢氧化物、氧化物及硫化物颜色的变化规律。
S2-半径最大,负电荷最高,变形性最大;OH-与O2-具有相近的离子半径,负电荷较高的O2-变形性较强,因此Co(OH)2、CoO、CoS随阴离子极化率的增加,极化作用逐渐增强,导致颜色逐渐加深(表4)。
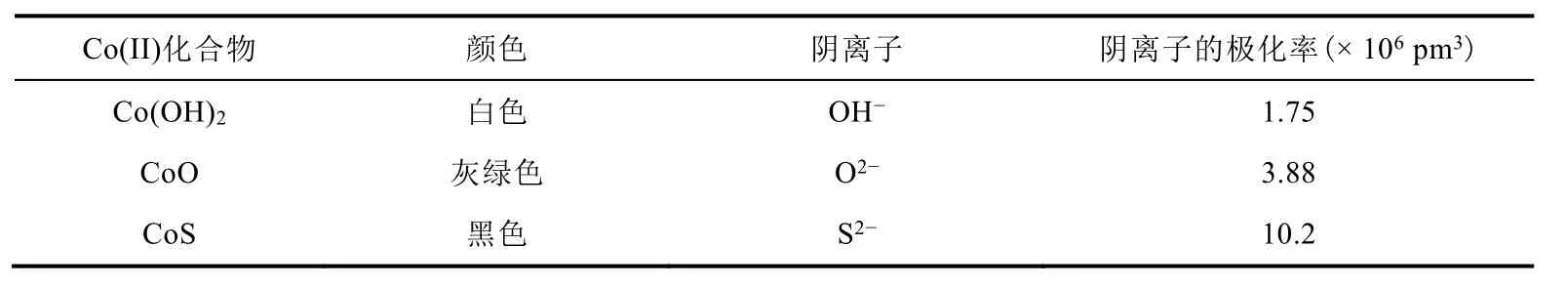
表4 Co(II)化合物的颜色和极化率[12]
可见,抓住了离子极化中的主要矛盾以及主要矛盾的主要方面,一些问题便可迎刃而解。
4 离子极化作用中矛盾及其矛盾主次方面的转化
对于简单离子化合物,阳离子电荷与半径或者说是离子势可认知为影响极化作用的主要矛盾的主要方面,然而在解释一些具有多层电子、且半径较大的过渡金属离子化合物的相关性质规律时,仅考虑离子势往往会遇到困难。如AgCl和NaCl均为6配位的NaCl晶型,且阳离子具有相同的电荷数,离子半径也相差不多(Ag+半径为 115 pm,Na+为 102 pm)[7],二者具有相近的离子势,然而AgCl的熔点为455 °C,NaCl的熔点却高达800.7 °C。如何理解?
矛盾分析法认为凡是矛盾,必有斗争,一切主要矛盾与次要矛盾、主要矛盾的主要方面与次要方面均互相作用、互相斗争、互相制约,在一定条件下亦互易其位、互相转化[3]。从极化定义可知,极化主要是极化离子的原子核对被极化离子电子的吸引所产生的形变。由于离子自身电子的屏蔽作用削弱了原子核对电子的吸引,因此离子极化的本质应修正为有效核电荷对电子的吸引。有效核电荷与电子结构密切相关,应考虑自身电子的屏蔽常数。过渡金属以及长周期的p区元素,其阳离子的d电子更加裸露,屏蔽能力弱,具有更高的有效核电荷,导致极化能力增强。因此,对于具有18e、18+2e以及9-17e电子构型的阳离子,应将电子构型转化为矛盾的主要方面。Ag+属于18e构型,其极化能力较之8e构型的Na+更强,导致AgCl中化学键的共价性成分升高,熔点较低。
5 附加极化——矛盾的对立统一
前面提到,由于阳离子的变形性小,一般只考虑阳离子对阴离子的极化,而不考虑其变形对极化作用的影响。然而,对具有18e、18+2e、9-17e电子构型且半径较大的阳离子,因变形性的增加,削弱极化的变形又会转化为促进极化的积极因素。此类阳离子除了保持对阴离子的极化之外,其自身的变形也增强了阴离子对阳离子极化的能力,产生了阴阳离子间的相互极化。这种由阳离子变形性引起的极化增强现象称为附加极化。可见,附加极化是极化与变形两个矛盾的对立面相互统一的结果。同族阳离子半径越大,附加极化作用递增,同时阴离子变形性越大,附加极化作用也越强。
典型举例3:解释ZnI2的熔点为何大于CdI2。
Zn2+与Cd2+同属于第IIB族元素,具有相同的18e电子构型,后者离子半径较大,变形性增加,与I-作用时,产生了较强的附加极化作用,因此CdI2中共价性成分增大,导致熔点较低。
6 反极化作用——矛盾的复杂性

图2 HNO3分子中存在的反极化作用
7 离子极化的局限性——矛盾的普遍性与特殊性
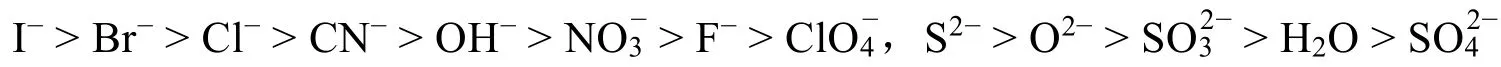
8 结语
我们将矛盾分析方法充分合理地渗透在离子极化教学过程中,坚持“两点论”,帮助学生分析了解矛盾的两个方面,坚持“重点论”,帮助学生把握主要矛盾和矛盾的主要方面以及主次矛盾、主要矛盾主次方面的互相转换,并结合“两点论”和“重点论”的统一列举实例解决实际问题,同时关注矛盾的普遍性与特殊性以及复杂性教会学生分析具体问题。实践表明,矛盾辩证原理的应用可有效梳理离子极化的原理及其影响因素,成功化解知识点难度与学生理解之间存在差异的问题,有助于学生对知识点的理解与应用。作为马克思主义哲学的重要组成部分,矛盾分析方法不仅有利于培养学生的归纳能力及科学思维,更重要的是帮助学生树立实事求是、具体问题具体分析的科学思政观。矛盾辩证原理作为哲学原理,具有普遍意义,除适用于离子极化理论外,在讲授酸式盐酸碱性、化学平衡、同离子效应、第二周期多电子元素电子亲和能及其原子间形成的共价单键键能较小等问题时也具有重要应用价值,我们将在今后的教学过程中不断实践,让学生体会化学知识的系统性以及能力培养的重要性。

