lnc1343对小鼠胚胎干细胞多能性的影响及其基因座潜在作用机制
陈绍恢, 苏光松, 陈 军, 吕万革
(南开大学生命科学学院, 天津 300071)
小鼠胚胎干细胞(embryonic stem cell, ESC) 是20世纪80年代首次从小鼠囊胚期内细胞团(inner cell mass)分离得到,具有在体外保持不分化的无限增殖能力;在胎鼠或成鼠体内胚胎干细胞可以分化形成各种细胞类型;在合适的培养条件下,胚胎干细胞可以定向诱导分化形成多种细胞类型[1-2].正是由于胚胎干细胞这种具有在体外培养下保持未分化状态的增殖能力及分化为多种细胞类型的潜能,使之成为一种研究哺乳动物细胞分化、组织形成过程的基本体系,以及临床移植治疗的新的细胞来源.ESC在发育生物学研究、药物发现以及细胞移植治疗等方面都有着巨大的应用价值.三个关键转录因子—Nanog、Oct4和Sox2,形成了一个核心的调控环路,以维持 ESC 的多能性[3-6].
对基因组、转录组及表观遗传组等测序数据的研究发现哺乳动物基因组中编码蛋白质的区域只占基因组区域的1%~2%,大量的区域不编码产生蛋白质,但会转录产生RNA分子,其中一类长度大于200 nt的RNA分子称为长非编码RNA(long non-coding RNA, lncRNA)[7].lncRNA在真核生物基因组中广泛转录,并且能够在多种层次以灵活的方式对基因表达进行调控.越来越多的证据表明,lncRNA在维持ESC自我更新和多能性中发挥了重要的作用.核定位的lncRNA可以通过结合或者靶定特异性的染色质修饰因子、抑或作为支架结构来调节基因的转录,而质定位的lncRNA可以与microRNA相互作用来调节ESC的多能性,如lncRNA可以作为海绵体(Sponge)的结构吸附或者与某些microRNA相互结合从而干扰microRNA的功能来调节蛋白质的翻译,进而调节ESC的多能性[8-11].lnc1343基因定位于小鼠4号染色体,基因全长1 699 bp,在基因组中可以通过反向DNA链转录出一条437 nt的lncRNA(即lnc1343),而且lnc1343不仅定位于细胞核,在细胞质中也有分布[12-13].近些年来,越来越多的研究表明lnc1343通过影响细胞的增殖和迁移等在许多恶性肿瘤的发病过程中发挥了重要作用,而且lnc1343还可以作为肿瘤恶性程度和预后不良的生物标志物[14-17].此外,Guttman等通过shRNA筛选并通过与全基因组微阵列杂交的方式鉴定了26条与小鼠ESC多能性相关的lncRNA,而lnc1343即为这26条之一,表明了lnc1343在小鼠ESC多能性维持中有可能发挥了重要功能,但是其具体的机制尚不是很清楚[11].
在本研究中,利用CRISPR-cas9敲除技术,发现lnc1343敲除细胞系中Nanog、Sox2和Oct4等多能性因子的表达水平显著降低.此外,在小鼠ESC中过表达lnc1343,发现小鼠ESC中Nanog、Sox2和Oct4等多能性因子表达水平显著升高,表明lnc1343对于小鼠ESC的多能性维持发挥了重要的作用.而且,本实验还发现lnc1343可以调节邻近基因Rcc1(regulator of chromosome condensation 1)的表达,进一步通过Chip-seq分析发现lnc1343以及邻近区域富含增强子样的序列.最后,本实验利用Capture-C实验发现,lnc1343基因座与多个不同基因的启动子序列具有相互作用,表明lnc1343基因位点可以通过染色质长距离相互作用来调节基因的表达.综上所述,lnc1343不仅可以通过转录来调节ESC的多能性,还可以通过其基因座位点远距离相互作用来调节基因的表达.
1 材料与方法
1.1 细胞培养
小鼠E14细胞系培养于常规干细胞培养基中,其中培养基成分如下:DMEM (C11995500BT, Gibco)、15%胎牛血清(Fetal Bovine Serum, FBS500-S, AusGeneX, Australia)、100 μmol·L-1非必需氨基酸(non-essential amino acids, NEAA)、5 000 U·mL-1双抗(penicillin/streptomycin, 15140-122, Gibco)、2 mmol·L-1L-谷氨酰胺(2503081, Gibco)、0.1 mmol·L-1β-巯基乙醇(M3148, Sigma, USA)、1000 U·mL-1LIF (ESG1107, Millipore).细胞培养箱(INCO153, Memmert, Germany)温度恒定在37 ℃,CO2体积分数恒定为5%,湿度恒定为95%.
1.2 两种lnc1343敲除细胞系和过表达细胞系的构建
1.2.1 lnc1343基因座敲除细胞系的构建 如图1A所示,在lnc1343基因座两端各设计一个sgRNA,合成后连接到pX330质粒载体中.利用转染试剂Lipofectamine 3000 (L3000015, Thermo Scientific, USA)将含有sgRNA的质粒载体转入培养的E14细胞中(WT细胞中转染对应的空载体质粒用于对照组),24 h后加入1 μg·mL-1嘌呤霉素,继续培养2 d,然后将剩余的细胞收集后重新转入10 cm的培养皿中继续培养5 d.待克隆生长到合适大小后,挑取单克隆细胞到24孔板中继续培养.待细胞长满后,收取部分细胞进行RT-qPCR和DNA扩增跑胶进行鉴定并挑选出敲除的克隆.
1.2.2 lnc1343转录起始位点(transcription start site, TSS)敲除细胞系的构建 如图1B所示,在lnc1343基因TSS两端再次设计两个sgRNA,为了尽可能不干扰lnc1343基因座的功能,两个sgRNA之间的片段要尽可能短一些.设计完成后按照1.2.1所述的方法进行细胞转染并筛选获得敲除的克隆.
1.2.3 lnc1343过表达细胞系的构建pCAGIPuro 为了构建lnc1343过表达细胞系,在lnc1343 cDNA两端设计两条合适的引物(Forward primer:GACTTCCGGGCGTTACTTAAG; Reverse primer: AGACATTCAAATGCTTTAATTC),利用cDNA为模板体外转录lnc1343 cDNA序列,经测序比对无误的体外转录产物连接到pCAGIPuro质粒载体中.利用转染试剂Lipofectamine 3000将构建好的质粒转染到E14细胞中(WT细胞中转染对应的空载体质粒用于对照组),24 h后,加入1 μg·mL-1嘌呤霉素,继续培养5 d左右,收集部分细胞进行总RNA提取和RT-qPCR检测来验证是否成功构建过表达细胞系.
1.3 RNA 提取、反转录及 RT-qPCR
RNA的提取采用TRIzol抽提法,方法简述如下:收集细胞后,用PBS清洗一遍,加入1mL TRIzol试剂(207002, Ambion),充分混匀后,加入200 μL氯仿(288306, Sigma, USA)后剧烈晃动30 s以上,室温静置5 min,利用离心机(5424R/5424, Eppendorf, Germany)在12 000 ×g 4℃条件下离心15 min,吸取400 μL上清并加入等量异丙醇(500 mL,科密欧,中国),混匀后室温静置10 min,12 000 ×g、4 ℃离心15 min,弃上清,加入1 mL 75%乙醇(500 mL,科密欧,中国)清洗一遍,7 500×g 4 ℃离心5 min,弃去乙醇,待自然晾干后加入适量的RNasefree的水(69182, Millipore, USA),混匀后放入-80 ℃冰箱(MDF-U54V, Panasonic, Japan)保存备用.
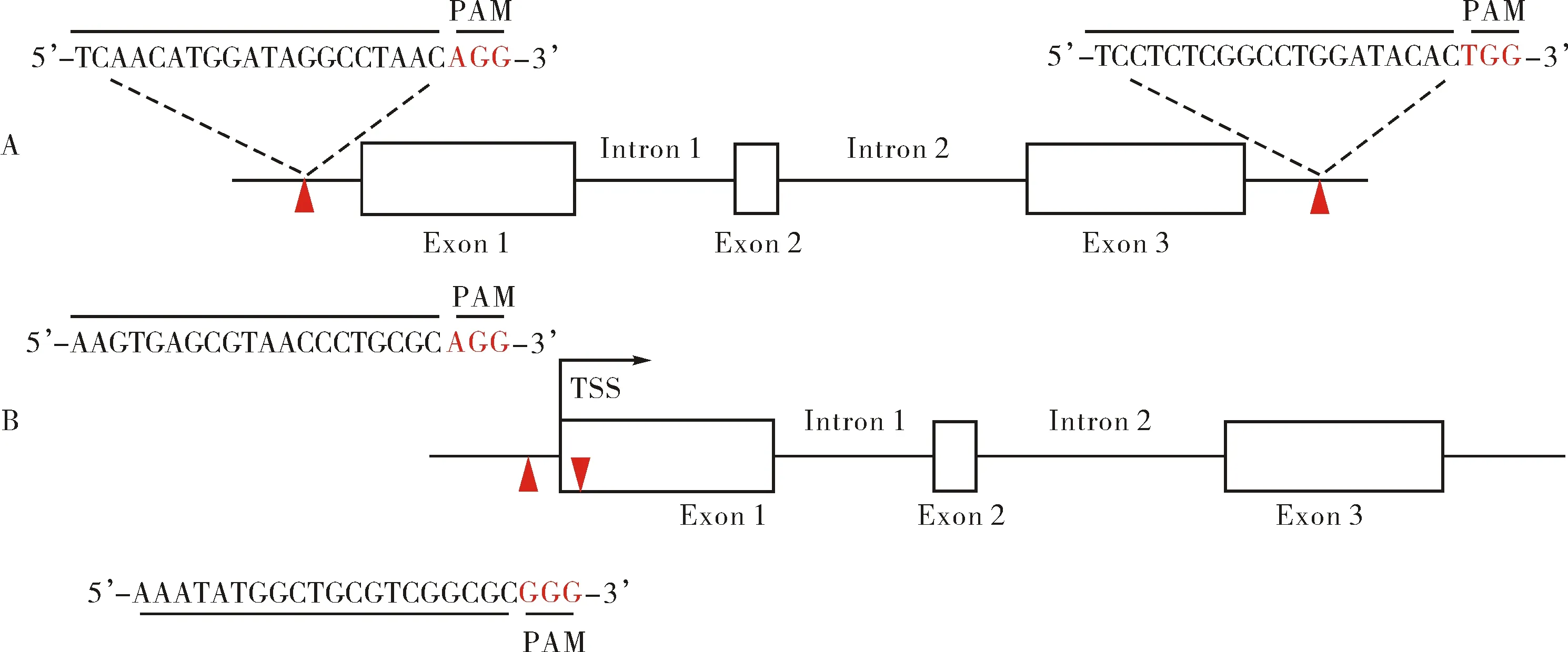
A) lnc1343基因座敲除细胞系的构建;B) lnc1343基因TSS敲除细胞系的构建;A) Construction of gene locus knockout for lnc1343; B) Construction of TSS knockout for lnc1343; 图1 两种lnc1343敲除细胞系构建Fig.1 Construction of lnc1343 homozygous knockout cell lines
取出提取完毕的RNA,利用试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser,RR047A, TaKaRa, Japan)进行反转录,反转录方法严格按照试剂盒的要求进行.RNA 反转录后,加入试剂盒[FastStart Universal SYBR Green Master (Rox),Roche, 4913850001, USA]配制好的Mix混匀离心,并加入到 96 孔板中,用配套膜覆盖孔板后离心,放至 qPCR仪(CFX Manager 3.1 System, Bio-Rad, USA)中进行反应,其中反应程序为:95 ℃预变性 5 min,进入循环反应,即 95 ℃变性15 s,60 ℃退火和延伸共计30 s,共循环35次,循环结束后随即进入熔解曲线程序,此程序根据仪器默认程序即可.程序全部运行完成后对数据进行以下处理即得到目的基因的相对表达量:
△Ct(test)=Ct(target, test)-Ct(reference, test),
△Ct(calibrator)=Ct(target, calibrator)-Ct(reference, calibrator),
△△Ct=△Ct(test)-△Ct(calibrator),
目的基因的相对表达量=2-△△Ct.
1.4 Western Blot
收集适量的细胞,加入适量的裂解液(P0013B,碧云天,中国),并根据裂解液的量加入适量的蛋白酶抑制剂(Protease Inhibitor Cocktail Set Ⅲ, Millipore),用移液枪吹打直至看不见细胞沉淀,将样品放在冰上,每隔10 min用Vortex(Vortex-6,海门市其林贝尔仪器制造有限公司,中国)震荡10 s左右,重复3~5次,震荡完毕后,将样品放入预冷后的非接触式超声破碎仪(B01060010, Diagenode, Belgium)超声5个循环,4 ℃条件下12 000 ×g离心10 min,吸取全部上清转移至新的预冷EP管中,利用试剂盒(P0010S,碧云天,中国)测定所有样品的蛋白浓度.在测完浓度后的蛋白样品中加入适量的5×Loading Buffer,95 ℃金属浴(DTH-100,上海百典仪器设备有限公司,中国)中变性处理10 min,然后按照测定的蛋白浓度加入到配制好的胶块(按照试剂盒来配制,20325ES62,上海翊圣生物科技有限公司,中国),电泳仪(PowerPacTMUniversal, Bio-Rad, USA)先用70 V电压开始电泳,待蛋白Marker(26616, Thermo Scientific, USA)进入分离胶并开始出现条带分离后,将电压调至120 V继续电泳,直至蛋白样品孔中的蓝色条带接近胶板边缘后停止电泳.整理取出的胶块,进行转膜操作,转膜完毕后取出PVDF膜(88520, Thermo Scientific, USA),放入盛有5%的脱脂牛奶封闭液中,用水平摇床(TY-80A/SA,华城润华,中国)室温封闭1h.封闭完成后将膜和稀释好的抗体(Antibody-Nanog, sc-293121, Antibody-Sox2, sc-365964, Antibody-Oct4, sc-5279, SantaCruz, USA, Antibody-β-Actin, P30002, Abmart, USA)封在塑料薄膜中,4 ℃下过夜.第二天用TBST连续洗膜5次,每次10 min,孵育二抗(Goat anti-Mouse IgG-HRP, LK2003; Goat anti-Mouse IgG-HRP, LK2001, 天津三箭生物技术有限公司,中国,室温,2 h),完毕后再次连续洗膜5次,每次10 min.洗膜完毕后,配制适量的HRP-底物显色液(WBKLS0500, Millipore, USA),利用化学发光成像系统(Tanon-5200,上海天能科技有限公司,中国)进行蛋白条带图像采集.
1.5 Capture C
Capture C实验和分析方法主要参考Davies等的方法[18].具体方法简述如下:收集足够量的细胞并用甲醛固定,加入适量的限制性内切酶Dpn Ⅱ进行充分消化,待检测消化样品合格后加入DNA连接酶进行连接;连接完成后,60 ℃过夜去交联并提取DNA,将提取合格的DNA样品进行超声处理,构建3C文库(DNA长度约为200 bp),将构建完毕的3C文库加入测序接头和引物,并利用磁珠进行纯化,并利用加入的引物进行扩增,获得足够的测序样品,最后交给华大基因进行测序和分析.
1.6 统计学方法
本实验均采用GraphPad Prism 7.0软件进行统计分析,数据用Mean±SEM来表示,并利用单因素方差分析来进行统计分析,P<0.05为差异具有统计学意义,P<0.01为差异具有显著性统计学意义.
2 结果与分析
2.1 lnc1343基因座敲除对小鼠ESC多能性的影响
如图2A、B所示,利用CRISPR-cas9基因编辑技术,本研究得到了两个lnc1343基因座敲除细胞系(Clone 1#和Clone 2#).通过RT-qPCR检测lnc1343的表达,发现两个双敲细胞系中lnc1343的相对表达量极低(图2A),而且在lnc1343基因座敲除内部设计引物(Forward:5′-ggcaagcttttctgcctact-3′;Reverse:5′-ccccatcactgagggtcttaac-3′)进行PCR扩增验证,发现两个敲除细胞系中不能扩增出条带(图2B),表明两个细胞系中lnc1343已经被成功敲除.为了验证lnc1343敲除后对小鼠ESC多能性维持的影响,本研究利用RT-qPCR检测了多能性维持的标志物(Nanog、Sox2和Oct4)的mRNA相对表达量,发现lnc1343敲除后Nanog、Sox2和Oct4的相对表达量均有所下降,且差异具有显著统计学意义(图2C),表明lnc1343敲除后小鼠ESC的多能性出现了显著的下降.进一步利用westernblot检测多能因子在蛋白水平的变化,结果发现lnc1343敲除后,Nanog、Sox2和Oct4的蛋白水平也出现了下降,这与其mRNA的表达变化一致 (图2D).综上所述,lnc1343的敲除破坏了小鼠ESC的多能性维持.
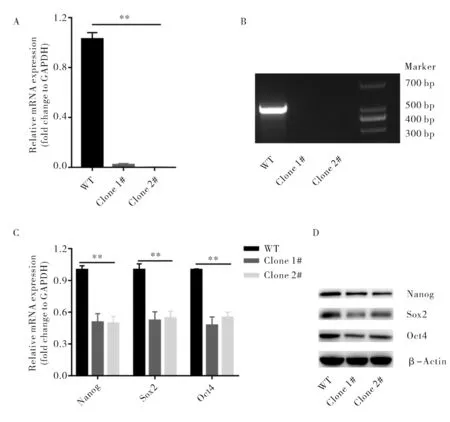
A.不同组中lnc1343的相对表达量; B.lnc1343基因敲除的验证; C.不同组中多能因子的相对表达量; D.不同组中多能因子的蛋白水平变化A.The relative expression of lnc1343 in different groups; B.Verification of deletion of lnc1343; C.The relative expression of pluripotency makers in different groups; D.The protein level of pluripotency markers in different groups图2 lnc1343敲除对小鼠ESC多能性维持的影响Fig.2 The effect of deletion of lnc1343 on mouse ESC
2.2 lnc1343基因座敲除对小鼠ESC分化的影响
为了验证lnc1343对小鼠ESC分化的影响,本研究继续利用单层贴壁分化模型[19]来探究,结果表明,基因座敲除细胞在去除白细胞抑制因子LIF的分化培养基中培养2 d后,相较于WT细胞来说,敲除细胞分化后的克隆呈现出更加不规则的单层扁平形状(图3A),这表明lnc1343基因座敲除后加快了细胞的分化进程.进一步通过RT-qPCR检测不同组分化标志物的表达,结果显示lnc1343基因座敲除后不同胚层分化标志物的相对表达量均有所上升,且差异具有显著统计学意义(图3B),再次表明lnc1343基因座敲除后确实加快了ESC的分化进程.
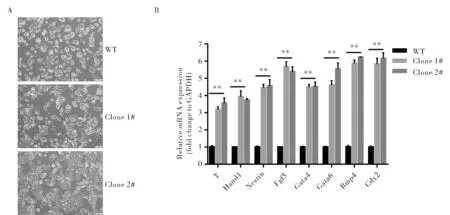
A.不同组细胞在分化培养基培养2 d的图像,比例尺为50 μm;B.不同组中分化标志物的相对表达量A.Representative images of different group cultured 2 days in indicated differentiation media. Scale bar, 50 μm; B.The relative expression of differential makers in different groups图3 lnc1343基因座敲除对小鼠ESC多能性维持的影响Fig.3 The effect of DNA locus deletion of lnc1343 on mouse ESC
2.3 lnc1343 TSS敲除对小鼠ESC多能性的影响
为了进一步验证lnc1343 RNA对于小鼠ESC多能性的影响,本研究利用CRISPR-cas9基因编辑技术,在lnc1343 TSS设计两个sgRNA位点,经转染筛选后得到了两个lnc1343 TSS敲除细胞系(Clone 3#和Clone 4#),通过RT-qPCR检测lnc1343的表达,结果显示这两个TSS敲除细胞系中lnc1343的表达量不足10%(图4A),在lnc1343 TSS敲除两端设计引物:Forward: gctaagaccgccaacacctt;Reverse:ctggaaggcggctaacactt,进行PCR扩增验证,结果显示两个敲除细胞系中均被敲除了部分序列(图4B).为了验证lnc1343 TSS敲除对于小鼠ESC多能性维持的影响,本研究利用RT-qPCR检测了多能性维持的标志物的相对表达量,结果显示lnc1343 TSS敲除后Nanog、Sox2和Oct4的相对表达量均有所下降,且差异具有显著统计学意义(图4C),表明lnc1343 TSS敲除后小鼠ESC的多能性出现了显著的下降.利用western blot检测多能因子在蛋白水平的变化,结果发现lnc1343敲除后,多能因子蛋白水平同样出现了下降,这与其mRNA的表达变化一致 (图4D).综上所述,lnc1343的TSS敲除也破坏了小鼠ESC的多能性维持.
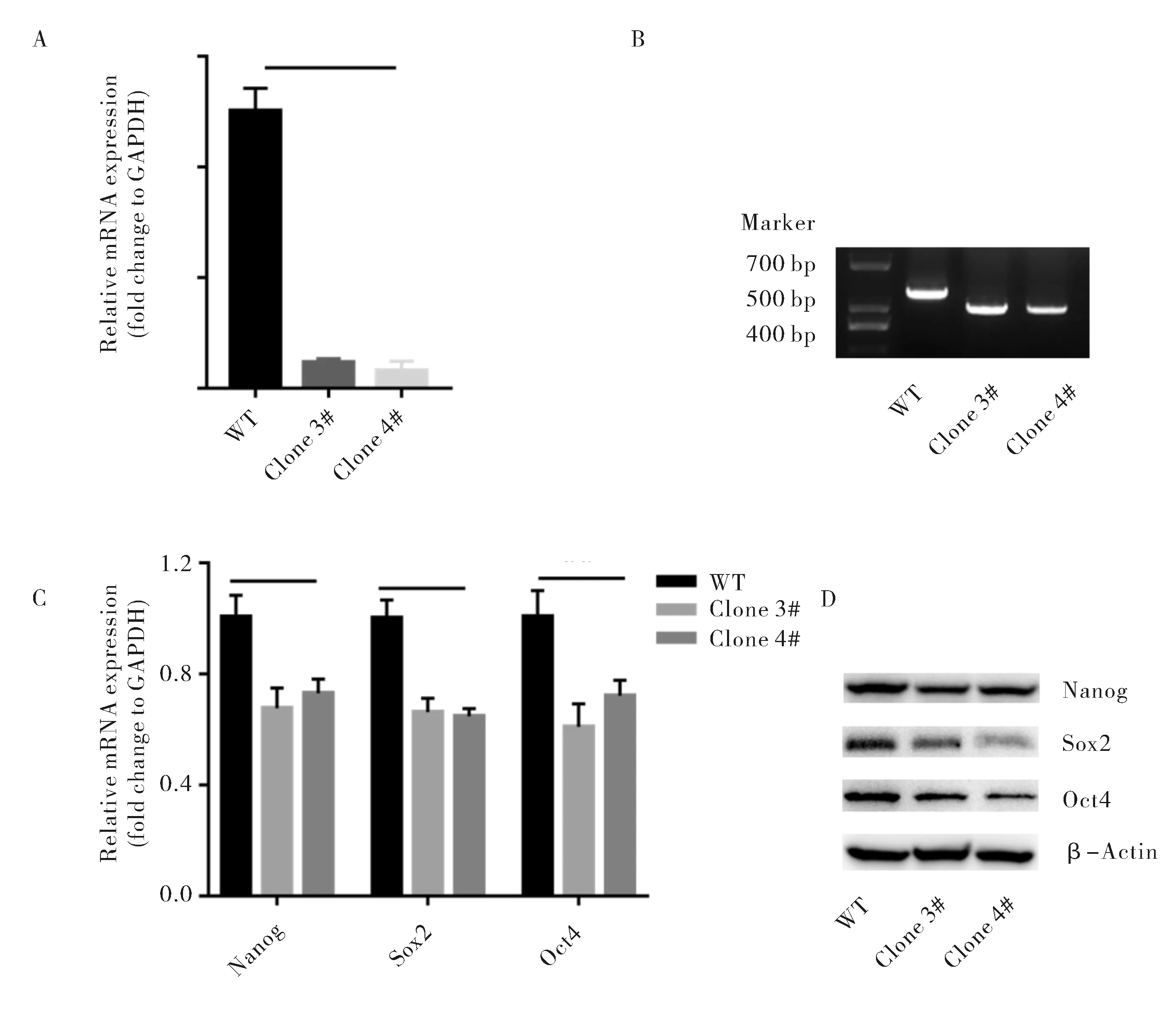
A.不同组中lnc1343的相对表达量;B.lnc1343 TSS敲除的验证;C.不同组中多能因子的相对表达量;D.不同组中多能因子的蛋白水平变化A.Relative expression of lnc1343 in different groups; B.Verification of the TSS deletion of lnc1343; C.Relative expression of pluripotency makers in different groups; D.Protein level of pluripotency markers in different groups图4 lnc1343 TSS敲除对小鼠ESC多能性维持的影响Fig.4 The effect of the TSS deletion of lnc1343 on mouse ESC
2.4 lnc1343 TSS敲除对小鼠ESC分化的影响
为了进一步验证lnc1343 RNA自身对小鼠ESC分化的影响,本研究将lnc1343 TSS敲除细胞系和WT细胞培养于去除LIF的分化培养基中分化培养2 d,同样的,结果显示TSS敲除后的细胞克隆也呈现出更加不规则的单层扁平形状(图5A).通过RT-qPCR技术检测TSS敲除细胞和WT细胞分化2 d后的分化标志物的相对表达,结果显示lnc1343 TSS位点敲除后,不同胚层的分化标志物相对表达量均有所上升,且差异具有显著统计学意义(图5B),这些结果表明,lnc1343 TSS敲除后促进了小鼠ESC的分化.

A.不同组细胞在分化培养基培养2 d的图像,比例尺为50 μm;B.不同组中分化标志物的相对表达量;A.Representative images of differentgroup cultured 2 days in indicated differentiation media. Scale bar, 50 μm; B.Relative expression of differential makers in different groups图5 lnc1343 TSS敲除对小鼠ESC多能性维持的影响Fig.5 The effect of TSS deletion of lnc1343 on mouse ESC
2.5 lnc1343过表达对小鼠ESC多能性和分化的影响
为了进一步证实lnc1343在小鼠ESC中的作用,本研究在小鼠ESC中过表达lnc1343 (图6A).利用RT-qPCR检测过表达细胞中多能因子的表达,结果显示lnc1343过表达后细胞中多能性因子Nanog、Sox2和Oct4的表达量均出现了上升,且差异具有显著统计学意义(图6B),表明了lnc1343的过表达进一步增强了小鼠ESC的多能性.同样的,本研究也通过westernblot检测了多能因子蛋白质水平的变化,结果发现多能因子在蛋白水平上也出现了上升(图6C).此外,利用单层贴壁模型试验进一步发现,lnc1343过表达后,过表达细胞在分化培养基中所形成的克隆相较于WT多数保持穹顶状样克隆(图6D),表明lnc1343过表达延缓了小鼠ESC的分化进程,抑制了其的分化作用.通过检测不同分化胚层的标志物发现,lnc1343过表达后,不同分化胚层的标志物都有了不同程度的下降,而且具有显著差异性(图6E).综上,lnc1343过表达能够促进小鼠ESC的多能性维持,而抑制其分化作用.
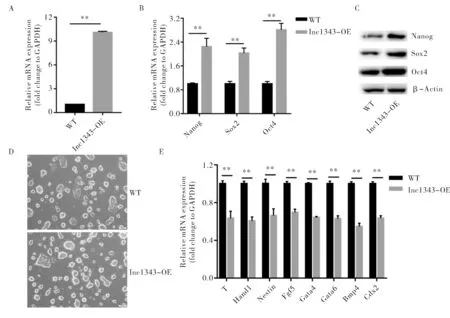
A.不同组中lnc1343的相对表达量;B.不同组中多能因子的相对表达量;C.不同组中多能因子的蛋白表达量;D.不同组细胞在分化培养基培养2 d的图像,比例尺为50 μm;E.不同组中分化标志物的相对表达量A.The relative expression of lnc1343 in different groups; B.The relative expression of pluripotency makers in different groups; C.The protein level of pluripotency markers in different groups; D.Representative images of different group cultured 2 days in indicated differentiation media. Scale bar, 50 μm; E.The relative expression of differential makers in different groups图6 lnc1343过表达对小鼠ESC的影响Fig.6 The effect of overexpression of lnc1343 on mouse ESC
2.6 lnc1343基因座对小鼠ESC的影响
在上述敲除和过表达实验中,发现lnc1343不管是基因座敲除还是TSS敲除,lnc1343邻近基因Rcc1的表达均有不同程度的下降,且差异具有显著统计学意义(图7A、B),此外,在lnc1343过表达后,邻近基因Rcc1的表达出现了上升,且差异具有统计学意义(图7C).这些结果表明,lnc1343的缺失或者过表达都能够对邻近基因的表达具有一定的调节作用,因此,本实验继续探究lnc1343是否可以通过染色质长远距离相互作用来调节其他基因的表达.首先,本实验利用已发表的文献以及数据库来检测lnc1343基因座的表观遗传修饰,结果发现lnc1343基因座具有很强的增强子特异性表观遗传标记,如H3K27ac等(图7D),表明lnc1343基因座含有增强子样的序列,可以通过染色质的长远距离调控作用来调节基因的表达.为了进一步验证lnc1343基因座是否可以通过长远距离调控作用来调节基因的表达,本实验在lnc1343基因座设计了特异性的DNA探针(Left oligo:5′-GAT CAA GGC AGG CAG CAG AGT CAT CAA TTT TCC ATT ATG ACC TAG GGA CCA GTC TAC CTC ATA TCA TAA GGC CCC TGT TAG GCC TAT CCA T-3′;Right oligo:5′-CCT TTT GCC AGA CCT CCA GCT GGA GGA AAA ACC CCA AAA ACG CCT GTC TCC AGA GTG CTG TGA CTA CAG ACT TCA GCC ACC TTT TCA GAT C-3′),利用Capture C技术来捕获与lnc1343基因座具有相互作用的DNA片段,通过生物信息学分析发现,lnc1343基因座与邻近的基因间具有很强的相互作用(图7E),表明了lnc1343基因座可能通过自身增强子样的序列调节邻近基因的表达.此外,本实验进一步分析发现,lnc1343基因座在其他染色体上也有许多相互作用的位点(图7F),这表明lnc1343基因座可能通过增强子样的序列与其他不同的位点远距离相互作用,从而调节不同位点基因的表达.
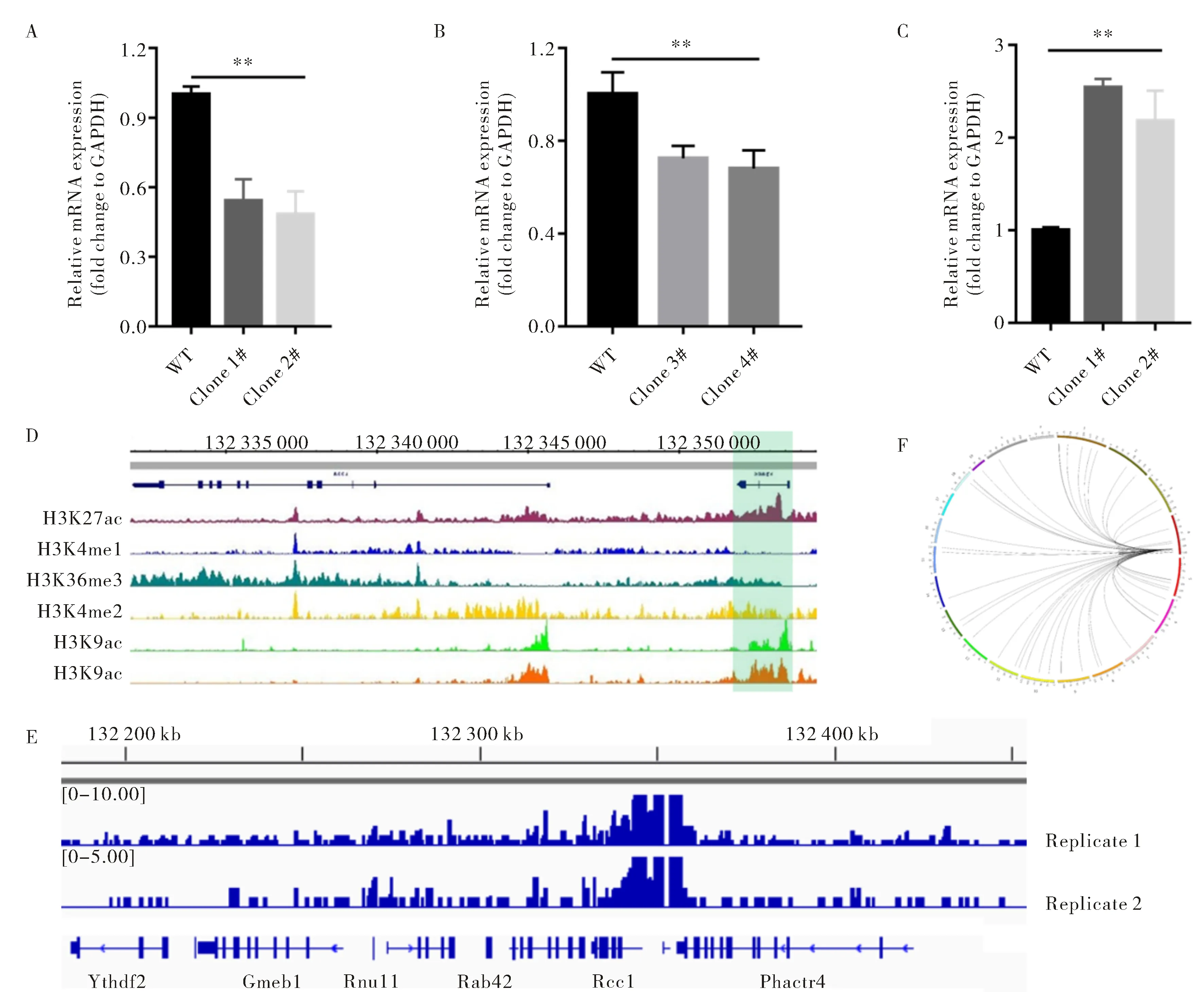
A.~C. lnc1343基因座、TSS敲除以及过表达后Rcc1的相对表达量;D.lnc1343基因座的表观遗传修饰;E.lnc1343基因座与邻近基因的相互作用;F.lnc1343基因座在染色体上的长远距离相互作用A.-C. Relative expression of Rcc1 in different groups upon lnc1343 DNA locus and TSS deletion or overexpression; D.Epigenetic modification in lnc1343 DNA locus; E.The interaction between lnc1343 DNA locus and adjacent genes; F.Long range interaction of lnc1343 DNA locus in different chromosomes图7 lnc1343基因座对小鼠ESC的影响Fig.7 The effect of lnc1343 DNA locus on mouse ESC
3 讨论
lncRNA 通常由多外显子的前体 RNA 剪接、加帽、聚腺苷酸化加工形成,定位于细胞质、细胞核或者同时存在于细胞质和细胞核中[9, 20-21].lncRNA已被证明在调节多种细胞功能和疾病进程(包括干细胞和癌症转移)中发挥了关键作用[11, 22-24].在本研究中,利用CRISPR-cas9基因编辑技术敲除lnc1343基因座后,发现小鼠ESC多能因子在转录和翻译水平上都出现了显著降低,表明lnc1343基因座的敲除对小鼠ESC多能性的维持造成了一定的影响,降低了小鼠ESC的多能性.此外,基因座的敲除虽然直接阻止了lnc1343在细胞中的表达,但是也因为切除了基因座序列而无法区分RNA自身和基因座序列对于小鼠ESC多能性的影响,而且后续的实验也证实,基因座序列具有增强子的特异性表观遗传标记H3K27ac,表明lnc1343基因座可能具有类似增强子的功能,在染色质的长距离相互作用中发挥了重要的功能.因此在本研究中进一步通过CRISPR-cas9基因编辑技术敲除lnc1343的TSS区,且尽可能地保留lnc1343基因座序列,结果表明TSS区敲除后,小鼠ESC多能性因子也出现了显著下降,表明lnc1343 RNA自身对于小鼠ESC多能性的维持也是必要的.此外,通过单层贴壁分化实验结果可以看出,lnc1343的敲除可以加快小鼠ESC分化的进程,即lnc1343的敲除可以促进小鼠ESC的分化,从而进一步表明lnc1343对于小鼠ECS多能性的维持是不可或缺的.最后通过Gain-of-function实验,发现lnc1343的过表达能够显著增加小鼠ESC多能性因子的表达,抑制小鼠ESC的分化进程,再次证明了lnc1343对于小鼠ESC多能性的维持是必需的.
lncRNA功能的发挥可以通过不同的机制来实现,如lncRNA能够与染色质修饰复合物相互作用,并且已经被认为是染色质表观遗传学调控的重要组成成分[12].此外,lncRNA还可以通过形成二级结构模仿DNA序列,作为“分子诱饵(molecular decoy)”调控转录因子的细胞定位以及形成不同的二级结构作为支架(scaffold)[25-26].在本实验中,通过Loss-of-function和Gain-of-function发现lnc1343对于小鼠ESC多能性的维持是不可或缺的,而且也通过Capture C 实验发现lnc1343基因座可能通过染色质长远距离相互作用调控基因的表达.此外,不管是敲除还是过表达,发现邻近基因Rcc1的表达量在lnc1343敲除后出现显著下调,在lnc1343过表达后显著上调,表明lnc1343可能通过自身增强子样的序列调控基因的表达.但是lnc1343过表达后造成Rcc1的上调,而外源性的lnc1343过表达不能将lnc1343 DNA序列引入内源位点,这一结果表明lnc1343可能通过RNA形成一定的二维结构,从而作为支架结合某些转录因子与其内源性DNA序列相互作用来调节邻近基因或者其他基因的表达.
高级染色质构象也是一种参与多能性维持的重要表观遗传机制.染色质虽然是线性的分子,同一染色体上或不同染色体上的位点可通过染色质的折叠从而在三维空间上相互接近,而且染色质长距离相互作用(long-range chromatin interaction)可以调控基因的表达,进而参与细胞命运决定[27].染色质长距离相互作用的重要意义正在逐步被揭示.参与染色质折叠的蛋白质的遗传突变、以及破坏染色质长距离相互作用的非编码 DNA 序列的突变可导致多种疾病,包括肿瘤、发育异常和早衰等[28-29].胚胎干细胞维持着特殊的高级染色质构象,相比分化的细胞而言,ESC中转录不活跃的染色质位点更多通过长远距离的相互作用与其他位点结合[30-32].在本研究中,通过对lnc1343基因座的分析,发现Rcc1基因毗邻lnc1343下游转录终止位点,而先前的研究表明,DNA结合蛋白Rcc1对于细胞周期的调控、核被膜形成、纺锤体形成以及核质物质运输过程中都发挥了重要的作用,而且Rcc1还有可能作为一类与ESC相似的具有多潜能特性的胚胎癌细胞恶性进展的基因组生物标志物[33-36].通过检测不同敲除细胞系以及过表达细胞系发现,Rcc1也确实在敲除细胞系中表达量降低而在过表达细胞系中表达量升高,而且基因座全敲后,Rcc1的表达量相较于TSS位点的敲除更少,这些数据表明lnc1343缺失或者过表达能够对邻近基因的表达具有一定的调节作用,而且基因座的缺失,对于邻近基因的调节更加明显,这也提示lnc1343基因座有可能对于小鼠ESC的多能性维持有一定的影响.通过生物信息学分析发现lnc1343基因座中具有增强子的特异性表观遗传标记H3K27ac,这表明lnc1343基因座可能具有类似增强子的功能,在染色质的长距离相互作用中发挥了重要的功能.为此,本实验进一步通过Capture C来捕获可能与lnc1343基因座相互作用的DNA片段,结果发现lnc1343基因座不仅可以与邻近基因之间具有很强的相互作用,而且与其他染色质之间也有许多不同的相互作用位点,进一步表明了lnc1343基因座在小鼠ESC中发挥了一定的功能,可能通过增强子样的序列长距离地调控基因的表达,从而调控ESC的多能性.进一步分析lnc1343基因座敲除以及TSS敲除数据,发现基因座敲除后不管是多能因子的相对表达量还是在分化模型中不同胚层的相对表达量变化幅度均相对高于TSS敲除后的变化,这也进一步表明lnc1343基因座DNA序列很有可能通过增强子样的序列在小鼠ESC的多能性维持中发挥了一定的功能,这部分的研究需要进一步探讨.
综合上述,本研究发现lnc1343在小鼠ESC中发挥了重要的作用,lnc1343不仅可以通过自身的转录剪切形成的lncRNA来调控mESCs的多能性,同时也可能通过其基因座位调控染色质的长远距离相互作用来调节其他基因的表达.

