本科生自主设计实验探究和实践
——含铬废水的处理和分析
范天骄,姚奇志,2,*,金谷
1中国科学技术大学化学与材料科学学院,合肥 230026
2 化学国家级实验教学示范中心(中国科学技术大学),合肥 230026
当前,我国高等教育正处于内涵发展、质量提升、改革攻坚的关键时期和全面提高人才培养能力、建设高等教育强国的关键阶段。为了紧跟教育改革步伐,依据高校办学和人才培养目标定位,建设适应创新型、复合型、应用型人才培养需要,围绕坚持知识、能力、素质有机融合的培养目标,培养学生解决复杂问题的综合能力和创新思维。我校在分析化学实验课程内容中特别增加了自主设计实验内容,例如:利用定量分析实验教学过程中产生的铬废液为目标处理物,要求学生以重铬酸钾结晶的形式回收废水中的铬,并对回收效率进行科学评价。学生通过查阅文献和可行性分析,自主设计实验方案,实验前通过PPT方式在班级内陈述交流,对各自的实验方案进行讨论、完善,然后进行实验。在自主设计实验教学中,学生成为教学主体,避免了传统实验教学中学生被动接受知识、思考不深入等弊端。突破习惯性认知模式,培养学生深度分析、大胆质疑、勇于创新的精神和能力。同时,提高大学生的环境保护意识,传授化学品废水、废渣的处理等专业知识,也训练学生相关实验操作技能。
该实验分为两周进行,每周8学时。为了保证自主设计实验的教学质量,突破实验学时局限,使学生有充分的准备和交流时间,提前4-6周把实验要求告知学生,学生各自进行文献调研,独自思考、撰写并提交实验方案,助教按照实验方案类型进行分组,学生在组内对实验方案进行讨论,初步修改。鼓励学生在实验前做好PPT,设计实验开始的第1周每组选出代表以PPT方式在班级内陈述实验方案并就实验方案进行答辩,答辩过程要求所有学生参与。学生激烈的质疑、讨论、建议使实验方案更合理、完善。讨论结束,按照实验组准备实验所需试剂并预做实验,进一步完善实验方案,第2周继续进行实验的实施和探究,然后独自完成实验报告的撰写。以下为学生自主设计实验的完成情况。
1 实验方案
1.1 实验方法的选择
按照实验要求废液中铬离子以重铬酸酸钾的形式回收,回收结果的评价采用分光光度法测定。主要采用还原沉淀法进行实验,基本思路为:先调节 pH至酸性,再使用还原剂将六价铬离子还原为三价铬离子;通过调节pH,得到Cr(OH)3沉淀,分离沉淀并氧化铬离子,得到重铬酸钾晶体。但是,具体实验方法有多种选择,如还原剂可以选择使用氯化亚铁或者硫酸亚铁,也可以选择亚硫酸钠;而在氧化剂选择上,高锰酸钾和过氧化氢均可以应用。不同方法的可行性分析如下。
1.2 可行性的理论预测
1.2.1 Cr(VI)的还原
本实验中我们提供的“含铬废水”原液中铬离子(假设均以 VI价态存在)浓度大约为0.1 mol·L−1,所有的实验都在室温(25 °C)下完成。
(1) 若采用亚铁离子作为还原剂,调节pH为酸性,并保持[H+] = 0.01 mol·L−1,其化学反应有:
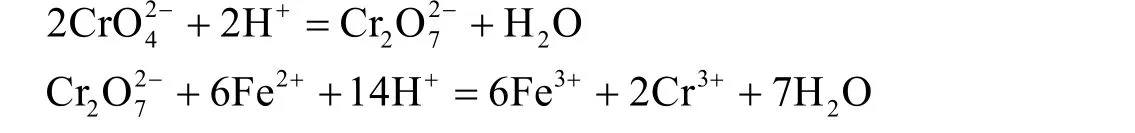
我们知道,在酸性条件下,上述氧化还原反应的标准电极电位分别为:

如果加入100 mL 0.3 mol·L−1的硫酸亚铁溶液于100 mL废液中,当反应完成了99%时,此时溶液中:

由能斯特(Nerst)方程:E = E0+ 0.0591/n × lg([氧化型]/[还原型]) (其中n是电极反应中得或失电子数),不难计算出:
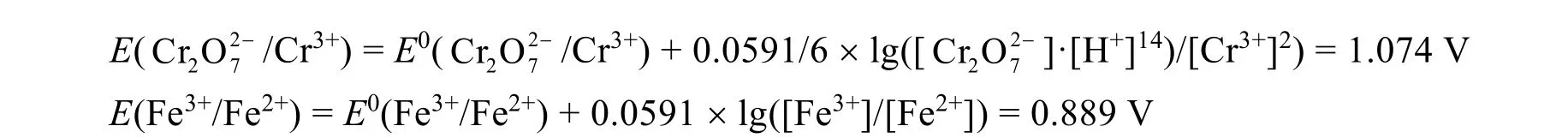
(2) 若采用亚硫酸钠作为氧化剂,其氧化还原反应有:
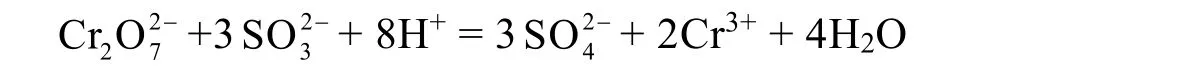
实验中配制酸化后的亚硫酸钠溶液0.15 mol·L−1(即称取18.9 g七水亚硫酸钠,或9.45 g无水亚硫酸钠或7.80 g亚硫酸氢钠溶于500 mL 0.001mol·L−1的硫酸溶液中),还原含铬废水中的六价铬。同样,实验中加入100 mL上述溶液于100 mL铬废水中。此外,根据不同pH条件下各种离子电离-水解平衡后占比为(取总浓度为单位1):

故不宜使得反应体系酸性过高,否则溶液中容易形成亚硫酸,分解后产生二氧化硫逸散,造成原料损失和环境污染。
同样,我们假设实验中的pH = 2 ([H+] = 0.01mol·L−1),氧化还原反应进行了99%,此时溶液中:

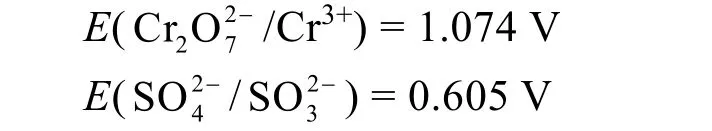
综合以上计算结果,使用亚铁离子和亚硫酸根离子作为还原剂,从热力学考虑均可完全还原重铬酸根。
1.2.2 Cr(III)的沉淀
实现了Cr(VI)到Cr(III)的还原,下一步工作就是如何实现Cr3+的沉淀分离。对于选择使用亚铁离子作为还原剂,则应将氧化所得的三价铁离子和铬离子进行分步沉淀。已知lgKsp(Fe(OH)3) = 37.4、lgKsp(Fe(OH)2) = 15.1和lgKsp(Cr(OH)3) = 30.2;考虑到加入了还原剂,离子浓度被稀释,取铬离子的浓度为0.05 mol·L−1,铬离子开始沉淀时,溶液pH = 4.4;完全沉淀时(取离子浓度低于10−5时为沉淀完全),则pH = 5.6;当铁离子完全沉淀时,pH = 3.2,而当亚铁离子完全沉淀时,pH = 9.0。因此,需要首先调节pH为酸性,在空气中微热后使亚铁离子被氧化,在氧化完全后得铁离子。这样,铁离子在调节pH至碱性的过程中先于铬离子沉淀,过滤去除。
对于选择使用亚硫酸根作为还原剂,则无需分步沉淀。可直接向溶液中逐滴加入浓度为6 mol·L−1的浓氨水并不断搅拌,使用精密pH试纸测量pH,使其pH > 5.6,形成Cr(OH)3,过滤并获得沉淀,之后可再加酸溶解。
1.2.3 Cr(III)的氧化
通过查找资料,提出的实验预案中氧化剂的选择也具有多样性,主要涉及实验原理如下。
(1) 使用高锰酸钾作为氧化剂。
缓慢向溶液(取铬离子浓度为0.1 mol·L−1,体积为100 mL)中加入酸化的KMnO4溶液(控制物质的量比约为1 : 1,浓度为0.1 mol·L−1,加入100 mL),控制pH = 4,静置后过滤。也可用亚硝酸钾除去过量高锰酸钾,同时用尿素除去过量亚硝酸钾,有以下方程式:
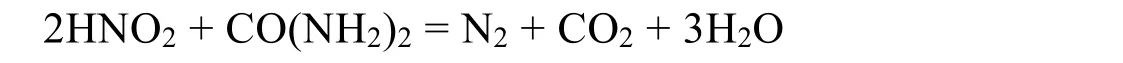
考虑到高锰酸钾还原后易得到Mn2+和MnO2两种还原产物:
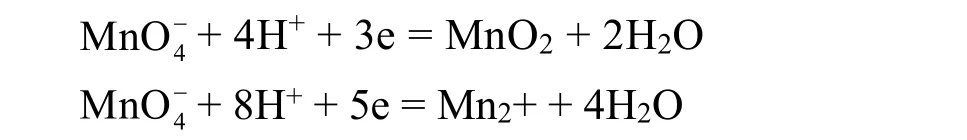
查得:

ΔE1= 0.432 V > 0.4 V,故反应可向右进行,从热力学上看,刚好可以产生沉淀MnO2,可通过过滤除去,得到重铬酸钾溶液。

ΔE2= 0.26 V > 0.2 V,反应从热力学上考虑能够进行,但 ΔE2< 0.4 V < ΔE1,进行并不彻底,故当反应时间足够长时,还原产物以热力学产物二氧化锰固体为主。
(2) 若选择过氧化氢作为氧化剂。
向100 mL的0.1 mol·L−1铬离子溶液中加入20 mL 3%的H2O2溶液(设溶液pH = 4),有如下方程式:

反应产生氢离子,此反应在碱性条件下有利。
查得E0(H2O2+ 2e + 2H+= 2H2O) = 1.776 V,室温下当反应进行了99%时,c(H2O2) = 0.0233 mol·L−1,由能斯特方程,得到:
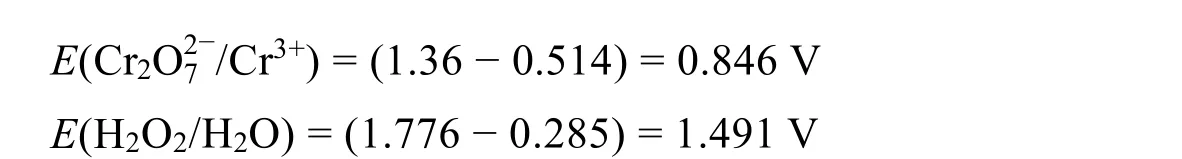
ΔE = (1.491 − 0.846) = 0.645 V > 0.4 V,在热力学条件下,反应可进行得比较彻底。
若考虑到铬离子溶液由于之前的稀释过程浓度发生了变化,设铬离子溶液浓度为0.05 mol·L−1,体积为200 mL,则反应进行了99%后,[H2O2] = 0.0127 mol·L−1,4.5 × 10−4mol·L−1,设 c(H+) = 0.0001 mol·L−1,由能斯特方程,得到:

ΔE = (1.484 − 0.858) = 0.626 V > 0.4 V,反应可进行得比较彻底。
需要说明的是,以上计算时过氧化氢均过量45%-50%。因为过氧化氢容易去除和得到,同时也可防止部分过氧化氢分解,无法让铬离子完全氧化的情况发生。
(3) 不氧化铬离子,而是氧化铬离子的配合物。
如向含有 0.1 mol·L−1100 mL (或 0.05 mol·L−1200 mL)铬离子滤液中加入浓氨水到 pH = 9,过滤得到氢氧化铬,用10 mL 2 mol·L−1氢氧化钠(氢氧化钾)溶解,有:
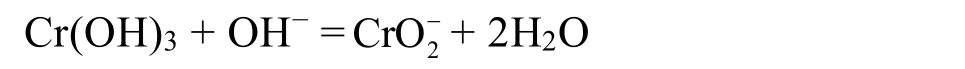
此配合物溶解性较好,不易析出。当得到绿色澄清液后,再向溶液中加入3%的H2O220 mL,水浴加热。
1.2.4 重结晶
根据氧化后的溶液中存在的离子及可能结晶析出的盐,查阅得到它们的溶解度随温度的变化关系曲线如图1所示。图1中溶解度定义为:在每100 g的总溶液溶解的溶质质量(g)。图1显示,重铬酸钠在水中溶解度极大,0 °C时每100 g的总溶液溶解的溶质质量已达62.1 g。因此,重铬酸钠对本次实验结果无影响。

图1 不同盐的溶解度随温度变化曲线图
从图1可直观看出,溶解度随温度变化较大的是重铬酸钾(K2Cr2O7),在冰水浴下硫酸钠(Na2SO4)和硫酸钾(K2SO4)的溶解度与重铬酸钾相近,因此,冰水浴重结晶宜选择氯盐。
综上,重结晶方案如下:向溶液中加入浓盐酸(计5 mol·L−1)调节pH至1-2 (需4 mL以上)。若用氢氧化钾调节 pH至碱性,可直接加热浓缩至出现重铬酸钾晶膜,再趁热过滤,冰水浴后可过滤得到产品;若用氢氧化钠调节pH至碱性,则需用浓硫酸控制pH至1-2,加热浓缩得到硫酸钠晶体,过滤后向溶液中加入1 g KCl固体加热浓缩至出现晶膜,冷却结晶(冰水浴),再次过滤。
而铁氧体法学生掌握得并不透彻,因此本实验中并未采用铁氧体法,而实际实验步骤为:先加入氢氧化钾调节 pH至碱性,沉淀过滤去除可能存在的铁离子后,取滤液加入亚硫酸钠,并用过氧化氢作为氧化剂得到重铬酸钾,最终重结晶得到产品。
1.3 铬离子含量检验
用分光光度法对回收前后废液中六价铬离子进行检验,学生查得检验方案如下。
(1) 根据前期查阅资料[1],酸性溶液中,六价铬可与二苯碳酰二肼(DPCI)作用,生成紫红色络合物,其色泽深浅与铬的含量成正比,用722型分光光度计在540 nm波长下进行比色测定,与标准工作曲线比较即可定量计算得到结果。具体操作如下:
① 由于提供的含铬废液中可能含有滴定分析时残留的指示剂二苯胺磺酸钠干扰吸光度,加入少量活性炭脱色。加入活性炭,搅拌5 min,抽滤,取滤液进行分析[2]。
② 由于二苯碳酰二肼法测量六价铬仅适用于痕量铬的测定,故需要将溶液进行稀释。仍假设溶液中铬离子浓度为0.1 mol·L−1,且均为六价铬,则稀释1000倍后,浓度为5.4 mg·L−1。稀释铬离子后,定容。
③ 配制重铬酸钾标液,其中铬离子浓度为 1 mg·L−1;同时配制 DPCI-乙醇(EtOH)溶液,其中 DPCI浓度为1 g·L−1。准确移取0、1、2、4、8、16 mL重铬酸钾标液于25 mL比色管,加入1 mL 3 mol·L−1硫酸和2 mL DPCI-EtOH溶液,定容,摇匀,显色5 min后在540 nm下测量其吸光度,并作标准工作曲线。
④ 取4 mL稀释后待测液于25 mL比色管,加入1 mL 3 mol·L−1硫酸和1 mL DPCI,定容,显色5 min后在540 nm测量吸光度。
⑤ 对照标准工作曲线,即可知铬离子浓度。
(2) 方案(1)测量均较繁琐,其应用受到课时限制。学生通过查阅资料,直接采用测量三价铬的方案,具体见参考文献[3]。其实验原理为:溶液中铬元素均还原为三价铬后,其在磷酸介质中显绿色,在波长600 nm下其浓度与吸光度之间满足朗伯-比尔定律。
需要注意的是,虽然文献中还指出了可以直接测量六价铬溶液的吸光度,但是由于存在以下平衡:

由于两酸根离子颜色不同,吸光度也会不同,故实验中学生并没有采用文献中六价铬的测定方法,而是采用文献中所提及的还原铬元素为三价铬并测定吸光度的方法。
也有学生提到参考文献[4]中的方法,即利用乙二胺四乙酸二钠(EDTA)络合三价铬得到有色络合物进行分光光度法分析,但由于实验中未提供EDTA,此实验未进行。
综合上述原因,学生采用了二苯碳酰二肼显色法对六价铬离子进行检验,而总铬离子浓度则采用参考文献[3]中测量还原产物中的三价铬吸光度方法进行实验。
2 实验结果与分析
2.1 实验结果
(1) 在预实验中采用了铁氧体法进行合成,但是经过仪器分析,发现并未形成如预期的铁氧体物质中较为常见的尖晶石(A2BO4)结构比例[5]。
(2) 在使用亚铁离子还原废液中的六价铬后,向溶液中逐滴加入浓氨水,用精密pH试纸控制pH < 4,有大量絮状沉淀产生。该絮状沉淀由于颗粒过细,难以通过常压过滤去除。而如果使用抽滤方法则出现了穿滤现象,难以去除。故最终未使用亚铁离子作还原剂。
(3) 在正式实验中,采用了亚硫酸氢钠作为还原剂,按照上述实验方法,经过氧化、重结晶步骤后,得到橙红色晶体,过滤,取滤液备用。
(4) 使用DPCI法测定滤液中六价铬离子含量,标准工作曲线如图2所示,拟合得到Y = 0.9076X −0.004167 (r2= 0.9997)。

图2 重铬酸钾-DPCI标准吸光度曲线
将重结晶得到的滤液收集并定容至100 mL,取1 mL稀释液于比色管,加入1 mL 3 mol·L−1硫酸,2 mL 1 g·L−1DPCI-EtOH溶液,定容;在540 nm下测得吸光度为0.043,由图2标准工作曲线计算,得滤液中铬(VI)质量为1.30 × 10−4g,已接近铬离子相关国家排放标准,达到预期实验结果。
(5) 我们还在尝试使用直接比色法测量总铬离子浓度时发现:若用参考文献[3]方法,即以十二水合硫酸铬钾为三价铬来源配制标准溶液,得到的溶液显蓝色;而由亚硫酸钠还原得到的三价铬溶液在加入磷酸后显浅绿色,此与标液颜色不相符。
因此,在实际比色中,我们用足量亚硫酸钠将已知浓度的重铬酸钾溶液还原后作为标准溶液的方法,制作标准工作曲线,拟合得到Y = 0.4105X − 0.000875 (r2= 0.9999),如图3所示。

图3 还原后重铬酸钾标准吸光度曲线
实验时,取10.00 mL废液于250 mL容量瓶中,加入30.00 mL 0.3 mol·L−1亚硫酸钠溶液,定容;转移20.00 mL于比色管后再加入5 mL 1 : 3磷酸 : 水溶液,600 nm下测得吸光度为0.007,由图3标准工作曲线可算得废液中铬离子总浓度为1.20 g·L−1。
2.2 实验分析
(1) 本次自主设计实验中,我们发现:如参考文献[3]方法直接测量三价铬精确度并不高,存在铬(III)在不同体系下颜色不同的情况,且废液中的其余离子(Cl−)等会与三价铬形成颜色不同的配合物离子等问题,影响了直接测量法的精度。
(2) 测量总铬浓度时,尝试采用DPCI法。但是在加入过量过硫酸钾固体并且加热后氧化效果并不好,蒸干溶液后仍然有绿色晶体存在,说明氧化并未彻底,得到了Cr2(SO4)3·6H2O绿色晶体,说明过硫酸钾用量和pH可能把控效果不佳,为满足教学实验结果,建议改用过氧化氢作为氧化剂。
(3) 虽然经过理论计算采用高锰酸钾作为氧化剂的方案可行,但是考虑到其副产物较多,并且氧化需要2-4 h[6],时间过长,教学学时有限。故最终并没有进行高锰酸钾氧化的尝试。
3 结语
自主设计型实验中,学生通过文献调研、提出实验方案、组内和班内多次讨论、PPT答辩以及展开预实验和后续实验探究等环节,特别是针对可能的实验情况进行多角度、多层面的可行性分析、讨论步骤,学生将所学到的扎实理论知识灵活地运用于复杂问题的处理中,训练了他们分析、解决复杂问题的综合实验能力,切实达到学以致用的教学目的。基于所学理论和文献调研之上的新颖想法在学生的讨论和实验中得以验证和升华,更加激发了学生的实验探究兴趣和创新热情。开放性、自主设计实验在我校分析化学实验教学中已经坚持了20余年,受到学生一直好评,多年来的教学座谈中,学生一致建议开放性、自主设计实验要继续坚持和发扬。

