基于文献计量分析的禾本科牧草染色体加倍研究进展
王 晶, 伏兵哲,3*
(1. 宁夏大学农学院, 宁夏 银川 750021; 2. 宁夏草牧业工程技术研究中心, 宁夏 银川 750021;3. 宁夏优势特色作物现代分子育种重点实验室, 宁夏 银川 750021)
多倍体是指拥有2个以上完整染色体组的个体[1],可以通过自然发生和人工诱导产生。自然发生多倍体是具有不同倍性水平的物种间天然杂交或未减数配子与种间或种内配子结合而形成[2],其形成相对缓慢且比较罕见,据前人统计被子植物中自然形成的多倍体物种只有2%~4%[3]。随着植物育种技术的深入研究及多倍体诱导技术的广泛应用,人们通常利用物理、化学、生物等人工诱导方法以提高多倍体的发生频率,从而克服在自然界中由于一些植物倍性水平不同而不能进行物种间杂交、杂交后代不育以及某些属只有一个物种等所导致的植物基因库狭窄、经济价值性状低等问题[4]。多倍体植株一般表现为器官巨大、抗逆性强,但往往也伴随着生长慢、矮生、育性低等特征[5],因此多倍体育种技术主要适用于以收获营养体为主的植物种质创新、改良和品种选育。综上,人工诱导多倍体技术被认为是促使生物多样性增加的一个有价值的工具,它增加了种质的多样性,为育种工作的延续奠定了基础[6-9]。
禾本科牧草作为家畜生长繁育的重要饲草,在维持我国畜牧业稳定发展以及草原生态系统平衡方面有着不可替代的作用[10],因而培育出优良牧草品种并使其成功应用于生产实践有着重大现实意义。多倍体诱导不仅可以提高禾本科牧草的饲用价值,而且促进了生物进化与育种技术的发展。近年来,许多育种家在禾本科牧草多倍体诱导技术和倍性鉴定方法等方面不断深入研究,取得了一定的成果。本文将基于中国知网(China national knowledge internet,CNKI)和Web of Science核心合集数据库(WOS),对植物染色体加倍研究发展趋势以及禾本科牧草染色体加倍和鉴定方法进行详细综述。
1 基于Citespace的植物染色体加倍发展趋势分析
为全面了解全球植物染色体加倍相关研究现状和前沿趋势,更好地把握最新的研究动态,利用CiteSpace软件分别对1999—2020年收录在CNKI和WOS中的有关植物染色体加倍的文献进行时区视图分析(图1,图2)。以CNKI数据库中的期刊作为检索大类,以“染色体加倍”为检索主题,共检索出文献495篇,剔除会议等无关条目后剩余483篇有效文献,以Refworks格式输出其信息作为分析数据源,图1显示共有67个节点(nodes),133条连线(links),每个节点代表一个关键词,节点越大所对应的关键词出现频次越多,连线越多则表示关键词共现次数越多,它们之间连线粗细表示相互关系的强弱[11]。“染色体加倍”出现频次最多,共出现了130次,“秋水仙素”次之,出现了105次,此外“多倍体”“染色体加倍”“单倍体”等节点外部有紫色圈,表明中介中心性较高,中心性分别为0.40,0.30和0.33;从中提取出12个突变词,最早的“甘蓝型油菜”这个研究热点自2001年起持续了5年,随着时间推移“药用植物(2005—2010年)”、“氟乐灵(2009—2012年)”的突变强度也相对突出,“三倍体(2015—2020年)”是近6年来的主要研究热点。WOS中以“Chromosome doubling(染色体加倍)”为检索标题,共检索出311篇文献并以“全记录与引用的参考文献”格式输出文献信息作为分析数据源,图2显示共有128个节点(nodes),378条连线(links),colchicine(秋水仙素)、recombination(重组)、induction(诱导)、polyploidy(多倍体)、gene(基因)为出现频次较多的前5个关键词,出现次数依次为35,25,24,22和20;从中提取突变词13个,“recombination(重组,1999—2010年)”最早作为研究热点,之后是“flow cytometry(流式细胞术,2007—2012年)”和“gene amplification(基因扩增,2009—2014年)”,而近4年的研究热点是“induction(诱导,2017—2020年)”。由此可以发现,染色体加倍研究有宏观层面,也有微观层面,总体呈现出从单一到多元化的趋势。

图1 基于CNKI的植物染色体加倍研究前沿时区视图Fig.1 Time zone view of the frontier research of plant chromosome doubling based on CNKI

图2 基于WOS的植物染色体加倍研究前沿时区视图Fig.2 Time zone view of the frontier research of plant chromosome doubling based on WOS
2 禾本科牧草多倍体人工诱导方法
人工诱导禾本科牧草多倍体的方法主要有物理、生物、化学等方法。如表1所示,不同方法的诱导原理、材料类型、诱导效果及应用等均不同。其中物理方法是利用温度骤变、离心力、电离辐射等处理植物材料从而诱导染色体加倍,该方法具有不确定性且诱导效率普遍较低,在禾本科牧草加倍中应用较少,仅有Randolph[12]、Dorsey[13]和韩玉琴[14]等利用高温或低温处理对一些粮食作物加倍时获得成功。生物方法是通过有性杂交、体细胞杂交以及胚乳培养等方法获得染色体加倍植株。有性杂交法通常以四倍体植株作为母本,授于二倍体植株的花粉以获得三倍体植株,如钟声[15]将二倍体野生鸭茅(Dactylisglomerata)与四倍体栽培种进行杂交获得了其三倍体,虽然三倍体鸭茅高度不孕,但却可以作为一种宝贵的育种材料;贾燕妮[16]的研究表明四倍体小麦与二倍体山羊草(Triticumtriunciale)杂交形成的三倍体杂种F1理论上自交不育,但却由于它的母本四倍体小麦未减数配子的基因作用使F1发生染色体加倍而具有较低的结实率。胚乳培养法因其生产无核品种,在水果三倍体培育中备受追捧[17-19],但由于其结实率低,因而在禾本科牧草中应用较少。化学方法是利用化学诱导剂处理植株生长点的实体细胞或离体组织,从而诱导染色体加倍,与物理、生物方法相比,该方法诱导效率高、成本低且较稳定,因而应用最普遍。
2.1 影响化学方法诱导禾本科牧草染色体加倍的主要因素分析
化学方法诱导禾本科牧草染色体加倍最为普遍,因此表2按时间顺序对CNKI和WOS中40篇有关化学方法诱导禾本科牧草染色体加倍时外植体类型、处理方法、加倍试剂的适宜浓度、时间与温度以及倍性鉴定技术等主要影响因素进行分析总结。
2.1.1化学加倍试剂的种类 化学加倍试剂主要有秋水仙素(Colchicine)、氟乐灵(Trifluralin)、甲酰胺草磷(Amiprophose methyl,APM)、氨磺乐灵(Oryzalin)等。在不同的化学加倍试剂中,因秋水仙素诱导多倍体高效且可靠而被普遍应用(表2)。也有部分研究显示秋水仙素虽然诱导率较高,但由于其毒性较大,且导致成活率较低,因此在使用秋水仙素诱导时应严格控制处理条件。也有一些研究认为在禾本科牧草多倍体诱导中使用其它加倍试剂效果较好,如Salon等[20]在诱导鸭茅状摩擦禾愈伤组织加倍时,发现使用APM加倍效果较秋水仙素好;Quesenberry等[21]使用氨磺乐灵、秋水仙素、氟乐灵诱导巴哈雀稗加倍时表明氨磺乐灵诱导效果最好,它和微管蛋白之间的亲和性高,可以形成氨磺乐灵-微管蛋白复合体,秋水仙素诱导效果次之。由此可见,加倍剂的诱导效果并不是绝对的,同一种化学加倍试剂对不同植物材料的诱导效果不同,适宜加倍剂的选择是影响加倍效果的关键因素。
2.1.2外植体材料类型 外植体类型是影响多倍体诱导效率的另一个主要因素[22-23]。诱导禾本科牧草染色体加倍时可供使用的外植体材料有愈伤组织、茎段、胚芽、分蘖芽、种子、幼苗、植株等。图3显示,诱导禾本科牧草最常用的外植体为种子,占27.6%,其次是愈伤组织,占25.9%,幼苗、分蘖芽分别为20.7%,13.8%,而其它几种外植体材料占12%。由表2可知,对同一种植物的不同外植体材料进行多倍体诱导时效果不同,如云岚[24]诱导新麦草(Psathyrostachysjuncea)的种子、分蘖芽、愈伤组织加倍时,得出在离体条件下诱导愈伤组织时,诱导效率最高,达到了53.58%;而张秀丽[25]分别对新麦草的种子、胚芽以及幼苗加倍时,发现以幼苗为外植体,诱导率达到了62.5%;Quarin等[26]在对百喜草(Paspalumnotatum)的研究中也得出,与萌发的幼苗相比愈伤组织作为外植体时其诱导率更高,为74.00%。因此,适宜外植体的选择是诱导成功的一大决定因素。

表1 禾本科牧草染色体加倍方法比较Table 1 Comparison of chromosome doubling methods for grasses
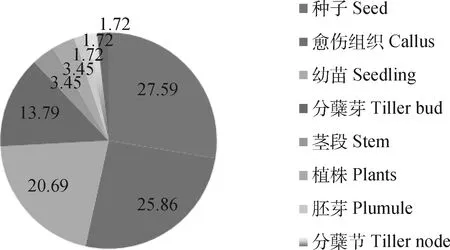
图3 秋水仙素诱导禾本科牧草加倍时外植体类型比例Fig.3 Colchicine induces the percentage of explant types to double in grasses/%
2.1.3化学诱变剂的处理浓度、时间与温度 化学诱变剂处理浓度、时间和温度是影响染色体加倍效率的主要参数,且3者之间存在明显的交互作用。表2中列出了秋水仙素诱导不同禾本科牧草染色体加倍的适宜浓度、时间和温度,一般诱导浓度范围在0.01%~0.3%,时间范围在1~72 h,温度范围在15℃~30℃,可见不同植物同一外植体或同一植物不同外植体的最适处理浓度、时间和温度均存在显著差异。随着秋水仙素处理浓度增加,染色体诱导率增大,但相应地细胞死亡率增加。一般高浓度处理时间宜短、低浓度处理时间相对延长时进行诱导处理效果较好,如钟声等[27]对鸭茅进行加倍时所选的适宜处理浓度和时间为0.05%,48 h或0.2%,24 h,而F. Wit[28]对意大利黑麦草加倍时选择0.1%,2 h或0.2%,1 h。大多数相关研究没有进行温度控制设置,但王桂花等[29]在诱导巨大赖草染色体加倍时,进行了不同温度梯度控制,结果显示在15℃时处理其种子效果最好,温度过高、过低都不利于诱导四倍体的产生。也有研究表明,秋水仙素处理浓度与温度之间的互作效应要大于浓度与时间之间的互作效应[24]。因此,选择适宜的处理浓度、时间与温度,可以在很大程度上提高多倍体诱导率。
2.1.4化学诱导处理方法 化学诱导处理方法主要包括浸泡法、包埋法、滴液法、注射法、涂抹法等。对禾本科牧草而言,其中浸泡法使用最多,占所有方法的91.38%,并且在浸泡法中以种子浸泡最为常见[62]。与实体诱导相比,离体诱导染色体加倍具有重复性高、试验条件易控制、诱导率高、嵌合体少等优点[63],因而近年来离体诱导法被广泛应用。如对新麦草愈伤组织进行诱导后,多倍体效率达到了53.58%,比对萌对动种子和分蘖芽实体细胞染色体加倍分别高29.18%和10.93%[24];云玲格[59]通过离体诱导披碱草(Elymuscanadensis)×野大麦(Hordeumbrevisubulatum)杂种F1愈伤组织时,也同样得到了较高的诱导率。

表2 秋水仙素诱导禾本科牧草染色体加倍Table 2 Colchicine induces chromosome doubling in grasses

续表2

续表2

续表2

续表2
2.1.5其它条件 除以上影响化学方法诱导染色体加倍的因素外,通常在处理液中添加一定浓度的二甲基亚砜(DMSO)能够增加细胞的通透性,从而增加细胞对诱导剂的吸收,并且在处理时使用振荡器或摇床震荡,并针对不同的外植体材料选择适宜的震荡速度可以使外植体与秋水仙素溶液充分接触,增强秋水仙素在细胞中的渗透,从而提高多倍体诱导率。
3 多倍体植物的倍性鉴定
多倍体植物的鉴定是多倍体育种中的一个重要环节。通常进行禾本科牧草倍性鉴定的方法有染色体计数、形态学、细胞学、流式细胞术(FCM)、核仁数目与核型分析、生理生化指标、逆境胁迫、分子水平鉴定等。其中染色体计数法是最基础且常用的方法,而近年来以FCM作为首选方法测定植物细胞核DNA含量和倍性水平的研究越来越多,主要由于FCM与其他技术相比,提供的结果准确而不复杂,并允许在短时间内分析大量目标植物[64]。表3总结了常用倍性鉴定方法的原理、优缺点并且统计了不同鉴定方法的应用比例,为之后的一系列研究选择合适的鉴定方法提供理论基础。
4 多倍体的应用
4.1 培育多倍体牧草新品种
诱导形成的多倍体植株具有巨型性以及其抗病虫害、抗逆性增强等特点,从而可以获得优质、高产的禾本科牧草新品种。染色体加倍后会使植物生理生化指标改变,如二倍体黑麦草加倍为四倍体后不仅水分和可溶性碳水化合物的含量增加,改善了适口性,而且增强了抗病性和耐旱性[40]。
4.2 克服杂交后代的不育性和不结实性,使种间杂种的育性得到恢复
加拿大披碱草与野大麦杂交后代F1为三倍体,杂种F1的花药又小又薄,不开裂,花粉育性仅为1.19%,并且在开放授粉条件下不结实,通过对杂种F1染色体加倍后其育性得到了恢复,成功创造六倍体加拿大披碱草—野大麦新种质[42]。Salon等[20]对鸭茅状摩擦禾(Tripsacumdactyloides)的研究中显示人工诱导加倍后的四倍体有性雌花两性花同株植株与无融合生殖的雌雄同株四倍体植株作为花粉亲本杂交,将产生可育后代。
4.3 形成远缘杂交育种的中间亲本
多倍体作为基因转移的媒介作用时,可以促进不同植物分类单位之间的遗传传递,如四倍体小麦与二倍体山羊草杂交创制了双二倍体,它可以作为“桥梁”与小麦杂交和回交,从而将山羊草的优良遗传物质转移到小麦,可以丰富遗传多样性[16]。

表3 禾本科牧草多倍体鉴定方法Table 3 Polyploid identification method of grasses
5 问题与展望
禾本科牧草多倍体的研究在过去的几十年里取得了显著成效,前人阐明了它们产生的原因和后果,发现多倍体化是推动物种形成和进化的主要力量,对植物进行染色体加倍可以改变其基因组的结构,提高它对环境的适应性以及丰富物种遗传多样性等方面的优势,从而获得优良的植物特性。然而,由于禾本科牧草多倍体化这一过程的复杂性,多倍体试验的成功率高度可变,目前还没有一个完整的多倍体化方案。秋水仙素诱导禾本科牧草染色体加倍的整体诱导率在0%~94.69%之间,引起这种结果的原因是诱导率的评估程序不同,如计算诱导率可根据处理植株的数量或存活植株的数量计算,并且多倍体化的百分比有时包括混倍体,有时却将加倍植株与混倍体分开。此外人工诱导染色体加倍效率取决于诸多因素,如植物种类、化学加倍试剂的种类、外植体类型和处理浓度、时间与温度以及处理方法等,这些参数之间的交互作用非常高,其中任何一个条件改变都会对诱导率产生一定程度的影响,所以可以通过调节几个参数来获得较高比例的多倍体。目前诱导多倍体形成时产生的嵌合体现象仍是主要难题,这种现象通常导致诱导形成的同倍性多倍体出现的频率较低。因此,阐明植物基因组中多倍体的作用,并且深入了解多倍化后基因组变化与新表型表达之间的关系,并将发生在基因组和转录组水平上的遗传变化与发生在表型水平和个体适应性水平上的变化联系起来,以确定在多倍体中观察到的遗传和表型变化是否真的具有适应性等问题仍有待深入研究。这不仅使禾本科牧草的改良具有良好的发展前景,同时可以使植物育种家更高效准确地操纵多倍体基因组并取得显著成效。随着禾本科牧草在畜牧业应用和发展中的不断扩展,多倍体诱导产生的禾本科牧草新品种将对高产、速生、优质、抗逆性强等特征更加重视,而现代育种技术的发展也必将解决这些难题,使禾本科牧草育种工作更加持续而高效的发展。

