果蔬中诺如病毒检测技术研究进展
朱金艳,于思梦,吕敬章,朴永哲,杨希国,吕日丰,陈 思,王月华,麻丽丹
(1.庄河市食品检验监测中心,辽宁大连 116400;2.深圳海关食品检验检疫技术中心,广东深圳 518045;3.大连民族大学,生物技术与资源利用教育部重点实验室,辽宁大连 116600;4.辽宁通正检测有限公司,辽宁沈阳 110026;5.凤城市汇明农产品有限公司,辽宁丹东 118109;6.沈阳农业大学食品学院,辽宁沈阳 110866;7.丹东海关,辽宁丹东 118000)
诺如病毒(Norovirus,NoV)直径约26~35 nm,无包膜,表面粗糙,球形,呈面体对称,电镜下缺乏显著的形态学特征,是引起人类病毒性胃肠炎的主要病原之一,由NoV等食源性病毒引起的食源性疾病问题日益突出,已成为威胁人类健康的重要公共卫生问题之一[1]。NoV具有很强的感染力和致病力,感染剂量低至10~100个病毒粒子,每年10月至次年3月是NoV暴发流行的高发期,极易在半封闭、人口密集的场所暴发,造成大规模群体感染,尤其易在医院、学校、养老院等抵抗力弱的人群聚集地暴发,传播途经多样,可经粪-口传播、人-人接触、水源性以及食源性传播[2]。
NoV在低温下能够存活数年,其pH耐受范围为2~9,在60 ℃下保持30 min仍具有活性,因此食源性NoV最主要的感染源是可生食的食品。果蔬生长接近地面,易受气候条件、土壤环境、灌溉用水及采摘人员的影响,或易腐烂、消毒清洗不彻底,具有潜在的病毒感染风险,因此也成为除贝类以外引发NoV感染的主要食物载体。目前,国内关于果蔬中NoV检测标准有GB 4789.42—2016、SN/T 4784—2017和 SN/T 5325.1—2020[3-5]。GB 4789.42—2016主要检测贝类、生食蔬菜、坚果等硬质食品,以及草莓、西红柿、葡萄等软质水果,硬质食品和软质水果则采用不同类型NoV提取方法进行提取,均采用实时荧光RT-PCR方法进行检测。SN/T 4784—2017的主要检测对象为软果、硬果、瓶装水和贝类。SN/T5325.1—2020主要是对贝类、硬质表面食品、生食蔬菜、软质水果中的食源性病毒进行定量检测。国际上目前通用的标准为ISO 15216-2:2019,也是主要结合食品(包括果蔬产品)的类型采用相应的NoV提取方法,结合实时荧光定量PCR法进行检测[6]。为提高果蔬的安全性,提升果蔬检测的准确性和规范性,本文将对果蔬样品中NoV的洗脱、富集和检验检测方法等方面的研究现状展开综述,为果蔬中NoV的研究提供参考,防范NoV的污染和感染,保障食品安全。
1 果蔬中食源性NoV污染
1.1 果蔬中食源性NoV的污染情况
近几十年来,全球范围内与果蔬相关的食源性NoV疾病暴发数量持续增长[7]。这些来源于农产品中的NoV使人们在食用后患病,涉及的果蔬主要有生菜、胡萝卜、绿葱、草莓及蓝莓等。由果蔬引发的食源性疾病在欧美国家时有暴发,2012年德国多所学校发生了由污染的草莓引起的NoV暴发,导致10 952人感染;同年美国生鲜果蔬产品食源性NoV的暴发共计287起,导致6 009人感染;2013年,丹麦果蔬相关的食源性NoV的暴发共计28起,导致655人感染[8-10]。近年来,根据大部分省市的监测情况来看,我国由NoV引发的急性胃肠炎暴发的病例报道也逐年增加,食品作为NoV传播载体的风险已引起重视,食源性NoV的监测得到风险评估部门的重视。
1.2 果蔬中食源性NoV检测存在的困难
文献显示,由食品引起的病毒性安全事件的实际发生数量远远高于所报道的数量[11]。果蔬产品基质复杂,富含色素、糖类和纤维素等多种成分,会造成病毒核酸提取过程中存在大量RT-PCR抑制剂,从而大大降低病毒RNA的提取效率和扩增效率,影响检测结果。与食源性细菌相比,食源性病毒粒子的数量较少,又不可在体外繁殖,因此蔬菜中病毒的洗脱和富集处理对提高食品中病毒的检出率和减少假阴性结果非常重要。
2 果蔬中NoV的洗脱和富集
2.1 NoV的洗脱
从水果蔬菜基质中洗脱NoV的关键是打破病毒与基质之间的静电和疏水性作用,洗脱效果与基质表面的形态特征(如粗糙程度等)、基质的组成成分(如果胶、脂肪、酸碱度等)、基质中病毒存在的部位(如内部、外部等)、基质的存在状态(如冷冻、冻干等)等有关[12-13]。病毒洗脱的完整性是病毒颗粒提取的重要前提。硬质果蔬一般采用洗脱液擦拭;软质水果和生食蔬菜多采用切块方式,再通过不同种类的洗脱液进行洗脱。
常用的洗脱液有三(羟甲基)氨基甲烷盐酸-甘氨酸-牛肉浸膏洗脱液(TGBE)、磷酸二氢钾-氯化钠-聚乙二醇辛基苯基醚洗脱液(Tralk)、碳酸氢钠-大豆蛋白洗脱液(SP)等。TGBE洗脱液(0.1 mol/L三(羟甲基)氨基甲烷盐酸、0.05 mol/L甘氨酸,3%牛肉浸膏、pH 9.5),是碱性洗脱液,其中Tris能够保持洗脱液的缓冲能力,甘氨酸用于减少病毒对样品成分的非特异性吸附,TGBE洗脱液使用范围较为广泛,为国际标准化组织的标准采用的方法。Tralk洗脱液,0.05 mol/L磷酸二氢钾、1.0 mol/L氯化钠、0.1%聚乙二醇辛基苯基醚、pH9.2是磷酸盐类型洗脱液的典型代表,亦属碱性洗脱液,常被用来洗脱阴(阳)离子膜上的病毒粒子。SP洗脱液(1 mol/L碳酸氢钠、1%大豆蛋白、pH 8.0)是以碳酸盐为基础的洗脱液,偏中性,可以在样品表面形成气泡,有利于病毒的洗脱,适用于表面不光滑的果蔬表面的病毒洗脱。王飞等[14]以草莓为实验样本,比较了3种洗脱液的洗脱效果,结果表明TGBE缓冲液洗脱草莓表面病毒粒子效果优于Tralk洗脱液,原因可能是草莓是酸性水果,处理过程会释放大量的酸性物质,TGBE洗脱液pH高于Tralk洗脱液。施晓峰等[15]以新鲜蓝莓、草莓、葡萄、番茄、杨梅、生菜、胡萝卜、黄瓜为样本,比较了7种洗脱液,TP ALK(同Tralk)洗脱液、TGBE洗脱液和磷酸缓冲盐洗脱液(PBS)对蓝莓样品表皮感染的病毒中NoV的洗脱效果较为明显,其中TP ALK洗脱液效果最佳,说明在蓝莓表皮洗脱病毒时TP ALK成分在打破阴阳离子膜作用上强于其他洗脱液,再经酶处理后超滤浓缩,NoV的回收率达到较高的水平。此外,管锦绣等[16]以西生菜为样本,比较3种洗脱液,发现牛肉膏-甘氨酸洗脱液的洗脱效果最佳。牛肉膏-甘氨酸洗脱液含3%牛肉膏、0.05 mol/L甘氨酸、pH 9.5,在蔬菜病毒洗脱中采用较多,牛肉膏中的蛋白质与病毒竞争吸附位点,达到洗脱的作用,甘氨酸可以改变病毒的吸附特性,在一定pH条件下,能破坏蔬菜样品基质与病毒颗粒之间的静电吸附、水环境中共存的非水溶性物质之间的相互吸附,从而可以快速、便捷地洗脱病毒粒子。另外有研究报道TGBE中所含的牛肉提取物会干扰分子生物学检测方法,可能引起假阴性结果[17]。果蔬中含有果胶和纤维素,在洗脱液中添加果胶酶和纤维素酶可改善洗脱效果,同时消除基质的抑制作用[18]。
2.2 NoV的富集
NoV病毒常用的富集方法有超滤法、靶向结合法、聚乙二醇(PEG)法和超离心法等[19-20]。超滤法是通过分子筛的作用使大分子病毒粒子截留在膜上而富集。靶向结合法是基于分子互作的靶向病毒富集技术,常用的靶向结合种类包括抗原-抗体结合、病毒-受体结合、筛选特异性的核酸适配体、基于噬菌体表面展示技术筛选特异性的多肽、分子印迹等[21]。PEG法具有强烈的吸水性和沉淀蛋白的作用,通过空间位置的排挤使溶液中的病毒粒子被迫聚集在一起,从而使病毒粒子沉淀富集。超离心法是利用超高的转速使病毒颗粒在离心场中快速沉降富集。李楠等[22]比较了磁珠免疫富集法和PEG法检测草莓中GⅡ型NoV的适用性,结果显示磁珠免疫富集法的回收率略高于PEG法。王飞等[14]以草莓为实验样本,结果表明10%和15%PEG6000/NaCl的富集效果明显好于5%PEG6000/NaCl的富集效果。张其刚等[23]以青葱与葡萄为实验样本,比较猪胃黏蛋白偶联磁珠(PGM-MB)和PEG8000法富集检测NoV的方法,结果表明PGM-MB法更适用于青葱、葡萄中NoV的检测。有研究发现不同基质样品,洗脱和富集的最优方法不相同,如草莓、葡萄、生菜、洋葱中MNV-1的最优洗脱-浓缩方法分别是TGBE洗液-PEG沉淀组合、TGBE洗液-超滤组合、Trallk洗液-PEG沉淀组合和Trallk洗液-超滤组合[24]。Summa等[25]发现超离心法在莴苣和火腿中能获得最高的NoV回收率,而PEG法从树莓中获得最高的NoV回收率。不同洗脱和富集方法的比较见表1。
2.3 核酸提取
洗脱富集后的病毒样本,需要进一步提取病毒RNA,但由于样品基质的不同,需要不同的处理,防止基质成分的影响,降低抑制作用,如加入蛋白酶K、果胶酶、纤维素酶、酚-氯仿、植物RNA分离剂等[26-28]。目前也有一些根据不同产品定制的试剂盒,提高病毒的回收率,降低抑制率。
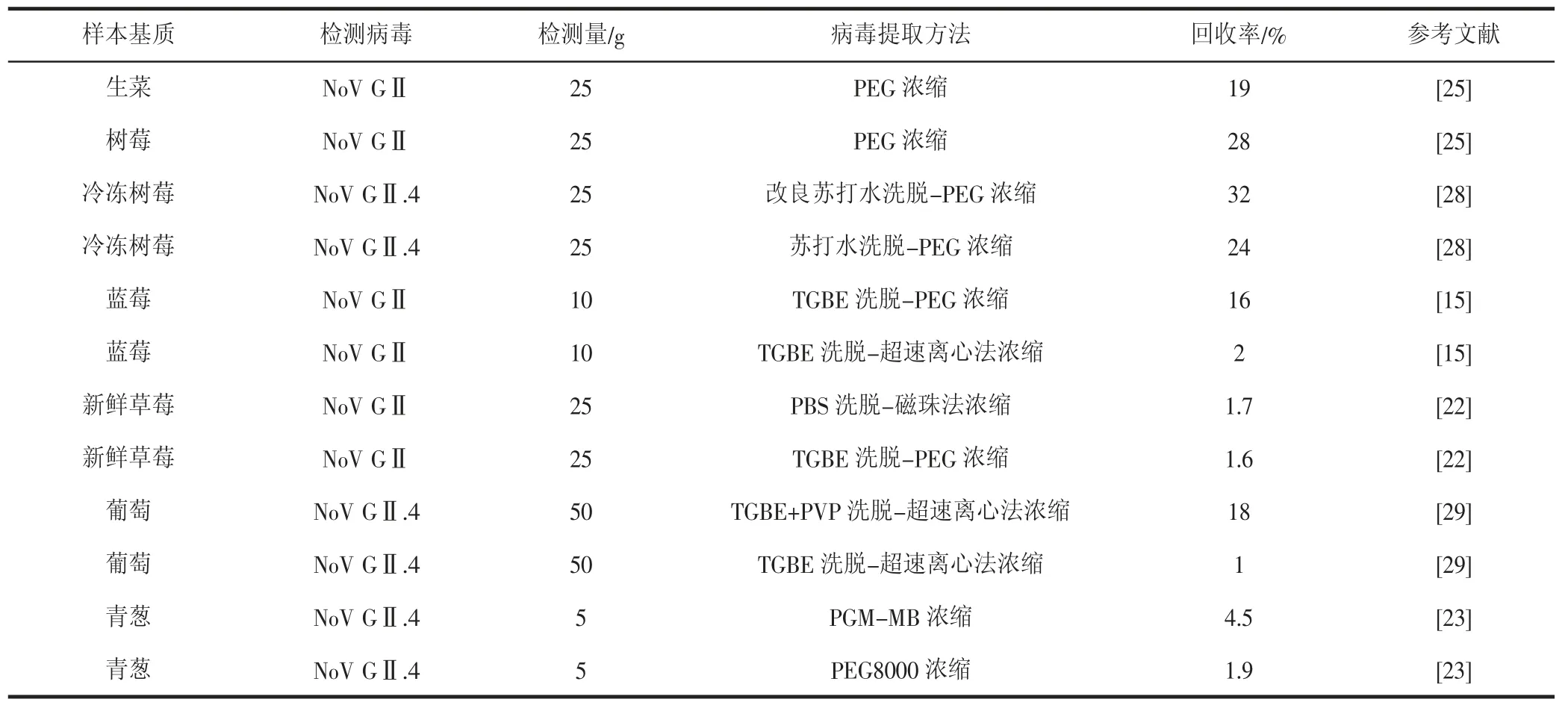
表1 不同病毒提取方法的比较Table 1 Comparison on different extraction methods of virus
3 果蔬中NoV的检验检测方法
目前用于NoV的检测方法主要有电镜法、免疫学法及分子生物学法等[11]。
3.1 电镜法
电镜法的优点是可以直观地观察到病毒颗粒,但设备价格昂贵、操作繁杂,无法广泛普及,也不便于进行大规模流行病学的调查研究;NoV颗粒在电镜下检测结果受主观因素影响较大,检测灵敏度低[29-30]。近年来,电镜技术不断发展,如胶体金免疫电镜技术和免疫吸附电镜技术在病毒检测中不断被应用,使病毒检测的直观性和灵敏性大幅提高。有研究者采用胶体金免疫电镜技术检测植物病毒,以胶体金标记,并用电镜观察,结果表明该方法可以实现对病毒更为准确可靠的检测[31]。
3.2 免疫检测法
免疫检测法是利用抗原抗体反应对病毒进行检测,使用的固相主要是高分子聚合物、微孔板、凝胶或硅胶等,标记物有胶体金、化学发光标记物、酶、荧光标记物等,最低检出率一般可达105拷贝/mL[32]。研究发现NoV的近红外免疫层析法与荧光RT-PCR、胶体金法相比,检测时间短,检测限低于胶体金法。酶联免疫吸附测定主要针对NoV的蛋白质外壳进行检测,但因病毒蛋白的变异性强,导致该方法敏感性、特异性较弱[33]。
总体来看,免疫法检测NoV迅速,价格便宜,便于广泛应用,但由于灵敏度和特异性都欠佳,还不能完全取代分子生物学方法,仅限于初步快速筛查,仍需采用分子生物学检测进行再确认。
3.3 分子生物学检测法
NoV的分子生物学检测方法有普通RT-PCR、实时荧光RT-PCR、微滴数字RT-PCR、逆转录环介导等温扩增法、高通量测序基因芯片、多重RT-PCR、微流体RT-PCR(MF RT-PCR)等[34]。
3.3.1 普通RT-PCR和实时荧光RT-PCR
普通RT-PCR是定性检测NoV的经典方法,特异性和灵敏度均较高,但在电泳过程中容易出现非特异性扩增,造成假阳性结果。实时荧光RT-PCR技术(quantitative real-time PCR,qRT-PCR)是在普通RT-PCR基础上利用染色或探针监测PCR反应管中的荧光信号从而达到定量的目的,是目前国内外检测果蔬中NoV的金标准,该方法通过设计合理的探针引物来提高检测的准确性和灵敏性。qRT-PCR可以检测NoV的基因型,敏感性和特异性要高于普通RT-PCR,能够快速准确定量检测NoV[35],但qRT-PCR无法同时检测多种病毒。多重RT-PCR(multiplex real-time PCR,mRT-PCR)可以在一个反应管中进行多重病毒检测,提高工作效率。高世光等[36]建立的MRT-PCR法,实现了NoV GI、NoV GII和甲肝病毒在同一反应体系中的同时检测,特异性为100%,对于草莓样品中三种病毒的检测灵敏度分别为56.2、31.6、31.4 CCID50/20 g,整个操作过程小于5 h。
3.3.2 微滴数字RT-PCR法
微滴数字PCR(droplet digital real-time PCR,ddRT-PCR)与qRT-PCR定量技术不同,对目标病毒定量无需标准曲线,通过在反应前将体系与微滴产生油混合,由微滴生成仪生成上万个液滴,每个液滴中不包含或包含一个或数个目的核酸,而每个液滴可看作一个PCR,在反应完毕后读取仪将读取液滴的荧光强度与液滴数目,根据泊松分布从而进行拷贝数定量的技术[37]。
ddRT-PCR是近年来新兴的绝对定量检测技术,又称第三代PCR技术,此方法逐渐被国内外标准方法采纳。研究发现ddRT-PCR的最低检测限为个位,在不同浓度人工染毒生菜和西生菜样品中,灵敏性、重复性良好,抑制物的存在对ddRT-PCR回收率没有显著影响[38]。有报道采用ddRT-PCR检测莴苣和草莓中NoVI、II基因群(NoV GI和NoV GII),最低检测浓度分别为4.68、8.47拷贝/μL,特异性、敏感性、重复性和稳定性均好于qRT-PCR,并有效避免假阴性[39]。
3.3.3 逆转录环介导等温扩增法
逆转录环介导等温扩增(reverse transcription loop-mediated isothermal amplification,RT-LAMP)是一种直观的核酸检测方法,全程恒温,其反应液中含有大量的甜菜碱,在60~65 ℃时,DNA双链处于动态平衡中,有利于引物与靶序列的结合,在DNA聚合酶的作用下,通过自我循环合成大量目的DNA,并产生白色沉淀,以浑浊度判定结果,这种检测方法具有更高的灵敏度,且成本更低,设备简单,可以在NoV暴发期间或在现场开展检测[40]。目前该项技术已在水产品NoV检测中使用,有待进一步在果蔬产品中应用,有研究发现在检测牡蛎和缢蛏中的NoV方面,RT-LAMP较qRT-PCR的检测灵敏度低10倍,且检测低限相当[41]。
3.3.4 高通量测序法
高通量测序(high-throughput sequencing,HTS)也称为第二代基因测序技术(next generation sequencing,NGS),以能一次对几十万到几百万条DNA分子进行序列测定和一般读长较短等为标志,操作包括样品准备、文库构建、测序反应、数据分析4个阶段[42],有别于PCR方法的扩增片段小,探针引物依赖强、感染性与非感染性不易辨别的局限性。该方法具有通量高、速度快、成本低、准确性高等特点,广泛应用于生物的基因组学、转录组学等研究领域。
Fumian等[43]采用HTS方法在未经处理的污水中观察到了NoV的高遗传多样性,并获得了环境样本中循环基因型更详细的图像。Yang等[44]以芹菜为试验材料,采用HTS技术检测低拷贝的NoV,利用Illumina MiSeq平台进行优化,无需扩增,即可进行文库生成和测序,采用qRT-PCR方法对病毒RNA的分离和回收进行确认,成功检测出低拷贝(<103拷贝)的病毒株或物种混合物中的NoV。
3.3.5 基因芯片检测法
基因芯片检测法是指将大量(通常每1 cm2点阵密度高于400)探针分子固定于支持物上,与标记的样品分子进行杂交,通过检测每个探针分子的杂交信号强度,进而获取样品分子的数量和序列信息[45]。基因芯片检测法是一种全新的病毒检测方法,具有高通量、高敏感性、检测速度快等优点。此技术中不仅有化学染料技术、激光技术,还有半导体微电子、分子生物学等技术,为信息科学与生命科学的深度融合建立了桥梁。
有学者采用基于磁珠的可视化基因芯片通过链霉亲和素与生物素的亲和作用,进行核酸杂交检测,杂交结果以肉眼或普通显微镜观测NoV的存在情况,该方法便捷、灵敏性高[46]。Chung等[47]采用液相基因芯片和静电吸附技术,快速检测到牡蛎中的NoV,该技术尚未在果蔬产品中应用。何雅青等[48]采用多重PCR扩增方法,将PCR产物与偶联核酸探针的微球混合物进行杂交,利用Luminex 200液相芯片检测仪检测杂交结果,可同时检测A型轮状病毒、GⅠ型NoV和GⅡ型NoV。
4 展望
因食用感染NoV的果蔬产品而感染疾病已成为全球重要的公共卫生问题之一,相关报道也越来越多,有关果蔬中NoV的检验方法研究不断多元化、深入化,从便利性、快捷性、准确性等方面都有所突破,国内外相关的食源性NoV检验标准方法也在不断更新和改善。尽管如此,针对果蔬基质的特殊性,尤其是诸如果蔬的沙拉等复杂基质产品,加之一般属于低剂量病毒感染,检测方法的回收率、基质的抑制率、检测的质量控制都需要进一步创新研究。
果蔬的安全来源于良好的种植环境、规范的生产作业、标准的运输配送,因此建立良好的全产业链果蔬追溯管理体系,做好源头和过程的管理与监控,是避免NoV感染的重要保障。在此基础上,建立果蔬的快速检测体系和精准检测系统,做到预防和监控双保险,能有效防止果蔬感染NoV,避免爆发病毒感染事件。

