2型糖尿病患者血清TNF-α水平与糖尿病肾脏疾病相关性研究
黄若妃 陈天喜 陈娟 夏静瑶 陈福宇

[摘要] 目的 探討2型糖尿病患者外周血中TNF-α水平与糖尿病肾脏疾病的相关性以及外周血TNF-α水平用于糖尿病肾脏疾病患者早期诊断的临床价值。 方法 选择2018年9月至2019年9月永康市第一人民医院就诊的DKD患者50例,设为糖尿病肾脏疾病组(DKD组),并根据患者尿白蛋白/尿肌酐将DKD患者分为微量蛋白尿组(n=32)、大量蛋白尿组(n=18),选同期T2DM不合并DKD患者200例,设为单纯糖尿病组(T2DM组)。检测并比较分析两组患者UACR、肾小球滤过率,检测并分析T2DM组患者和DKD组患者以及DKD患者两个亚组间TNF-α水平差异,采用 Pearson或Spearman分析外周血TNF-α与eGFR或UACR的相关性,采用 Logistic 多元回归分析法分析TNF-α水平与DKD的关系,最后绘制ROC曲线分析TNF-α、eGFR或UACR用于DKD诊断的特异性和敏感性。 结果 DKD组血清TNF-α水平高于T2DM组患者,且大量蛋白尿组血清TNF-α水平高于微量蛋白尿和单纯糖尿病组;TNF-α高水平是 DKD 的高危因素;血清TNF-α分别与 UACR 呈正相关(P<0.05),与 eGFR 呈负相关。ROC曲线分析显示,外周血TNF-α水平检测DKD的曲线下面积为 0.893,95%可信区间为0.675~1.000,敏感性和特异性分别为81.3%和89.3%,高于eGFR或UACR检测DKD的敏感性(73.4%,75.1%)和特异性(80.1%,83.5%)。 结论 TNF-α可能参与DKD进程,在DKD病情变化中发挥重要作用,并在一定程度上反映肾小球滤过率,可作为 DKD 早期诊断的指标。
[关键词] 2型糖尿病;糖尿病肾脏疾病;肿瘤坏死因子α;蛋白尿
[中图分类号] R587.2 [文献标识码] A [文章编号] 1673-9701(2021)04-0030-04
Study of correlation between serum TNF-α level and diabetic kidney disease in patients with type 2 diabetes mellitus
HUANG Ruofei CHEN Tianxi CHEN Juan XIA Jingyao CHEN Fuyu
Department of Endocrinology, the First People′s Hospital of Yongkang City in Zhejiang Province, Yongkang 321300, China.
[Abstract] Objective To explore the correlation between TNF-α level in peripheral blood and diabetic kidney disease(DKD) in patients with type 2 diabetes mellitus(T2DM) and the clinical value of TNF-α level in peripheral blood in early diagnosis of DKD. Methods A total of 50 patients with DKD admitted to the First People′s Hospital of Yongkang from September 2018 to September 2019 were selected as DKD group. According to urinary albumin and creatinine, patients with DKD were divided into microalbuminuria group(32 cases) and massive proteinuria group(18 cases). A total of 200 T2DM patients without DKD were selected as simple diabetes group. Urine Albumin-to-Creatinine Ratio(UACR) and glomerular filtration rate were detected and compared between the two groups. The differences of tumor necrosis factor-α(TNF-α) level between T2DM patients, DKD patients and DKD patients in two subgroups were detected and analyzed. Pearson or Spearman was used to analyze the correlation between TNF-α in peripheral blood and eGFR or UACR. Multiple Logistic regression analysis was used to analyze the relationship between TNF-α level and DKD. Finally, ROC curve was drawn to analyze the specificity and sensitivity of TNF-α, eGFR or UACR in the diagnosis of DKD. Results The serum TNF-α level in DKD group was higher than that in T2DM group, and the serum TNF-α level in massive proteinuria group was higher than that in microalbuminuria and simple diabetes group. The high level of TNF-α was a high-risk factor of DKD. Serum TNF-α was positively correlated with UACR(P<0.05) and negatively correlated with eGFR. ROC analyses showed that the area under the curve of peripheral blood TNF-α in the detection of DKD was 0.893, and the 95% confidence interval was 0.675-1.000. The sensitivity and specificity were 81.3% and 89.3%, respectively, which were higher than those of eGFR(sensitivity: 73.4%; specificity: 80.1%) or UACR(sensitivity: 75.1%; specificity: 83.5%). Conclusion TNF-α may participate in the process of DKD, playing an important role in the change of DKD, and reflecting glomerular filtration rate to a certain extent, which can be used as a method for early diagnosis of DKD.
[Key words] Type 2 diabetes mellitus; Diabetic kidney disease; Tumor necrosis factor alpha; Proteinuria
糖尿病肾脏疾病(Diabetic kidney disease,DKD)是糖尿病患者常见的微血管并发症之一,也是糖尿病发病和糖尿病相关死亡的关键原因之一,研究指出40%~50%的1型糖尿病(Type 1 diabetes,T1DM)或2型糖尿病(Type 2 diabetes,T2DM)患者最终都会发展为DKD[1-3]。此外,DKD也是诱发终末期肾病(End-stage renal disease,ESRD)的主要原因之一,通過诱发ESRD而导致患者严重的肾脏损伤和肾功能障碍,进而导致患者的不良预后和死亡率的升高[4]。流行病学统计指出,中国糖尿病患者中DKD的发病率高达52.2%,DKD已成为严重的公共健康问题,严重影响人民健康。然而,目前DKD的治疗选择有限,并且DKD的进展不可逆[5]。因此,迫切需要鉴定特定的生物标志物以检测T2DM患者的早期肾功能下降,从而及早地采取干预和治疗措施以提高患者生存率,改善患者预后。
DKD的发生和发展与多种因素有关,包括种族易感性和遗传、代谢异常、生长因子和各种细胞因子分泌异常,近年来,研究人员已经广泛研究各种细胞因子对DKD进程的影响[6]。文献指出,肿瘤坏死因子α(Tumor necrosis factor α,TNF-α)的增加在DKD的发生发展中具有重要作用,其过度表达分泌可引起异常的炎症反应,进而导致内皮功能障碍和肾脏纤维化增加[7],然而TNF-α水平用于DKD患者的早期诊断价值及其与UACR和肾小球滤过率(Glomerular filtration rate,eGFR)的相关性分析却少见报道,因此,本文选择2018年9月至2019年9月永康市第一人民医院就诊的DKD患者和单纯糖尿病患者进行外周血TNF-α水平测定和统计分析,旨在探讨2型糖尿病患者血清TNF-α水平与DKD的相关性以及TNF-α水平用于DKD患者早期诊断的临床价值,从而为临床DKD 的早期预防提供新思路。
1 资料与方法
1.1一般资料
选择2018年9月至2019年9月我院就诊的DKD患者50例,设为糖尿病肾脏疾病组(DKD组),男32例,女18例,年龄27~73岁,平均(53.14±4.68)岁,平均病程(6.13±1.12)年,平均体质量指数(Body mass index,BMI)(21.98±1.72)kg/m2;平均心率(63.69±2.85)次/min,平均血红蛋白(13.83±1.96)g/dL。本研究已通过永康市第一人民医院医学伦理委员会批准,且所有患者均同意并签署知情同意书。
纳入标准:①符合2017版中国2型糖尿病防治指南诊断标准[8];②依靠饮食控制或使用糖尿病药物;③病程>5年;④年龄>18岁;⑤患者愿意签署知情同意书,可以配合完成后续检测;⑥对主观感受可进行描述并可阅读。
排除标准[9]:①其他肾病史;②合并自身免疫疾病或免疫抑制状态;③eGFR<60 mL/(min·1.73 m2);④合并恶性肿瘤;⑤严重肝功能损伤、感染等其他可引起TNF-α水平升高的疾病;⑥孕妇以及哺乳期妇女;⑦肌酐(Creatinine,Cr)>130 μmol/L。
选择同期T2DM不合并DKD患者200例,设为单纯糖尿病组(T2DM组),男132例,女68例,年龄29~79岁,平均(56.21±4.96)岁,平均病程(6.38±1.72)年,平均BMI(21.34±2.13)kg/m2,平均心率(65.18±3.21)次/min;平均血红蛋白(12.19±1.82)g/dL。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
①指导患者收集晨尿5 mL,采用全自动生化分析仪(罗氏c701)测定患者UACR,UACR=mAlb/肌酐(Cr),并根据肾脏疾病(MDRD)公式估算eGFR:eGFR[mL/(min·1.73 m2)]=175×Cr-1.234×年龄-0.179×0.79[9]。②抽取患者肘静脉血5 mL置于EP管中,加入枸橼酸钠抗凝剂5 μL(百奥莱博有限公司,中国),4℃,1000 r离心5min,抽取上层血清于EP管,按照试剂说明书,使用酶联免疫吸附法检测两组患者血清样本中TNF-α水平,所用试剂盒购自浙江格鲁斯特生物科技有限公司(中国),使用酶标仪(百奥莱博公司,中国)检测吸光度值,并根据标准曲线计算外周血TNF-α浓度。
1.3 统计学方法
采用 SPSS 19.0统计学软件进行数据处理分析,计量资料以均数±标准差表示,组间比较采用t检验。采用 Pearson或Spearman分析外周血TNF-α与eGFR或UACR的相关性,采用 Logistic 多元回归分析法分析TNF-α水平与DKD的关系,绘制ROC曲线分析TNF-α、eGFR或UACR用于DKD诊断的特异性和敏感性。P<0.05为差异有统计学意义。
2 结果
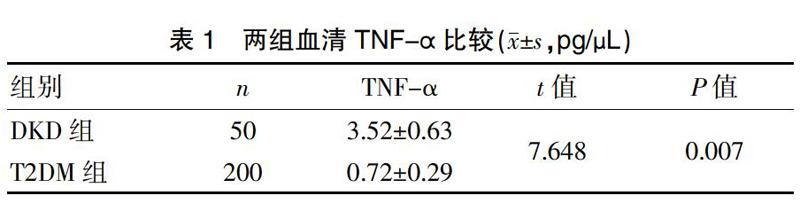
2.1 两组血清TNF-α比较
DKD组血清TNF-α明显高于T2DM组(P<0.05)(表 1)。
2.2血清 TNF-α水平与UACR及eGFR相关性
血清 TNF-α水平与UACR呈显著正相关(P<0.05),与eGFR呈显著负相关(P<0.05)(表2)。
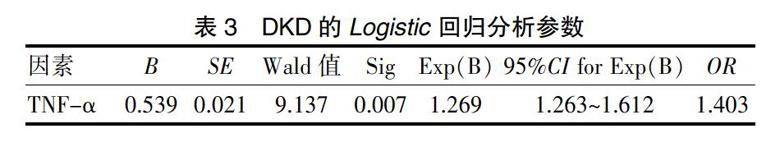
2.3 Logistic回归分析
以TNF-α水平为自变量,DKD发生情况为因变量,进行Logistic回归分析:TNF-α<100 ng/mL=0,TNF-α≥100 ng/mL=1。结果显示,TNF-α高水平(OR=1.403,95%CI=1.263~1.612)是 DKD 的高危因素(P<0.05)(表3)。
2.4 微量蛋白尿和大量蛋白尿患者基线资料和外周血TNF-α水平比较
大量蛋白尿组患者外周血TNF-α水平明显高于微量蛋白尿组患者(P<0.05),而其年龄、病程、BMI、HOMA-IR等一般资料差异无统计学意义。见表4。
2.5 外周血TNF-α水平对DKD的诊断价值
ROC曲线分析显示,外周血TNF-α水平检测DKD的曲线下面积为 0.893,95%可信区间为0.675~1.000,敏感性和特异性分别为81.3%和89.3%,高于eGFR或UACR检测DKD的敏感性(73.4%,75.1%)和特异性(80.1%,83.5%)(封三图4和表5)。
3讨论
随着饮食习惯和生活方式的改变,近年来全球糖尿病的发病率快速上升,目前,全球约有4.15亿糖尿病患者,而糖尿病发病率的快速上升导致包括DKD在内的多种糖尿病相关并发症迅速增加。近年来研究指出,DKD与糖尿病患者心血管相关死亡风险的增加以及ESRD的发生密切相关,糖尿病患者的心血管死亡风险比非糖尿病人群约高出2倍,而DKD则会进一步增加糖尿病患者的心血管死亡风险,此外,与单纯糖尿病患者相比,DKD诱导的ESRD患者3年生存率降低约13%,死亡风险增加1.4~1.8倍,随着ESRD持续时间的增加,DKD患者死亡风险愈大[10-11]。研究指出,在DKD发病过程中多存在肾小管间质损伤,进而导致蛋白尿的形成,而全世界约35%的DKD患者临床表现出微量白蛋白尿,因此目前临床多采用微量白蛋白尿和UACR检测早期DKD[12-14]。但是,近年来研究表明,无蛋白尿的患者也可能会发生糖尿病肾脏疾病的典型组织病理学改变,表明以尿白蛋白作为早期DKD患病的鉴定标准存在一定局限性,而UACR测定容易受到包括尿路感染、高血糖、发热、血尿、剧烈运动以及月经在内的多种因素的影响[15-16]。因此,迫切需要用于提高DKD早期诊断特异度和敏感度的生物标志物以提高DKD早期诊断准确度,从而采取干预措施预防DKD发作,进而阻止由糖尿病流行引起的全球经济和健康问题。
以往研究多认为,糖尿病肾脏疾病为非免疫性疾病,但是近年来的研究发现,巨噬细胞浸润增加以及炎症细胞因子分泌异常在DKD发病中发挥重要作用。参与DKD发病机制的主要介质有TNF-α、C反应蛋白(C-reactive protein,CRP)、白介素-1(Interleukin-1,IL-1)和白介素-6(Interleukin-6,IL-6)等。TNF-α主要由巨噬细胞和单核细胞产生,多种生物作用导致不良反应[17-19]。研究指出TNF-α可以通过包括胞内磷脂酰肌醇激酶/蛋白激酶B,两面神激酶/信号传导及转录激活蛋白3以及Hippo信号转导在内的多条信号转导通路影响胰岛素分泌并诱导胰岛素抵抗,损伤肾小球膜和肾小球细胞进而导致T2DM中肾损害的发生,促进DKD的发展[20-21]。此外,TNF-α还在炎症过程中发挥关键作用,而炎症过程是导致肾小管间质和肾小球损害的重要病理机制之一[22]。研究指出肾小球滤过率和肾小球血流量的变化取决于TNF-α引起的血管舒张介质和血管收缩介质之间的平衡状态[23]。尿液中TNF-α的快速排泄可导致嗜中性粒细胞趋化因子和淋巴细胞的分泌和合成增加,从而导致血清TNF-α浓度的升高,进而提高内皮的通透性并诱导内皮促凝活性,最终参与糖尿病肾损伤的进展,此外,尿液中TNF-α的浓度增加还可刺激钠的吸收,导致肾脏肥大和钠潴留,导致早期DKD的典型改变[24-26]。本研究发现DKD组血清TNF-α明显高于T2DM组(P<0.05),TNF-α高水平是 DKD 的高危因素(P<0.05),提示TNF-α的浓度可反映肾脏功能,且与DKD的发生和发展密切相关。此外,亚组分析表明,在蛋白尿水平不同的DKD患者两个亚组中,大量蛋白尿组患者外周血TNF-α水平高于微量蛋白尿组患者,差异有统计学意义(P<0.05)。
综上所述,本研究表明在DKD患者外周血中TNF-α的表达浓度显著升高,且大量蛋白尿组患者外周血TNF-α水平高于微量蛋白尿组患者,Logistic 回归分析显示TNF-α水平升高是DKD的高危因素。此外,外周血TNF-α水平检测DKD的敏感性和特异性高于eGFR或UACR检测DKD的敏感性和特异性。本研究提示TNF-α可能参与DKD进程,在DKD病情变化中发挥重要作用,而其作为血清标志物用于DKD早期诊断具有重要临床价值。但是,本研究也存在一定局限性,由于样本量不足和DKD机制的复杂性和不确定性,细胞因子TNF-α与发病机制的相关性及其具体作用机制需要进一步研究和临床证实。
[参考文献]
[1] 郑文,潘少康,刘东伟,等.糖尿病肾病治疗进展[J].中华肾脏病杂志,2020,36(6):476-480.
[2] 趙雪杉,安至超,柳红芳,等.芪地糖肾颗粒对糖尿病肾病大鼠模型炎症因子IL-6、IL-18、TNFα、CRP的影响[J].中国中西医结合肾病杂志,2020,21(1):8-11.
[3] Maheshwari Rajesh,Balaraman Ramachandran,Sen Ashim Kumar,et al. Effect of concomitant administration of coenzyme Q10 with sitagliptin on experimentally induced diabetic nephropathy in rats[J]. Renal Failure,2017,39(1):87-93.
[4] 王倩.尿液炎性因子与肿瘤坏死因子-α检测在糖尿病肾病患者中的应用价值[J].医学理论与实践,2019,32(21):3528-3529.
[5] Jian Wu,Xiaohong Shao,Kan Lu,et al. Urinary RBP and NGAL levels are associated with nephropathy in patients with type 2 diabetes[J]. Cellular Physiology and Biochemistry,2017,42(2):68-73.
[6] 赵延香.早期糖尿病肾病患者血清TNF-α、IL-6的变化及其与尿白蛋白/肌酐的相关性分析[J].中国医学创新,2020,17(4):121-124.
[7] Saideh Fakharzadeh,Hassan Argani,Peyman Mohammadi Torbati,et al. DIBc nano metal-organic framework improves biochemical and pathological parameters of experimental chronic kidney disease[J]. Journal of Trace Elements in Medicine and Biology,2020,61(2):42-57.
[8] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2017年版)[J].中国实用内科杂志,2018,38(4):292-344.
[9] 陈燕,钟静,董加宝.尿微量白蛋白联合血清碱性磷酸酶、胱抑素C水平与早期2型糖尿病肾病的相关性研究[J].中国医刊,2020,55(7):740-743.
[10] Xiao Ling,Luo Dan,Pi Pei,et al. Up-regulation of miR-135b expression induced by oxidative stress promotes the apoptosis of renal tubular epithelial cells under high glucose condition[J]. Clinical and Experimental Pharmacology &Amp;Physiology,2020,47(8):74-79.
[11] Juyu Cai,Bin Liu,Tingting Guo,et al. Effects of thromboxane prostanoid receptor deficiency on diabetic nephropathy induced by high fat diet and streptozotocin in mice[J]. European Journal of Pharmacology,2020,882(4):239-246.
[12] 樊华英,刁红杰,成兴波,等.血清脂肪分化相关蛋白水平与2型糖尿病合并非酒精性脂肪肝的相关性[J].中华糖尿病杂志,2019(12):799-802.
[13] 徐将. SIRT1/FOXO1介导的自噬对糖尿病肾病的影响及二甲双胍作用机制研究[D].济南:山东大学,2019.
[14] 刘新磊,宋卫敏,高志强,等.抑制miR-200c表达对糖尿病肾病大鼠肾组织的保护作用及机制研究[J].中国临床解剖学杂志,2019,37(6):668-672.
[15] 庞欣欣,石秀杰,张雅歌,等.通络地龟汤治疗2型糖尿病肾病Ⅳ期患者的临床疗效研究[J].中国全科医学,2020,23(30):3846-3850.
[16] 冉敏,黄笠.序贯血液透析滤过结合血液灌流治疗糖尿病肾病患者维持性血透患者的效果[J].中国现代医学杂志,2019,231(10):1-9.
[17] 陈琰,白倩,蔡妍,等.2型糖尿病患者血清ChREBP水平与糖尿病肾病的相关性[J].中国现代医学杂志,2019(12):21-26.
[18] Yacheng Xiong,Wei Zhu,Qian Xu,et al. Sleeve Gastrectomy Attenuates Diabetic Nephropathy by Upregulating Nephrin Expressions in Diabetic Obese Rats[J]. Obesity Surgery: The Journal of Metabolic Surgery and Allied Care,2020,30(4):118-125.
[19] Xu Erdi,Yin Chunyan,Yi Xiaoqing,et al. Knockdown of CTRP6 inhibits high glucose-induced oxidative stress,inflammation and extracellular matrix accumulation in mesangial cells through regulating the Akt/NF-κB pathway[J]. Clinical and Experimental Pharmacology &Amp;Physiology,2020,47(7):439-447.
[20] 冯天保,陈灯德,王倩,等.糖肾安对糖尿病肾病炎症因子影响的临床研究[J].中国实验方剂学杂志,2018,78(16):320-323.
[21] Xu Xinwei,Pan Xiaojing,Li Song. Prospective analysis of the efficacy of beraprost sodium combined with alprostadil on diabetic nephropathy and influence on rennin-angiotensin system and TNF-α[J]. Experimental and Therapeutic Medicine,2020,19(1):13-21.
[22] Yang Huimin,Xie Tingting,Li Dengren,et al. Tim-3 aggravates podocyte injury in diabetic nephropathy by promoting macrophage activation via the NF-κB/TNF-α pathway[J]. Molecular Metabolism,2019,23(6):35-42.
[23] 高利超,徐兵,劉永安,等.三七皂苷R1抑制TGF-β1/Smad3信号传导对糖尿病肾病大鼠肾脏纤维化和炎症细胞因子的调节作用研究[J].中国免疫学杂志,2020, 36(10):1188-1193.
[24] 肖伟伟,奚悦.白藜芦醇对糖尿病肾病大鼠Wnt/β-catenin和TGF-β1-Smad2/3信号通路的影响[J].中成药,2019,41(12):3033-3038.
[25] 石磊,向海燕,朱玲华.小檗胺对糖尿病肾病大鼠肾损伤和炎性细胞因子产生的影响[J].免疫学杂志,2020, 36(7):599-605.
[26] 王婷婷. 糖尿病患者血清高尿酸水平与糖尿病肾病发生、进展的关系研究[D].上海:上海交通大学,2019.
(收稿日期:2020-00-00)

