辣椒抗疫病基因初步定位
张 曦,王秀雪,邹春蕾
(辽宁省农业科学院蔬菜研究所,沈阳110161)
辣椒疫病(Phytophthora blight)是由辣椒疫霉菌(Phytophthora capsiciLeonian)侵染的土传性病害,自首次在美国发现以来,已在全球多个国家和地区辣椒种植区发生,成为威胁全球辣椒生产主要病害[1-3],如何防控成为辣椒生产亟待解决的问题。目前,辣椒疫病防控主要从栽培管理、化学防治和种植抗病品种等方面开展[4-5],由于灌溉使辣椒疫霉菌在土壤中转移,疫病一旦发生较难根除[6],加之疫霉菌繁殖能力高,对杀菌剂不敏感,同时长期使用化学药物加重环境污染,因此种植抗病品种是防治辣椒疫病最经济且有效措施。
目前,辣椒疫病抗源主要包括CM334、PI201234和Perennial,已利用这些抗源材料找到部分辣椒抗疫病基因QTL。Thabuis等利用3种抗疫病材料将主效抗性基因定位于5号染色体,Phyto5.1和Phyto5.2两个位点可解释超过60%表型变异[7];Bonnet等利用CM334和‘Yolo Wonder’构建重组自交系群体将Pc-5.1和Pc-5.2两个主效QTL位点定位在5号染色体上[8];Minamiyama等以CM334为亲本构建定位群体,使用辣椒疫霉菌不同生理小种和不同接菌浓度将主要抗性QTL位点定位在5号染色体上[9-11];Mallard等将已报道定位到辣椒遗传图谱中QTL位点作元分析,整合到辣椒第5号染色体3个抗性QTL位点,分别为MetaPc5.1、MetaPc5.2和MetaPc5.3,其中MetaPc5.1对疫病抗性贡献率最高[12];Wang等利用辣椒疫霉菌2号生理小种对以PI201234为亲本构建的F2分离群体作遗传分析,将抗性基因定位在辣椒5号染色体1.08 Mb区域内(Chr05:29,097,205-30,177,879)[13];而Xu等以CM334和NMCA10399为亲本构建定位群体将PhR10基因定位在10号染色体长臂末端2.57 Mb范围内,找到一个新辣椒抗疫病基因位点[14];Muhammad等结合GWAS对构建的RIL群体测序,在辣椒5号染色体3个QTL位点分别找到15、20、28个辣椒抗疫病候选基因[15]。另外,利用同源克隆方法也发掘部分辣椒抗疫病相关基因,如病程相关蛋白(CaPR1、CAPR4)、防 御 相 关 基 因(CaChi3、CaODC1、CaOSM1、CaCYP450A、CaPOD)等,为揭示辣椒抗疫病分子机理提供理论依据。
由于不同抗源对疫病抗病性不同,加之辣椒疫霉菌生理小种选择和病原菌接菌条件等因素影响,辣椒抗疫病基因定位研究较复杂,研究结果存在差异。通过调查辽宁省辣椒生产情况,张里等明确辽宁省辣椒疫霉菌优势小种为3号生理小种[16],抗3号生理小种辣椒抗源材料对1号和2号生理小种也具有抗性,同时3号生理小种也是广东、重庆、山西、内蒙古、青海等省优势小种[17-19]。针对辣椒生产上遇到的实际问题,课题组利用接菌鉴定和高代自交结合方式获得对辣椒疫霉菌3号生理小种完全免疫品系ZCM334。
本研究以ZCM334作为抗源,构建辣椒抗疫病基因定位群体,选取BC1F1抗、感疫病分离群体分别构建极端性状混池测序,采用SLAF-BSA开展辣椒抗疫病基因初步定位,为继续挖掘辣椒抗疫病基因奠定基础,同时为培育辣椒抗疫病新品种提供理论支撑。
1 材料与方法
1.1 植物材料与群体构建
前期对亚蔬-世界蔬菜中心高抗疫病材料CM334接菌鉴定,多代自交后获得对辣椒疫霉菌3号生理小种免疫的高代自交系材料ZCM334,该材料对辣椒疫病表现完全免疫,本研究以免疫材料ZCM334为父本,以感病品种Early Calwonder为母本,杂交获得F1代后,自交得到F2代,同时F1代与感病母本Early Calwonder回交得到BC1F1代。利用得到的各世代群体作抗病性鉴定和遗传分析,其中BC1F1代作为辣椒抗疫病基因初步定位群体用于SLAF-BSA测序。
1.2 辣椒疫霉菌培养与接菌方法
本研究采用辣椒疫霉菌3号生理小种ZY14由辽宁省农业科学院植物保护研究所园艺病害研究室刘长远研究员提供。首先对ZY14复壮和扩繁后,转至V8培养基中28℃培养7 d;待菌丝长满培养皿后,将培养基切成2 cm3小块,转移至无菌水中浸泡3 d;产孢后置于10℃培养箱中1 h促进孢子释放,24℃环境条件下30 min后使用血球计数板计算孢子浓度,加无菌水稀释辣椒疫霉菌孢子浓度至2 000个孢子·mL-1。
将种植于穴盘、长至4~6片真叶辣椒植株转移至人工气候室内,采用灌根接菌法对辣椒植株接菌,用注射器在每个植株根部土壤中注入5 mL游动孢子悬浮液,接种后保持环境温度为25~28℃,土壤相对湿度>90%。
1.3 辣椒抗疫病性状鉴定和遗传分析
对免疫亲本ZCM334、感病亲本Early Calwonder、正反交F1代、回交BC1F1代和F2代群体接菌鉴定,以感病亲本Early Calwonder为对照,在感病对照全部发病时调查各世代群体感病植株个数,感病植株发病症状为植株根茎部变黑并发生缢缩、植株萎蔫,与感病亲本表现一致,根据调查结果对辣椒抗疫病性状作遗传分析。
1.4 混池构建与DNA提取
为确保所有植株全部接菌成功,并保证准确筛选出抗、感植株用于构建极端性状混池,本研究采用二次接菌,首先在感病对照全部发病时对感病个体取样,从中选取100个单株构建极端感病混池,接下来将剩余未表现发病症状植株个体第2次接菌,同样设置抗、感病对照,在第2次接菌10 d后对仍表现抗病个体取样,从中选取100个单株构建极端抗病混池。采用CTAB法分别提取两个混池各单株,利用Nanodrop 2000测定DNA浓度等量混合。免疫亲本ZCM334、感病亲本Early Calwonder、抗病池和感病池共计4个样品送交北京百迈客生物科技有限公司作SLAF-seq测序。
1.5 SLAF文库构建及测序数据分析
选择已测序完成辣椒CM334基因组(2 753.50 Mb)为参考基因组,根据选定最适酶切方案,对检测合格各样品基因组DNA分别酶切。对得到酶切片段(SLAF标签)3′端加A处理、连接Dual-index4测序接头、PCR扩增、纯化、混样、切胶选取目的片段,文库质检合格后用Illumina HiSeqTM2500测序。利用Dual-index对测序得到原始数据作识别,得到各样品reads。过滤掉测序reads接头后,通过将reads与参考基因组比对,在亲本和混池中开发SLAF标签,寻找在亲本中存在多态性SLAF标签和有reads覆盖区域SNP。SNP检测主要使用GATK软件工具包实现。
1.6 辣椒抗疫病基因初步定位
将测序得到的SNP作关联分析,获得与性状紧密关联位点,并根据关联阈值确定候选区域,使用BLAST软件对候选区域内基因分别与NR、SwissProt、GO、COG、KEGG数据库比对,作基因功能注释和生物通路富集分析。
2 结果与分析
2.1 ZCM334抗辣椒疫病遗传分析
对各世代群体植株灌根接菌后发现,感病对照在接菌后第5天全部发病,因此将接菌后第5天作为调查植株抗病性时间点;在此时间点统计各世代材料发病情况,结果表明,免疫亲本ZCM334对辣椒疫霉菌3号生理小种完全免疫,而感病亲本Early Calwonder则全部发病死亡(见图1);F1植株全部抗病,表明ZCM334对辣椒疫病抗性由1对显性基因控制;调查BC1F1群体中抗病植株685株,感病植株643株;F2株系抗病植株441株,感病植株162株。经卡平方检验可知,BC1F1分离群体符合1∶1分离比例(χ2=1.27<χ20.05=3.84),而F2群体也同样符合3∶1分离比(χ2=1.02<χ20.05=3.84)(见表1),说明ZCM334对辣椒疫病抗性由一对主效基因控制。

图1 各世代群体接菌5 d时发病情况Fig.1 Incidence of the populations on the 5th day after inoculation
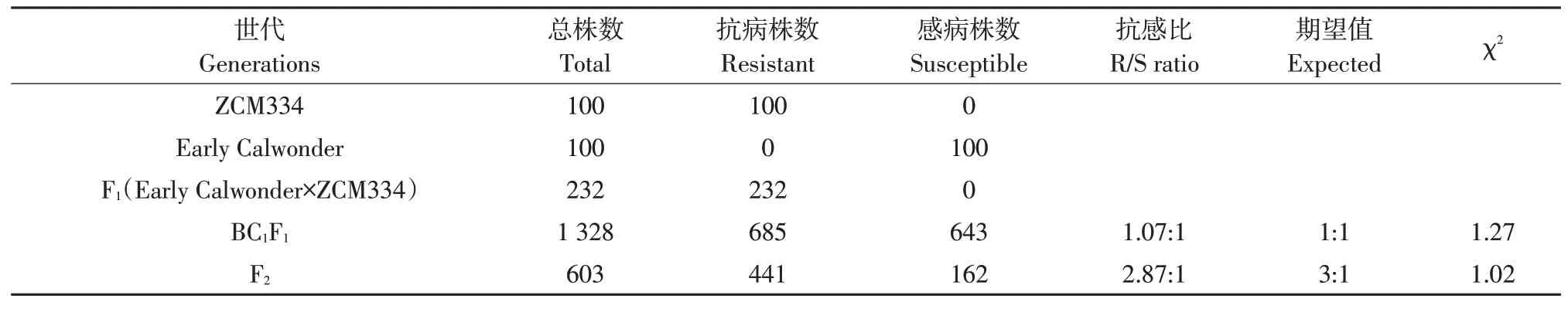
表1 辣椒抗、感疫病亲本和各世代群体遗传分析Table 1 Genetic analysis of resistant parent,susceptible parent and populations in pepper
2.2 辣椒抗疫病基因初步定位分析
通过SLAF-seq技术对抗病父本(P)、感病母本(M)、抗病混池(aa)和感病混池(ab)测序,共开发SLAF标签153 471个,其中父本和母本标签数分别为140 533和141 870个,测序平均深度为35.06x;抗病混池和感病混池分别为153 454和153 067个,混池测序平均深度为131.78x(见表2)。使用GATK软件工具包实现SNP检测,共得到638 011个SNP,在SNP-index关联分析前,先对638 011个SNP位点过滤,过滤掉307个有多重突变SNP位点,391 435个混池间一致SNP位点,155 816个混池中read支持度小于4位点,27 838个亲本中不存在SNP位点,最终获得62 615个高质量可信SNP位点。采用SNPNUM方法对△SNP-index拟合,取每个SNP附近200个SNP的△SNP-index中值作为该位点拟合后关联值。经SNP-index关联分析确定目标基因候选区域在辣椒第5号染色体5.1 Mb范围内(Chr05:161627379-166 731 706),共26个候选基因。
2.3 候选基因功能注释分析
使用BLAST软件对关联区域内候选基因分别在NR数据库、Swissprot数据库、GO数据库、KEGG数据库和COG数据库注释,这些基因与细胞壁过氧化物酶、LRR受体、抗真菌蛋白、抗病蛋白、胁迫诱导蛋白等有关(见表3)。
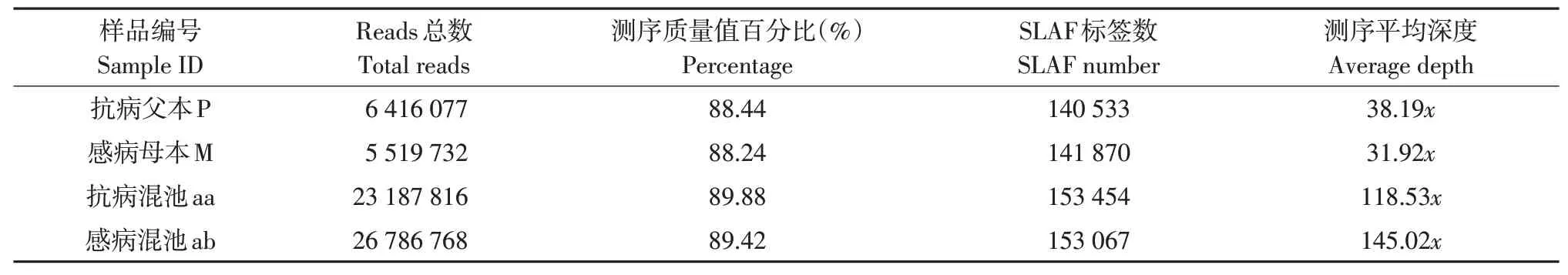
表2 样品测序数据评估与SLAF标签统计Table 2 Statistics of sample sequencing data assessment and SLAF tag

表3 定位区域内基因注释信息Table 3 Gene annotation in positioning area
3 讨论
近年来,多数研究者对辣椒疫病抗病性鉴定采用病情分级方法[13,20],而本试验在对辣椒接菌过程中发现,仅植株出现发病症状,无论是根茎部变黑出现缢缩,还是叶片萎蔫脱落,均出现死亡[21],因此本研究仅将抗病性分为抗病和感病两种情况,而不作病情分级分析,目的是为得到极抗和极感材料用于目标基因初步定位。
目前育种家通过研究辣椒疫病3种抗源发现,不同抗源材料对疫病抗性遗传规律不同,如CM334对辣椒疫霉菌抗性由两个非连锁隐性基因控制[22],或是由3个等位抗性基因控制[23],也有研究认为是由一个显性基因和一个隐性上位基因控制[24],或存在两个独立显性基因[25];PI201234抗性是由一个显性基因[26]或一个显性基因加上修饰基因控制[27];而Perennial抗性则是由存在加性效应和上位效应多个基因控制[28]。
本研究采用ZCM334为抗源,该材料以CM334为亲本,经自交后接菌鉴定,保留抗疫病植株开展下一代自交纯化,通过连续六代接菌、选择和自交,最终获得对辣椒疫霉菌3号生理小种完全免疫材料,比高抗材料CM334纯合度更高。通过调查发现F1群体全部抗病,说明ZCM334疫病抗性由显性基因控制;同时本研究发现在接菌后感病对照全部发病时调查的BC1F1分离群体中抗、感植株分离比符合1∶1,而F2群体抗、感植株符合3∶1分离比,因此推断在感病对照全部发病时,ZCM334对辣椒疫病抗性由一对主效基因控制,说明在辣椒疫霉菌侵染早期阶段,ZCM334对辣椒疫霉菌3号生理小种抗性是由一对主效基因控制的显性性状。
通过SLAF-BSA测序将候选区域定位到辣椒第5号染色体5.1 Mb(161627379~166 731 706)范围内,这一区间与Mallard等整合到MetaPc5.2抗性位点(53 089 203~162 656 768)有部分重合[12]。对候选基因注释发现,部分候选基因与细胞壁过氧化物酶相关,过氧化物酶是重要植物保护酶之一,在植物细胞壁合成过程中发挥重要作用,积极应答抗生物和非生物胁迫等过程,当植物被病菌侵染后,过氧化物酶通过诱导改变植物细胞壁等方式形成第一道物理屏障,对病原菌被动防御起关键作用;还有一些类似于丝氨酸/苏氨酸蛋白激酶的LRR受体属于植物抗性蛋白(R蛋白),R蛋白感应病原产生的激发子,从而触发信号转导快速启动防卫反应,参与植物对病原菌主动防御。后续将继续深入研究该基因辣椒疫病抗性。
由于研究者所选用辣椒疫病抗源亲本大多数为高抗材料,加之利用辣椒疫霉菌不同生理小种开展研究,使辣椒抗疫病基因(位点)定位结果不同。本研究所选用辣椒抗疫病材料ZCM334是对辣椒疫霉菌3号生理小种免疫的自交系,以此构建基因定位群体可更准确定位目标基因。未来将进一步在候选区域内设计SSR分子标记,并在构建BC1F2群体中筛选重组单株,缩小候选区间范围,以期精细定位到辣椒抗疫病基因,为今后转基因育种奠定良好基础。
4 结论
本研究利用获得辣椒疫病免疫材料ZCM334构建各世代群体开展辣椒抗疫病遗传分析发现,ZCM334对辣椒疫病抗性是由一对主效显性基因控制,通过采用SLAF-BSA测序技术对构建的BC1F1群体作混池测序,初步将辣椒抗疫病基因定位在辣椒第5号染色体5.1 Mb范围内,根据基因注释结果发现与抗病相关基因用于后续研究。

