Y染色体多态性对精液质量、精子功能及IVF/ICSI-ET妊娠结局的影响*
曹井贺 董业浩 孙宝刚 房 姣 梁鲁南 刘贞辉
济宁医学院附属医院(山东济宁 272029)
人类Y染色体是由大部分是异染色质组成的小的近端着丝粒染色体,容易发生形态学即长度的变化,诸如46,XY,Y≥18、46,XY,Y≤21;46,X,Yq-;46,X,Yp+,对于这是Y染色体的正常形态表现,还是异常染色体类型?目前仍然存在很多争议。而Y染色体多态性对精子功能的影响未见有相似报道,Y染色体长度对IVF/ICSI-ET妊娠结局以及出生后代的影响也鲜有报道且存在争议[1-3]。基于以上研究背景通过分析Y染色体多态性患者精液质量及其精子功能、IVF/ICSI-ET妊娠结局以及后代情况,探讨Y染色体多态性对精液质量、精子功能、辅助生殖妊娠结局以及出生后代的影响,为临床上对此类患者进行生育能力评价、治疗措施的选择、遗传咨询、妊娠结局的预测、对子代的影响等提供依据。
资料与方法
一、研究对象
回顾分析济宁医学院附属医院生殖医学中心2016年6月至2019年12月因男方因素行IVF-ET/ICSI-ET的207例Y染色体多态性患者(包括50例46,XY,Y≥18;51例46,XY,Y≤21;36例46,X,Yqs;30例46,X,Yq-;40例,46,X,Yp+),为实验组(A组),染色体正常135例男性纳入对照组(B组)。所有周期均为第一次治疗周期,所有患者进行助孕治疗前均经过详细的一般情况检查、体格检查、内分泌检查、遗传学检查和至少两次精液分析。具有严重生殖系统异常的患者,如重度精索静脉曲张、隐睾症等均被排除在研究之外。重度少精子症(精子计数<5×106/ml)和无精症患者均要进行Y染色微缺失的检查,具有Y染色微缺失的男性也被排除在研究之外,对Y染色体多态性患者进行必要的遗传咨询。
女方筛选标准:染色体核型46,XX,未发现已知的影响IVF-ET或ICSI-ET妊娠结局的疾病(其通过HSG或者宫腔镜、腹腔镜手术以及超声检查证实)。本项研究得到了济宁医学院附属医院生殖医学伦理委员会的批准。所有的研究对象均在自愿的前提下签署了科研知情同意书。
二、方法
(一)实验方法
1.细胞遗传学检查方法
取外周血进行淋巴细胞培养后,常规制备染色体标本,G显带分析计数30个中期分裂相,分3~5个核型,异常者加倍分析、计数,结果分析按人类细胞遗传学国际命名体制(ISCN,1985)进行。
2.精液常规分析
(1)计算机辅助精子分析(CASA):采用计算机辅助精子分析仪(西班牙,SCA)检测精子密度、总数、各级运动精子百分率和数量等。
(2)精子形态学分析(Diff-Quik法):检测精子形态正常率=畸形精子数/计数精子总数×100%
3.精子功能检查
依照WHO技术规范采集、处理和检测精液标本,检测实验组与对照组相关精子指标水平以及精子-透明质酸结合率;精子核蛋白不成熟率;精子DNA碎片率。
(1)精子顶体酶活性检测:使用精子顶体染色试剂盒(PSA-FITC,深圳华康生物)检测精子顶体酶活性,简要步骤如下:测定精液常规参数后,测定和对照Ep管中加入7.5×106个精子,离心去除精浆,按照试剂盒使用说明操作,依次加入相关试剂,水浴后离心,紫外分光光度计读取各管405 nm的OD值,计算顶体酶活性。
(2)精子核蛋白组型检测(苯胺蓝染色法,深圳华康生物)利用洗涤液稀释精子浓度至40×106/ml,对于小于该浓度的样本进行离心浓缩)。取上述调整后的精液1 ml加Eppendorf管内,1000×g离心10 min,去除精浆。加1ml洗涤液,充分混匀。1000×g离心3 min去上清液,如此共洗涤3次。最后一次离心弃上清液后,加1ml粘合液。取5μl调整后的精液涂片,空气干燥。加固定液固定90s,甩去固定液。玻片以自来水轻轻冲洗7次,甩去玻片表面积水,加染液覆盖膜片区,染色5 min。以自来水缓缓冲洗,然后将膜片浸泡至洗脱液中准确脱色18~20 min,或至膜片无明显蓝色为止。立即甩去脱色液,以自来水快速洗涤7次。迅速吹干或晾干后加封固液1滴,以盖玻片封片。油镜计数200个精子,不成熟核蛋白组型转换的异常精子头部呈蓝色,计算头部着色精子百分率。
(3)精子DNA碎片检测[精子染色质扩散实验(SCD)法,深圳博锐德生物科技有限公司]。检验方法:(1)试剂及室温准备:将易熔凝胶管置于80℃孵育20 min,待完全融化后,将易熔凝胶管置于37℃待用。检测前将室温调整至20-28℃。(2)标本制备:将液化的新鲜精子浓度用生理盐水调整至(5-10)×106/ml (3)检测方法:严格按照试剂盒使用说明给出的检测方法进行检测。(4)精子DNA碎片判定标准:精子头部仅产生较小的光晕或无光晕,单侧光晕的厚度不超过精子头部最小直径的1/3。SDF(%)=存在DNA碎片精子数/ 被观察精子总数×100%。
(四)精子-透明质酸结合率检测(深圳博锐德生物科技有限公司):将10μl液化的精液加入透明质酸包被的载玻片(测定孔)“T”孔中,待精液白然扩散到(对照孔)“C”孔,盖上盖玻片;室温放置10min后,在400倍显微镜下观察精了与玻片上的透明质酸结合情况,计数500个活动精了,精了-透明质酸结合率(%)=(“T”孔被结合精了数/“T”孔计数活动精了总数-“C”孔被结合精了数/“C”孔计数活动精了总数)×100%。
(二)临床操作
1.控制性超促排卵:实验组与对照组女方均选择长方案超促排卵:于启动周期前次月经黄体中期肌注GnRH。达菲林1.33mg,月经第3天开始使用Gn促排卵,月经第6天起,行阴道B超检查卵泡和子宫内膜发育情况,并以此及时调整用药。直至有2~3个主导卵泡直径在18mm以上时,结合激素检测结果提示卵泡发育成熟,停用促排卵药物,于当晚8点注射hCG5000-10000u。注射hCG后34~36小时在阴道B超引导下穿刺取卵,记录取卵数。
2.对Y染色体多态性患者进行必要的遗传咨询。
(三)胚胎实验室操作。
1.精子处理:为了减少或者去除精浆的抗精子抗体、细菌、免疫活性细胞、杂质,达到符合要求的精子浓度,促进精子获能,改善精子受精能力等,将实验组与对照组在授精前需对精子进行必要的处理。采用密度梯度分离法分离:其具体步骤为:取精子密度梯度分离培养基,吸取1ml下层(高密度)分离培养基置于离心管中,再吸取1ml上层分离培养基(低密度)缓慢地注于下层分离培养基的上面。两层培养基的中间形成一个清晰的界面,37℃培养箱复温。小心吸取1ml培养基化的精液覆盖于上层分离培养基的液面。以(300~600)×g的速度离心20min。移去所有的分层溶液,只剩底部的沉淀。加2~3ml洗精培养基,将沉淀混匀。200×g离心5min。移去上清,再加入洗精培养基,重复离心洗涤步骤。用0.5mlIVF受精培养基沉淀。进行精于计数和精子质量评估。将处理获得的精子调整密度(50~300)×103/ml为宜,后置5%CO2、37℃、95%湿度培养箱待用。
2.受精及胚胎培养:实验组、对照组采用常规的体外受精。受精后18h观察原核,出现2个原核和2个极体为正常受精卵,未出现2PN为受精完全失败。取卵后培养72h观察胚胎形态,将优质胚胎移植到宫腔内。胚胎移植后14天检测尿或血HCG阳性,移植后4~5周超声检查见胎心搏动为临床妊娠。移植时先选择常规受精来源的胚胎,若无常规受精来源胚胎则移植ICSI受精胚胎。
3.胚胎按以下评分标准分级
形态学指标:4’-卵裂球大小均匀,碎片为≤5%;3’-卵裂球大小均匀或不等,碎片6%~20%;2’-卵裂球体积相等或不等,碎片21%~50%;1’-卵裂球少,碎片>50%。1、2级胚胎在发育过程中出现下列情况,胚胎评级时在形态学基础上降一级:①授精20h内未见到原核,48h证实为延迟受精的胚胎。②取卵后48h超过8细胞或72h未超过5细胞。正常受精4、3级胚胎为优质胚胎。
(四)计算公式:受精率=正常受精卵数/ 卵-冠-丘复合体数×l00%;优质胚胎率=优质胚胎数/ 正常受精卵数×l00%;着床率=B超观察到的妊娠囊数/ 移植胚胎数×100% ;临床妊娠率=临床妊娠例数/ 移植周期数×l00%;生化妊娠率=生化妊娠周期数/ 妊娠周期数;流产率=孕28周前流产周期数/ 临床妊娠周期数。
三、统计学处理
实验数据采用SPSS 16.0统计软件进行分析。计量资料用表示,比较采用单项方差分析;计数资料用率(比值)表示,比较应用卡方检验。P<0.05认为差异有统计学意义,P<0.01差异有显著统计学意义。
结果
收集在济宁医学院附属医院生殖医学科就诊的207例Y染色体多态性患者(包括50例46,XY,Y≥18;51例46,XY,Y≤21;36例46,X,Yqs;30例46,X,Yq-;40例,46,X,Yp+),为实验组。并将Y染色体正常组135例男性纳入对照组。
(一)Y染色体多态性组与Y染色体正常组一般资料比较
比较实验组与对照组患者:男、女方年龄、不孕年限、窦卵泡数、女方基础FSH、LH、HCG日E2日子宫内膜厚度差异无统计学意义(P>0.05),见表1。
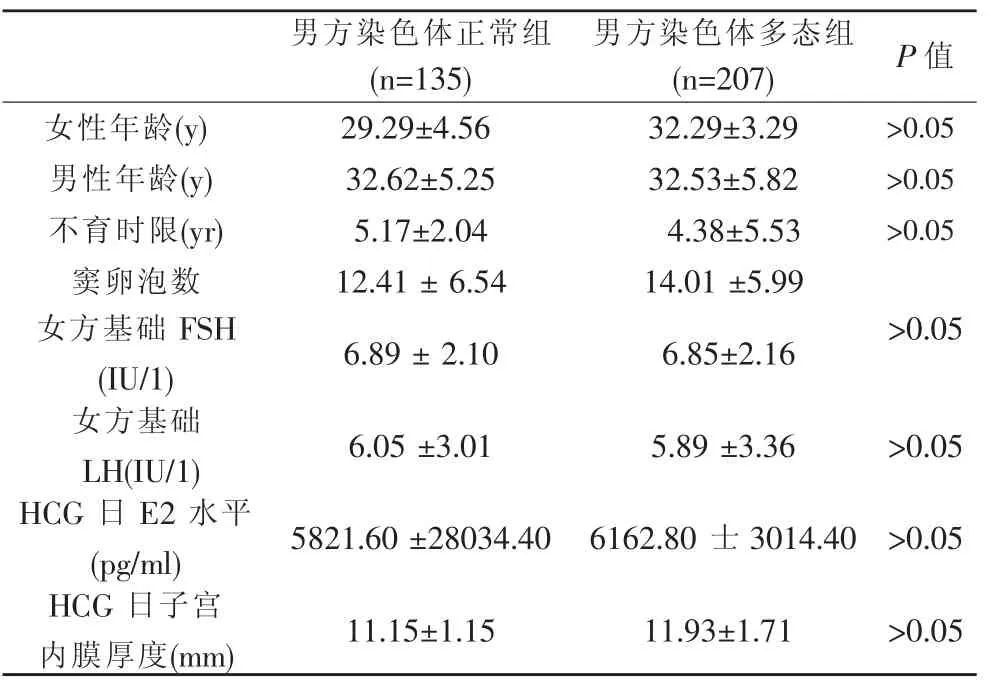
表1 Y染色体多态性组与Y染色体正常组一般资料比较
(二)比较实验组与对照组患者
实验组与对照组相比,精液参数中,精液量、差异无统计学意义(P>0.05)。精子浓度、前向运动精子率(PR)、正常形态率、精子存活率、对照组组高于实验组,差异有统计学意义,见表2。
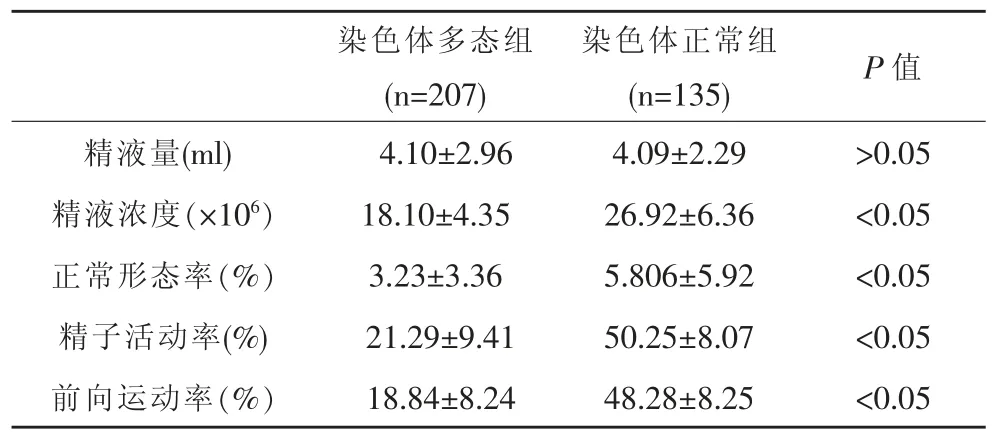
表2 实验组与对照组患者基本情况比较
(三)Y染色体多态性组与染色体正常组精子功能的比较
Y染色体多态性组有10例、Y染色体正常组有1例精子浓度过低,由于无法继续进行精子功能试验,故将此11例患者剔除出去。其中对比Y染色体多态性组与Y染色体正常组精子功能指标发现:Y染色体多态性组的顶体酶活性、精子-透明质酸结合率小于Y染色体正常组,Y染色体多态性组的DNA碎片、核蛋白组异常率,型大于Y染色体正常组,差异具有统计学意义,见表3。
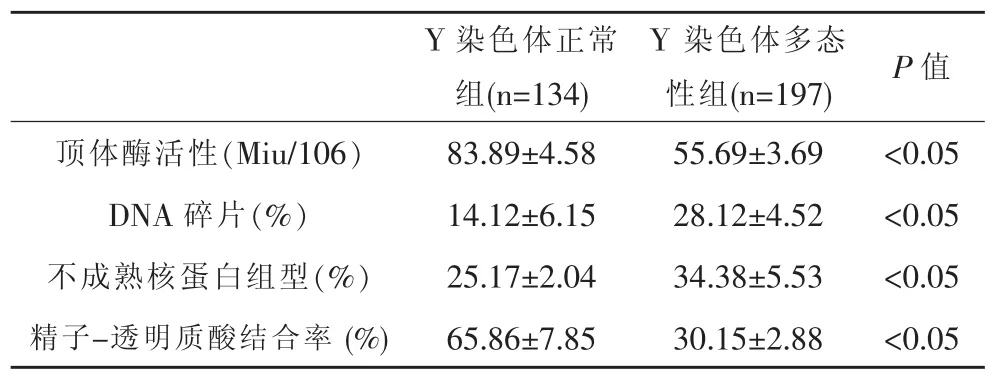
表3 Y染色体多态性组与Y染色体正常组患者精子功能比较
(四)Y染色体多态性组与Y染色体正常组IVF-ET和ICSI-ET妊娠结局的比较
IVF-ET组当中Y染色体多态性组的受精率、优质胚胎率、着床率、临床妊娠率小于对照组,生化妊娠率大于对照组,差异有统计学意义,而卵裂率两组之间差异无统计学意义,见图1。ICSI-ET组染色体多态性组与对照组的受精率、卵裂率、优质胚胎率、着床率、生化妊娠率、临床妊娠率差异无统计学意义,见图2。
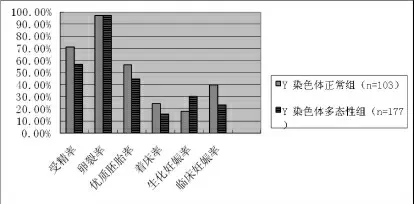
图1 Y染色体多态性组与染色体正常组IVF-ET妊娠结局的比较
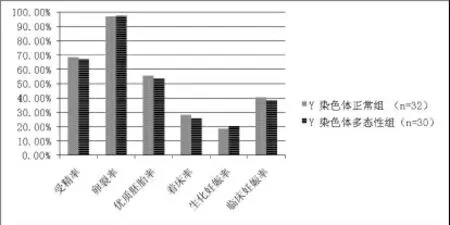
图2 Y染色体多态性组与染色体正常组ICSI-ET妊娠结局的比较
(五)Y染色体多态性组与Y染色体正常组对子代影响
Y染色体多态性组流产率高于正常组,差异有统计学意义,而两组早产率、后代出生体重(3.12kg±0.79 vs 3.20kg±0.56)、双胎妊娠率、男婴比例、出生缺陷率两两比较后显示无统计学差异,见图3。

图3 Y染色体多态性组与Y染色体正常组对子代影响
讨论
Y染色体是最小的近端着丝粒染色体,其上有睾丸决定因子及系列与精子发生相关的基因,在人群中Y染色体的长度具有很大的变异性,主要是因为Y染色体长臂长度的差异引起。人类Y染色体很大部份是异染色质,极易发生形态学的变化。Y染色体异常包括46,XY,Y ≥18;46,XY,Y ≤21;46,X,Yqs;46,X,Yq-及46,X,Yp+等,这些基因的突变、缺失可导致男性不育,也可导致妻子复发性流产或胎儿畸形等的发生[4-6]。然而有关Y染色体异常对男性生育的影响也一直存在分歧[7-9]。Y染色体异常以往多认为无临床意义,最近学者研究表明Y染色体异常对男性不育以及胚胎继续妊娠有重要影响[9]。
以往有关Y染色体异常的研究多集中在Y染色体结构多态与临床效应关系的探讨,对精子功能的影响未见有相似报道。同时为了更好地衡量Y染色体多态性对男性生育能力以及预测生殖结局,我们对Y染色体多态性的男性不育患者进行精子功能检测,其中精子顶体酶是存在于精子顶体内的一种与精子顶体膜相连的胰蛋白酶样丝氨酸蛋白酶,以酶原形式合成并储存在顶体内,是受精过程中的关键酶,当精卵结合发生顶体反应时,顶体酶原释放,为精卵结合提供条件。顶体酶的作用是使精子穿过透明带,同时能降低宫颈粘液的粘度,提高精子穿过宫颈粘液的能力。顶体酶活性低下会影响卵细胞卵丘的分解及精子对卵细胞透明带的穿透,从而导致男性不育。具有一定数量和运动能力的精子是受精的前提,而具有正常的精子形态和顶体酶活性是必要条件。因此顶体酶活性是判断精子生育力很有价值的一项指标,可以有效弥补精液常规分析仅能了解男性的一般生育力。精子染色质及DNA完整性是保证遗传信息准确传递的物质基础。精子核成熟过程中,经历了组蛋白-过渡蛋白-鱼精蛋白的核蛋白组型转换,在此过程中85%的组蛋白被鱼精蛋白取代,核蛋白组型转换异常可阻碍鱼精蛋白与DNA的正常结合,使精子DNA稳定性降低。精子-透明质酸结合试验(hyaluronan binding assay,HBA)作为一种简便易行的精子功能检测方法,可用于评估活动精子的成熟度,精子DNA损伤是影响男性生育能力,导致男性不育的重要原因。因此,精子DNA损伤程度的检测在不育患者的治疗、生育力和辅助生殖预后的评估中占有极其重要的地位。关于精子DNA损伤的机制尚无统一的定论,精子核蛋白组型异常是其可能机制之一。精子与透明质酸(hyaluronicacid,HA)的结合能力,可以客观反映精子的成熟度。王金香等[10]研究显示,精子-透明质酸结合率<65%时,总受精率和正常受精率均显著降低(P<0.01),建议即使精液常规参数正常,也应谨慎选择IVF。本研究发现在少弱精子症患者当中,Y染色体多态性比例要明显高于Y染色体患者,并且Y染色体多态性组的顶体酶活性、精子-透明质酸结合率小于Y染色体正常组,Y染色体多态性组的DNA碎片、不成熟核蛋白组型大于Y染色体正常组,提示:Y染色体多态性可能会导致精子发生障碍,从而对精子质量产生一定影响。同时对精子受精能力会产生一定影响。
而随着体外受精胚胎移植(in vitro fertilization and embryo transplantation,IVF-ET)以及卵胞浆内单精子注射(intracytoplasmic sperm injection,ICSI)在男性不育患者中的应用,对于一些由Y染色体异常导致无精子症和严重少精子症的男性患者可以此获得生育。但是这类技术的应用绕过了自然受精过程中对精子的自然选择过程是否对辅助生殖妊娠结局以及对出生后代会产生不良的影响目前仍不明朗。不同于以往的研究[11],为了更准确反映Y染色体多态性对IVF/ICSI-ET结局的影响,我们将研究对象分为IVF诊疗组以及ICSI治疗组,来分析Y染色体多态性对IVF/ICSI-ET结局的影响。
本研究中,在实行IVF诊疗组当中Y染色体多态性患者的受精率、优质胚胎率和临床妊娠率、着床率低于Y染色体正常患者,而卵裂率无明显差异。在实行ICSI治疗组,Y染色体多态性患者的受精率、卵裂率、优质胚胎率、临床妊娠率、着床率与Y染色体正常患者相比,无明显差异。这与Hong的研究[12]相似,提示部分Y染色体多态性患者虽然精液常规参数正常,但其潜在的受精能力可能降低,所以导致IVF诊疗组Y染色体多态性患者的妊娠结局不良,提示Y染色体多态性对男性不育患者的IVF-ET或ICSI-ET妊娠结局有不良,影响其机制尚不能完全明了。有研究显示[13]:Y染色体异染色质的变化可以导致临近相关基因的不表达或者引起细胞分裂过程错误,影响细胞分化和基因调节,导致精子生成障碍并影响精子的受精能力。
有研究显示[14]:Y染色体异染色质的变化可以导致不育、复发性流产、胚胎丢失和胎儿发育异常,陈咏健[15]对1例46,XY,Yqh+患者受精后第3d胚胎进行荧光原位杂交分析(FISH),认为大Y患者胚胎非整倍体发生率增高可能是导致其不良孕产史的原因。同时本研究发现Y染色体多态性患者的流产率高于Y染色体正常患者,差异有统计学意义。提示Y染色体多态性患者流产率的增加可能是非整倍增加等原因。这与Halliday J[16]研究相似。但本研究也发现Y染色体多态性患者的早产率、出生体重、双胎妊娠率、男婴比例、出生缺陷率与Y染色体正常患者相比,差异均无统计学意义,这与Nagvenkar P[17]的研究相似,这提示Y染色体多态性可能对后代躯体发育以及性别比例等无明显不良影响,要得到具有更具有临床参考价值的结论还需要更大样本的进一步研究。
综上所述,Y染色体多态性患者可能对男性生育能力有一定的影响。对于IVF治疗结局不良的Y染色体多态性患者,实行ICSI受精可能会改善其助孕治疗结局,由于本研究中染色体多态性的样木量不够充足,因此,需要更大的样本量和更敏感的研究方法进行进一步的研究。

