脂肪来源间充质干细胞治疗神经损伤性勃起功能障碍的实验研究
提运荣 杨孟波 张 明 肖冬冬 吕向国 卢慕峻*
1.上海交通大学医学院附属仁济医院泌尿外科(上海 200127)2.上海市男科学研究所(上海 200001)
勃起功能障碍(erectile dysfunction,ED)是指阴茎无法勃起或维持勃起以完成满意的性生活[1]。ED的原因包括血管性、神经性、内分泌性和心理性等多个方面。其中盆腔手术(如前列腺癌根治手术)是造成神经性ED的常见原因,手术中不可避免造成海绵体神经切断、灼伤和器械牵拉造成的海绵体神经损伤(cavernous nerve injury,CNI),其对患者术后生活质量造成很大影响。尽管近年来保留双侧性神经的前列腺癌根治术(radical prostatectomy,RP)得到有效推广,其术后海绵体神经损伤性勃起功能障碍(cavernous nerve injury related erectile dysfunction,CNI-ED)的发生率依然达到20%-90%[2]。由于神经损伤造成的海绵体纤维化,CNI-ED较一般的ED更加难以治疗,其对ED的一线治疗方法口服PDE-5抑制剂反应往往不佳[3]。
海绵体注射干细胞用于治疗勃起功能障碍且取得一定疗效[4,5]。干细胞来源多样,脂肪、骨髓和脐带条索均可以分离出具有分化潜能的干细胞。其中,脂肪来源间充质干细胞(Adipose-derived mesenchymal stem cells,ASCs)以其获取容易、来源广泛和一定的旁分泌功能广泛用于组织修复[6,7]。本研究拟采用脂肪来源间充质干细胞治疗双侧海绵体神经损伤ED大鼠,检测其勃起功能和组织恢复情况,并诠释其治疗机制。
材料和方法
一、大体设计
本研究分为3组,为年龄匹配组(age-matched control,AMC,n=8),对照组(双侧海绵体神经损伤后阴茎海绵体注射PBS,n=8)和ASCs组(双侧海绵体神经损伤后阴茎海绵体注射人脂肪来源间充质干细胞,细胞数量为106个细胞,n=8)
二、材料
ASCs的提取、培养:取得患者的知情同意后,取年轻女性患者抽脂所得腹部脂肪废弃液,0.25%氯霉素溶液冲洗后PBS(上海赛戈生物有限公司)冲洗,剪刀剪碎后按1:1的比例加入0.1%的IV型胶原酶(Sigma-Aldrich,Germany)放入37℃的恒温摇床摇晃直至乳糜状,把上述液体放入离心机,300g,37℃离心5分钟。去掉上层液体后用含有10%胎牛血清(Gibco,USA)和1%抗生素(Gibco,USA)的完全培养基(DMEM,Gibco,USA)重悬后,悬液滤过2μm的滤网,过滤后的细胞悬液接种到10cm的培养皿中,放到37℃5%二氧化碳的细胞培养箱中培养。每两天换液,在细胞融合度达90%时传代。
三、方法
(一)海绵体神经损伤和海绵体注射
CNI-ED模型构建方法按文献所述方法构建[8]。10到12周的雄性Sprague-Daw ley大鼠(300-350克)提前适应环境一周,腹腔注射水合氯醛(Sigma-Aldrich,Germany),失去意识后放到温度可控平板上,腹部正中切开后用镊子提起膀胱,暴露前列腺,在前列腺后外侧叶小心分离海绵体神经(cavernous nerve,CN)。年龄匹配组大鼠随即关闭腹腔。对照组大鼠和实验组大鼠在距盆大神经节(major pelvic ganglia,MPG)5毫米处用显微镊子夹住30s后松开,间隔30s后再夹30s(成功的损伤后海绵体神经应有颜色改变),随后关闭腹腔。按下述方法进行海绵体注射[9],剪开对照组大鼠阴茎中段包皮,用显微注射器注入100微升PBS到大鼠海绵体内,随后缝合切口。实验组执行相似的操作,注入100微升P3代人脂肪来源间充质干细胞悬液(含106细胞)到大鼠海绵体内。
(二)勃起功能检查
所有大鼠在CNI-ED建立后4周和12周进行勃起功能评估。利用如前所述方法记录最大海绵体内压(intracavernous pressure,ICP)和实时动脉压(mean arterial pressure,MAP)[10]。麻醉后,暴露完整的阴茎和前列腺。定位MPG和CNs后,将一根26号针连接到导管的一端插入海绵体。导管的另一端连接到采集测量海绵体内压(ICP)的压力数据的装置(BL-420s,中国成都泰盟软件有限公司)。接下来,暴露右侧颈动脉,并在动脉中放置一个装有肝素生理盐水的20口径套管,以测量平均动脉压。套管的另一端通过压力传感器与BL-420s相连。用BL-420s连接的信号发生器,在海绵体神经上放置刺激电极,刺激参数设置为6v、25hz、60s。计算每只大鼠的最大ICP/MAP比值(ICP/MAP)以比较勃起功能。
(三)马松三色染色(Masson trichrome staining)
取材后将阴茎中段组织浸泡于4%多聚甲醛(Sigma,USA)中,程序性脱水后石蜡包埋,切成4um厚的组织切片后。经二甲苯酒精梯度脱水后,利用马松染色试剂盒(Masson trichrome stain kit,Solarbio,USA)对组织进行染色。
(四)免疫荧光染色
取材后将阴茎中段组织浸泡于4%多聚甲醛,4小时后放入30%的蔗糖PBS溶液,4度冰箱过夜,OCT(Sakura Finetek USA) 包埋后于冷冻切片机切成6um厚的切片。稍晾干后即可使用10%驴血清封闭,封闭后孵一抗,平滑肌组织检测使用nNOS抗体(abcam,USA),4度冰箱过夜,后倾掉一抗,PBS润洗3次,每次5分钟。标记的荧光二抗稀释后加入组织,室温孵育一小时,倾掉二抗,PBS润洗。每个组织加入30uLPBS稀释后的DAPI,室温孵育5分钟,PBS清洗后加入5uL抗荧光衰减封片剂,盖上盖玻片,室温干燥后于荧光显微镜下拍照。
统计方法
本研究使用Graphpad Prism v7.0 software进行统计,所有结果均以均值±标准差显示,组间差异使用one-way ANOVA和T检验检测,P<0.05认为差异有统计学意义。
实验结果
一、ASCs形态
培养皿培养至P3代,ASCs呈现纺锤形,贴壁生长,如图1所示。
二、勃起功能评价

图2 大鼠阴茎海绵体测压和平均动脉压波形(ICP/MAP)
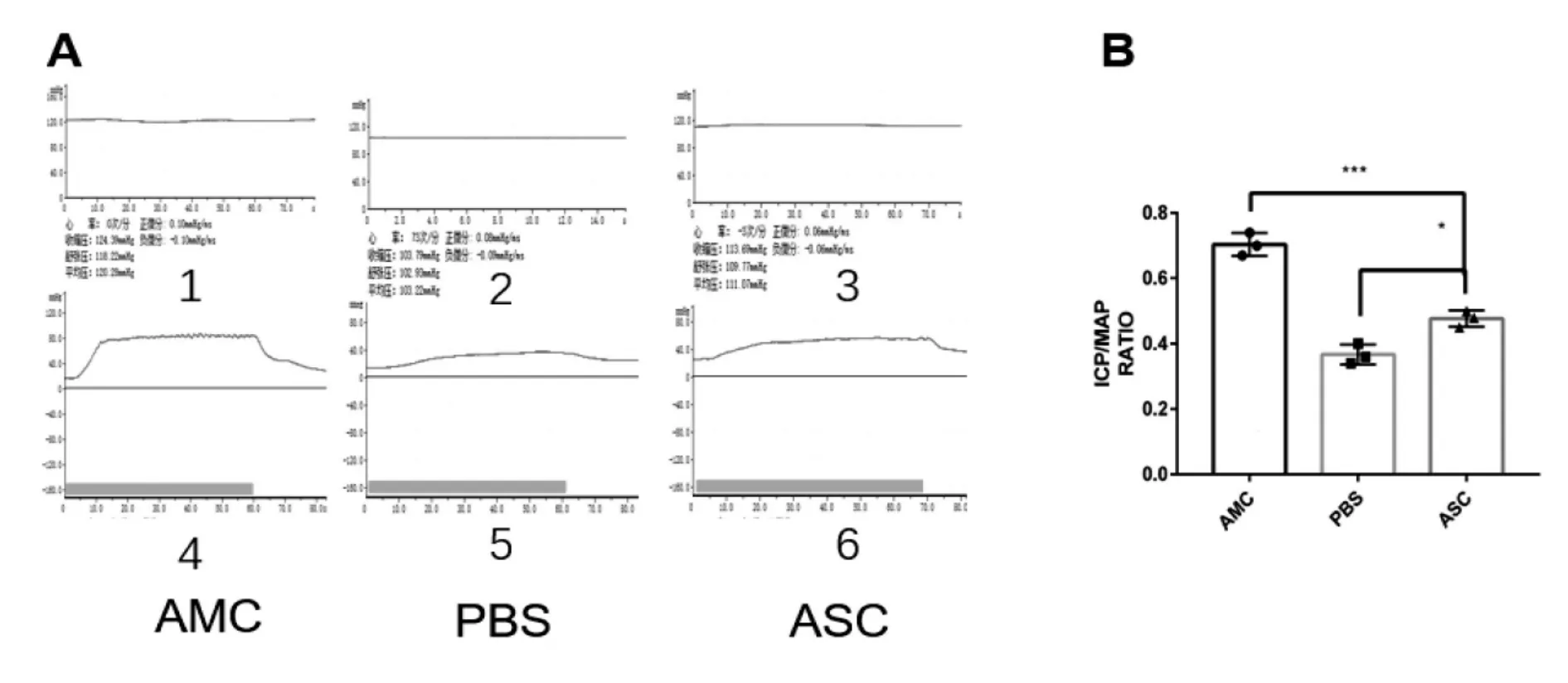
图3 大鼠阴茎海绵体测压和平均动脉压波形(ICP/MAP)
大鼠在4周和12周分别进行功能学检测,结果如图2所示。对照组和实验组大鼠ICP/MAP比值较AMC组显著降低(0.33±0.08,0.45±0.10,0.74±0.06,P<0.001,P<0.01),差距有统计学意义。实验组较对照组大鼠勃起功能显著恢复(0.45±0.10,0.33±0.08,P<0.05),12周后,对照组和实验组大鼠ICP/MAP比值仍低于AMC组(0.38±0.11,0.48±0.10,0.71±0.12),但比起4周有一定提升(0.48±0.10,0.45±0.10)。
三、马松三色染色
马松染色可以显示平滑肌胶原成份和比例。如图3所示,4周后,AMC组大鼠的平滑肌,胶原比例明显高于对照组和实验组(0.42±0.20,0.19±0.18,0.34±0.19),细胞组平滑肌/ 胶原成份比例明显高于对照组(0.34±0.19,0.19±0.18,P<0.01),12周后,AMC组大鼠的平滑肌比胶原比例仍高于PBS组和实验组(0.43±0.12,0.19±0.13,0.38±0.15),实验组平滑肌比胶原比例比起4周时有升高(0.38±0.15,0.34±0.19)。
四、免疫荧光染色
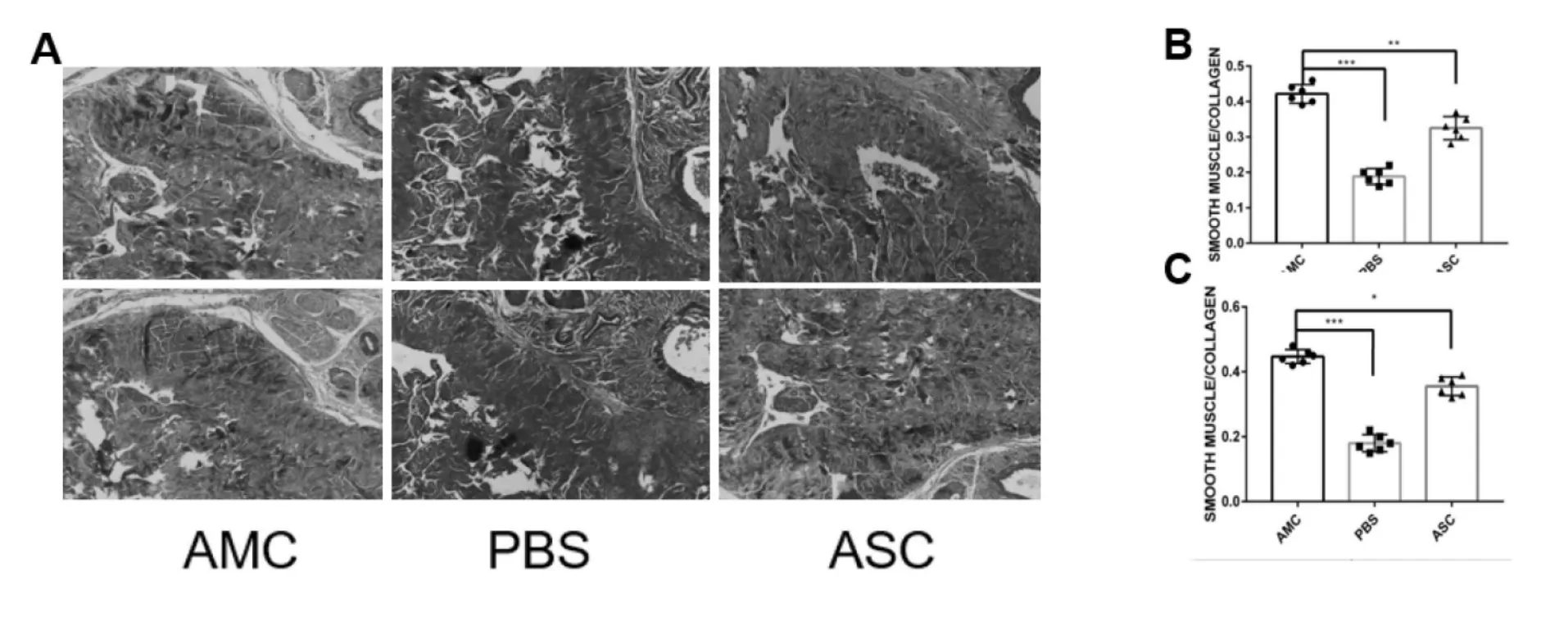
图4 大鼠阴茎海绵体Masson染色结果
nNOS染色可以显示海绵体神经型一氧化氮合酶数量和分布情况。如图4所示,4周后,AMC组大鼠平滑肌数量显著高于对照组和实验组(0.37±0.29,0,11±0.27,0.19±0.25,P<0.001),实验组明显高于对照组(0.11±0.27,0.19±0.25,P<0.05)。12周后,AMC组大鼠平滑肌数量仍高于PBS组和实验组(0.40±0.32,0.13±0.23,0.23±0.27,P<0.001),细胞组平滑肌数量比起4周有一定提高(0.23±0.27,0.19±0.25,P<0.05)。
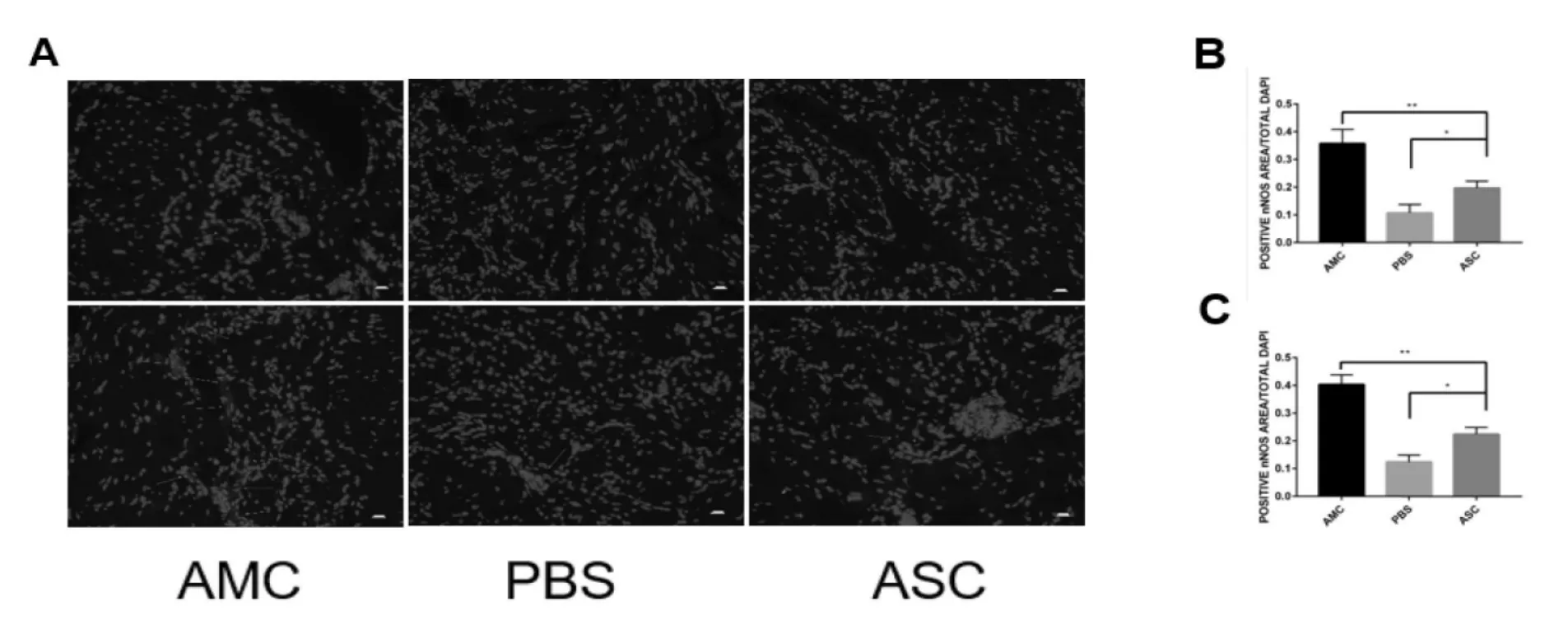
图5 大鼠阴茎nNOS免疫荧光染色结果和统计结果
讨论
男性勃起是一项复杂的生理活动,需要神经、血管、心理和内分泌等共同调节[1]。ED病因众多,其中盆腔手术或外伤造成的海绵体神经损伤是ED的常见病因。早期研究认为造成CNI-ED的原因是包含一氧化氮合酶的轴突变性,进而导致无法完成正常和夜间勃起[11]。透射电镜结果发现大鼠海绵体神经损伤28天后神经纤维已部分再生而海绵体平滑肌却持续纤维化[12]。因此,海绵体神经损伤后修复海绵体神经损伤和抗海绵体纤维化是治疗CNI-ED的关键。
组织工程和干细胞研究的兴起给CNI-ED治疗带来了新的可能。目前,海绵体注射间充质干细胞已经证实了其疗效[13]。间充质干细胞种类繁多,其中,ASCs以其广泛的来源和一定的旁分泌能力而普遍用于组织和器官修复[14,15]。同时,其低表达MHC-II类免疫复合物也让不同种属之间使用成为可能[16]。在这项研究中,海绵体神经损伤4周和12周后,对照组无论在勃起功能还是海绵体神经型一氧化氮合酶数量上比起AMC组均降低,而ASCs细胞治疗组大鼠勃起功能和nNOS数量均得到提高。4周和12周后,实验组的平滑肌比胶原成份比例也显著高于对照组。
目前国际关于海绵体注射间充质干细胞治疗神经损伤的机制多认为旁分泌作用(Paracrine effect)[17]。间充质干细胞可以分泌生物活性因子如神经生长因子(nerve growth factor,NGF),血管内皮生长因子(vascular endothelial growth factor,VEGF),胰岛素样生长因子(insulin like growth factor,IGF)和脑源性生长因子(brain derived nerve growth factor,BDNF)等,其中,NGF、IGF和BDNF均具有神经营养作用,VEGF则具有血管营养和再生作用[18,19]。在我们的前期研究中,我们发现ASCs可以分泌基质细胞衍生因子-1(stromal derived factor-1,SDF-1)从而促进膀胱血管化[20]。这项研究中,我们推测,ASCs分泌的生长因子促进了损伤部位的神经修复,进而减少了海绵体组织的纤维化,恢复了CNI-ED大鼠的勃起功能。
同时,我们的研究存在一些不足,如没有探究ASCs治疗CNI-ED的具体作用因子及机制,没有使用老龄大鼠来精确模拟老龄人口CNI-ED患者的真实生理状态,这在我们今后的研究中将会得到改进。
结论:本项研究建立CNI-ED大鼠动物模型并通过海绵体注射ASCs对CNI-ED进行治疗,发现ASCs可以通过促进神经再生和保护海绵体平滑肌,来改善CNI-ED大鼠的勃起功能,提示ASCs治疗神经损伤性ED具有良好前景。

