粪菌移植对内毒素诱导的急性肺损伤大鼠Keap1−Nrf2/ARE信号通路的影响
谭乂珉,汪玉磊,李波,尹国芳,范贤明△
急性肺损伤(acute lung injury,ALI)是多种因素引起的肺部过度炎症反应和氧化应激。当肺部受到刺激时,会引起炎性细胞浸润,氧自由基、蛋白水解酶等释放,损伤肺泡上皮细胞及毛细血管内皮细胞,导致血管通透性增加,引起肺水肿,肺泡间隔增厚甚至断裂,造成肺内氧弥散障碍、通气/血流比例失调,形成顽固性低氧性呼吸功能不全[1−2]。目前临床上常用的治疗手段效果较差。
正常的肠道菌群会形成微生物屏障,帮助宿主获取能量、调节免疫、抗炎、合成维生素等[3]。一旦肠道菌群平衡被打破会引发诸多疾病,而粪菌移植(fecal microbiota transplantation,FMT)可帮助受体重建正常肠道微生态环境。近年来许多研究将FMT应用于各种肠内外疾病,如难辨梭状芽孢杆菌感染、炎症性肠病、肠易激综合征、自身免疫性疾病、神经精神疾病等[4],均取得了重要进展。炎症、氧化应激在ALI的发生发展中至关重要,FMT干预脂多糖(LPS)诱导的ALI中,抗炎、抗氧化机制可能发挥了重要作用。笔者前期的研究证实ALI模型大鼠肠道菌群丰度、结构、多样性等方面均发生明显变化,通过FMT干预后肠道菌群改变得以纠正,同时肺损伤得到了改善,这与抑制磷脂酰肌醇3−激酶(PI3K)/蛋白激酶B(AKT)/核因子(NF)−κB信号通路、转化生长因子(TGF)−β1/Smad3信号通路及细胞外信号调节激酶(ERK)信号通路的活化,减少炎性因子表达有关[5−6],但未阐明抗氧化应激机制是否在其中发挥作用。Kelch样环氧氯丙烷相关蛋白1(Keap1)−核因子E2相关因子(Nrf2)/抗氧化反应元件(ARE)信号通路作为氧化应激系统中一条重要的抗氧化通路,可以通过激活下游的抗氧化酶基因转录、表达,增强清除自由基能力,抑制脂质过氧化反应,进而减轻肺损伤[7]。本研究通过检测Nrf2及Keap1−Nrf2/ARE信号通路下游相关产物在各组大鼠中的表达情况,探究Keap1−Nrf2/ARE信号通路在此过程中的作用。
1 材料与方法
1.1 材料与试剂成年雄性SPF级SD大鼠15只,6~8周龄,体质量(200±20)g,购自西南医科大学实验动物中心,动物合格证号:SYSK(川)2018−065。实验前将大鼠于实验室喂养1周。LPS(Sigma,美国),Nrf2、血红素氧合酶−1(HO−1)抗体(武汉三鹰生物技术有限公司,中国),免疫组化Nrf2抗体(北京孚博生物科技有限公司),甘油醛‑3‑磷酸脱氢酶(GAPDH)抗体、山羊抗兔二抗(上海碧云天生物技术公司,中国),超氧化物歧化酶(SOD)、丙二醛(MDA)、蛋白质羰基(PCO)酶联免疫吸附测定(ELISA)试剂盒(上海科兴商贸有限公司,中国),其余均为国产或进口分析试剂或材料,肠道菌群测序由上海生物工程有限公司完成。
1.2 方法
1.2.1 实验分组与模型制备15只SD大鼠按随机数字表法分为对照组(NS组)、模型组(LPS组)、干预组(FMT组),每组5只。LPS组、FMT组通过腹腔注射LPS(5 mg/kg)1次制备大鼠ALI模型;相同条件下,NS组腹腔注射等体积无菌生理盐水,造模完成24 h后,FMT组立即给予自制粪菌液(参照Cui等[8]的制备方法)灌胃(10 mL/kg,2次/d,持续2 d);相同条件下,NS组和LPS组灌胃等体积生理盐水。实验期间各组大鼠常规摄食,房间温度(25±5)℃、湿度40%~60%。观察各组大鼠精神、体质量、进食、毛色变化及对外界刺激反应等。于最后一次FMT完成24 h后收集腹主动脉血、肺组织及结肠内新鲜粪便。
1.2.2 血氧分压[p(O)2]、肺湿/干质量比(W/D)测定抽取腹主动脉血0.5 mL于血气分析仪检测p(O)2。取出右肺组织,清洗后吸干表面水分称量得肺湿质量(W),然后将肺组织放置于70℃烤箱内烘烤2~3 d至完全脱水称量肺干质量(D),计算肺W/D。
1.2.3 肺大体观察及肺损伤病理学评分将肺组织在生理盐水中洗净后观察肺组织外观情况。将左肺上叶固定后,经过脱水、包埋、切片、HE染色等操作后,光镜下观察肺组织病理学形态,根据肺泡腔及肺泡间隔中性粒细胞渗出、肺泡间隔增宽、充血出血和纤维蛋白渗出情况进行病理学评分,0分为无或非常轻微,1分为轻,2分为中,3分为重,4分为极重。每张切片观察5个不同的视野,以平均值作为每个样本的肺损伤病理学评分。
1.2.4 肠道菌群测序收集各组大鼠结肠内新鲜粪便放入无菌冻存管中保存,根据需要提取粪便样品DNA进行肠道菌群测序,利用MiSeq控制软件进行图像分析:对97%相似水平下的操作分类单元(operational taxonomic units,OTU)进行生物信息统计分析,利用实际观测到的OTU计算出Alpha多样性指数,包括ACE、Chao、Shannon和Simpson指数,其中ACE和Chao指数反映微生物丰度,Shannon和Simpson指数反映微生物多样性;根据各组大鼠肠道菌群的OTU丰度计算出Beta多样性距离矩阵,进行层次聚类分析后得到聚类树图,Beta多样性可用于比较3组大鼠肠道菌群差异性;将序列进行物种分类,通过信息整理后得到科水平菌群分布柱状图。
1.2.5 血清SOD、MDA、PCO水平测定将收集到的大鼠血液样本在4℃,3 000 r/min离心10 min后收集上清,ELISA法检测血清中SOD、MDA、PCO水平。按照ELISA试剂盒说明书进行操作。
1.2.6 免疫组化染色将3组大鼠肺组织切片进行免疫组织化学染色,分析肺组织Nrf2的表达情况。在光镜下观察并摄取放大200~400倍的图像,将图像导入Image Pro Plus 6.0内,先对图像进行灰度转化,明显区分阳性区域与背景,手动描绘测量区域,软件自动测量出区域面积(Area)及积分光密度(IOD)值,并算出平均光密度(IOD/Area)。
1.2.7 Western blot法 检 测 肺 组 织HO−1及Nrf2蛋 白 表达将肺组织进行蛋白提取,用于检测肺组织中HO−1蛋白含量,再按照细胞核蛋白提取试剂盒说明书,提取肺上皮细胞核蛋白,用于检测活化Nrf2蛋白的表达,按BCA蛋白定量法检测目的蛋白浓度,依次经过电泳、转膜、封闭、洗涤、一抗过夜孵育、再洗涤、二抗室温孵育、再洗涤、曝光显影、扫描图像、测量灰度值后,以GAPDH为内参,比较各组样本目的蛋白表达情况。
1.3 统计学方法将各组数据使用SPSS 22.0进行统计学分析,所有计量资料均使用x±s表示,多组间比较采用单因素方差分析,组间多重比较采用LSD−t法,P<0.05表示差异有统计学意义。
2 结果
2.1 实验期间大鼠一般情况NS组较前无明显变化;LPS组大鼠与NS组相比,活动减少、精神萎靡、反应迟钝、呼吸增快、摄食减少、毛发暗淡。FMT后,大鼠活动、精神、对外界刺激反应、摄食等均有好转。
2.2 各组大鼠肺W/D、p(O)2比较与NS组相比,LPS组肺W/D明显升高,p(O)2降低;与LPS组相比,FMT组大鼠肺W/D降低,p(O)2有所回升,组间比较差异均有统计学意义(P<0.05),见表1。

Tab.1 Changes of lung W/D,p(O)2 and lung injury pathological scores of rats in each group表1 各组大鼠肺W/D、p(O)2、肺损伤病理学评分变化(n=5,x±s)
2.3 肺大体观察及肺损伤病理学评分
2.3.1 肺大体观察NS组大鼠肺组织表面光滑呈均匀粉色,质软;LPS组部分大鼠肺组织外表可见出血、淤血、坏死等表现;FMT组大鼠肺组织表面出血、淤血、坏死情况减轻。
2.3.2 肺组织形态学观察及肺损伤病理学评分NS组肺泡结构完整,肺间质及肺泡腔无明显炎性细胞浸润,LPS组肺损伤病理学评分明显高于NS组(P<0.05),LPS组大鼠肺组织结构杂乱,主要表现为肺泡间隔明显增厚,肺泡腔及肺泡间质出现大量炎性细胞、红细胞浸润,部分肺泡间隔断裂;FMT组肺组织结构清晰,肺泡腔及肺泡间质炎细胞、红细胞明显减少,渗出减轻,但肺泡间隔较厚,FMT组的病理学评分较LPS组降低(P<0.05),见图1、表1。

Fig.1 HE staining of lung tissue of rats(×200)图1 大鼠肺组织HE染色(×200)
2.4 大鼠肠道菌群宏基因组高通量测序结果
2.4.1 测序结果3组大鼠OTU数值比较差异无统计学意义,见表2。
2.4.2 Alpha多样性分析3组大鼠ACE、Chao、Shannon、Simpson指数比较差异均无统计学意义,见表2。
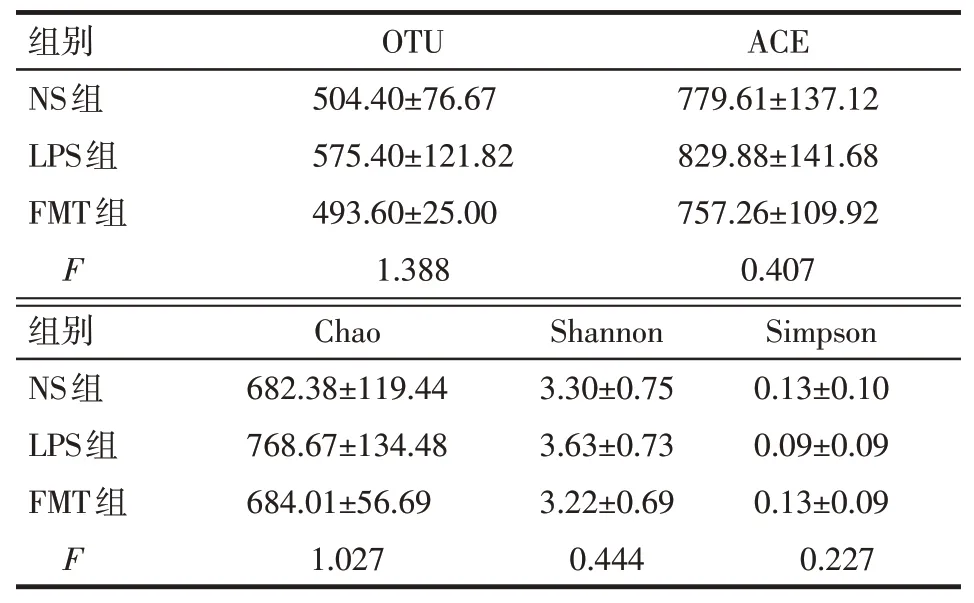
Tab.2 Diversity analysis of intestinal flora in three groups of rats表2 3组大鼠肠道菌群多样性分析(n=5,x±s)
2.4.3 Beta多样性分析FMT组与NS组菌群结构成分较为相似,LPS组与以上2组菌群结构组成相差较大,见图2。
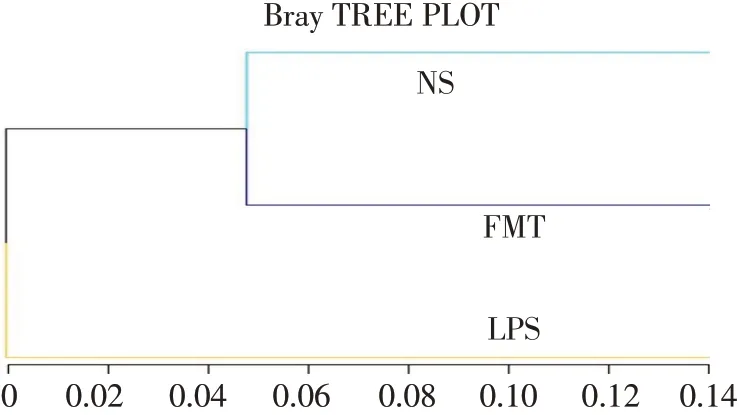
Fig.2 Similarity tree diagram图2 相似性树状图
2.4.4 大鼠肠道菌群结构分析3组样本均以乳酸杆菌科、紫单胞菌科、瘤胃球菌科、未分类菌、消化链球菌、毛螺菌科、普雷沃氏菌科为主,其中以乳酸杆菌科、紫单胞菌科最多;LPS组与NS组比较,乳酸杆菌科、消化链球菌科丰度降低,紫单胞菌科明显增高,FMT组乳酸杆菌科、消化链球菌科丰度增高,紫单胞菌科降低,见图3。
2.5 3组大鼠血清中SOD、MDA、PCO水平比较与NS组相比,LPS组血清中MDA、PCO明显增高,SOD降低;FMT组血清中MDA、PCO较LPS组明显减少,SOD表达升高(P<0.05);LPS组SOD/MDA、SOD/PCO均低于NS组及FMT组(P<0.05),而NS组与FMT组比较差异无统计学意义,见表3。
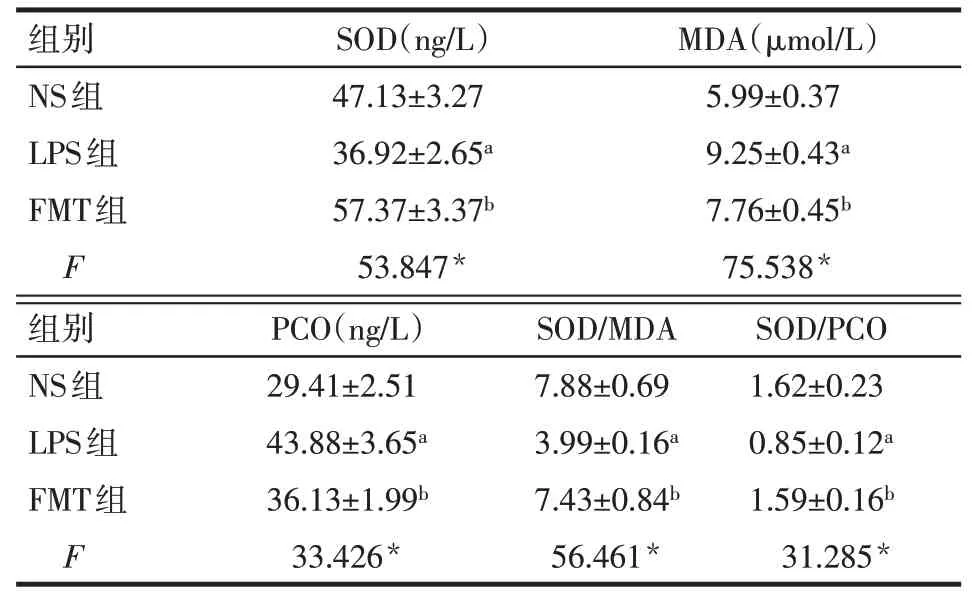
Tab.3 Changes of serum levels of SOD,MDA,PCO,SOD/MDA and SOD/PCO in three groups of rats表3 3组大鼠血清中SOD、MDA、PCO、SOD/MDA、SOD/PCO变化(n=5,x±s)

Fig.3 Histogram of family horizontal flora distribution图3 科水平菌群分布柱状图
2.6 肺组织中HO−1、Nrf2蛋白表达比较NS组肺组织中Nrf2极少表达[(49.20±56.14)×10−6],LPS组Nrf2蛋白表达增多[(2 169.60±1 364.42)×10−6],FMT组[(4 671.80±2 291.79)×10−6]较LPS组进一步增多(n=5,F=11.285,P<0.05),见图4。Western blot结果显示,NS组中Nrf2、HO−1较少表达,LPS组Nrf2、HO−1蛋白表达量较NS组增多,FMT组Nrf2、HO−1蛋白的表达量较LPS组进一步增多(P<0.05),见图5、表4。
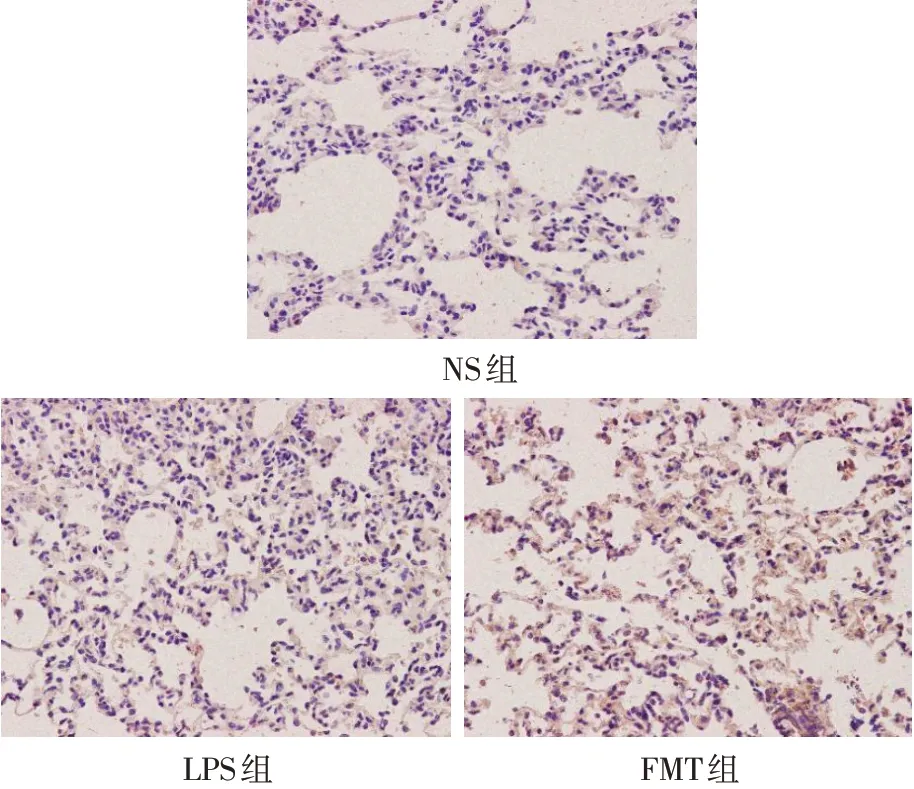
Fig.4 Immunohistochemical staining for Nrf2 protein in rat lung tissue(SP,×400)图4 免疫组化检测大鼠肺组织中的Nrf2蛋白(SP,×400)

Fig.5 The expression of Nrf2 and HO−1 protein in rat lung tissue detected by Western blot assay图5 Western blot检测Nrf2、HO−1蛋白表达的结果

Tab.4 The expression levels of Nrf2 and HO-1 protein in the lung tissues of rats表4 Nrf2、HO-1蛋白在各组大鼠肺组织中的表达情况(n=3,x±s)
3 讨论
LPS导致ALI是一个失控性炎症级联放大过程,促抗炎失衡、氧化抗氧化失衡、细胞凋亡紊乱等在该过程中发挥作用[9]。氧化应激是ALI发生发展的重要环节。LPS进入机体后刺激产生过多的活性氧(ROS)直接损伤肺泡上皮细胞及血管内皮细胞,与之发生脂质过氧化反应,产生具有细胞毒性作用的MDA,MDA再次损害上述细胞使肺损伤情况进一步恶化[10]。ROS对蛋白质造成氧化损伤,产生PCO,PCO含量是判断蛋白质氧化损伤的敏感指标[11]。研究表明,氧化应激反应系统中重要抗氧化通路Keap1−Nrf2/ARE可通过激活下游的抗氧化酶基因的转录、表达,增强清除自由基能力,抑制脂质过氧化反应,进而减轻肺损伤[7]。Nrf2在调节氧化应激中起着重要作用。Nrf2生理状态下无活性,通常与胞质中的Keap1结合,泛素化后被蛋白酶降解,当受到氧化刺激时,两者解偶联,Nrf2入核并与Maf结合成异二聚体后与ARE结合,激活通路下游编码Ⅱ相解毒酶基因和抗氧化相关蛋白的转录,使SOD、HO−1、谷胱甘肽过氧化物酶(GSH−Px)、过氧化氢酶(CAT)等抗氧化酶表达增加[2,12]。SOD是清除氧自由基的关键酶,其与HO−1被Nrf2激活后通过分解血红素生成的胆绿素和一氧化碳(CO)共同发挥清除氧自由基、抑制脂质过氧化反应、细胞保护等作用[13]。本研究结果显示,NS组MDA、PCO处于较低水平,而SOD处于中等水平,此时氧化抗氧化反应处于低水平平衡状态,肺组织Nrf2及HO−1蛋白较少表达;当腹腔注射LPS后,肺组织形态学的改变,病理学评分增加、p(O)2降低以及肺W/D增高,说明大鼠出现ALI;SOD减少,MDA、PCO明显增多,SOD/MDA及SOD/PCO均明显降低,说明此时机体氧化应激反应强于抗氧化应激反应,血清中检测出的SOD较NS组减少,但肺组织Nrf2及HO−1蛋白增多,考虑可能是由于氧化刺激使部分Nrf2入核被活化,激活Keap1−Nrf2/ARE信号通路,因此检测出的Nrf2及HO−1蛋白增多,SOD因为清除自由基及氧化损伤产物被消耗,故而血清中检测出较少的SOD;FMT后,Nrf2及HO−1蛋白、SOD均较LPS组明显增多,MDA、PCO减少,SOD/MDA及SOD/PCO明显升高,且与NS组数值接近,表明此时机体抗氧化能力明显增强,使氧化抗氧化再次达到平衡,考虑可能原因是Nrf2大量入核被活化,显著激活Keap1−Nrf2/ARE信号通路,使抗氧化物明显增加;FMT组肺损伤病理学评分降低、肺W/D下降及p(O)2的升高,均说明ALI得到改善。以上结果表明,肺组织中Nrf2、HO−1及血清中的SOD、MDA、PCO水平与肺组织损伤及修复有关,提示FMT干预LPS诱导的大鼠ALI的作用机制与激活Keap1−Nrf2/ARE信号通路相关。
人体肠道细菌数目庞大,正常肠道菌群在调节宿主免疫系统、影响发育和生理等方面均发挥着重要作用,维持肠道微生态平衡,可避免许多疾病发生[3]。当肠道菌群紊乱时,可导致许多肠内外疾病的发生。近年FMT在纠正菌群紊乱、修复肠屏障以及调节免疫等方面作用的研究取得了重要进展[14]。研究发现肠道菌群可通过“肠−肺轴”影响呼吸系统疾病的病理改变和免疫功能[15]。笔者前期研究发现LPS组大鼠在出现ALI的同时肠道菌群发生了改变[5−6]。本研究发现LPS组Beta多样性与NS组及LPS组有差异,其中乳酸杆菌科、消化链球菌科减少,紫单胞菌科明显增多;FMT组与NS组在Alpha多样性及Beta多样性上相似,表明其菌群结构、多样性、丰度相似;同时,FMT组大鼠肺损伤情况较LPS组得到了改善,说明FMT对LPS诱导的ALI存在一定干预作用,这也与前述的“肠−肺轴”理论相符合,但其具体干预机制目前尚不明确。研究表明肠道菌群的代谢产物如乙酸、丙酸、丁酸等短链脂肪酸具有调节免疫、对抗炎症、提供能量等作用[16−17]。本研究中也发现LPS组菌群结构与NS组及FMT组有差异,因此考虑肠道菌群代谢产物的变化可能在上调Nrf2活化,激活Keap1−Nrf2/ARE信号通路中起重要作用。
综上,FMT在LPS诱导的大鼠ALI中有一定的治疗作用,其作用机制与上调Nrf2活化,激活Keap1−Nrf2/ARE信号通路,增加下游抗氧化物产生,从而减轻氧化应激反应有关,肠道菌群的代谢产物短链脂肪酸可能在其中发挥重要作用,但其具体机制目前尚不明确,后期需进行相关实验深入研究。

