丹皮酚对IL−1β诱导HFLS−RA的保护作用及相关机制研究
李梅,欧大明,黄丽芳,谢立虎,张济
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性全身炎症性疾病,其特征性病理改变为慢性滑膜炎及滑膜组织增生,最终可致关节和骨骼破坏[1]。成 纤 维 样 滑 膜 细 胞(fibroblast−like synoviocytes,FLSs)被认为是介导RA关节破坏的主要效应细胞,释放多种细胞因子,在炎症反应、滑膜增生、关节破坏等过程中起着重要作用。因此,滑膜组织中的FLSs是RA炎症介质的主要来源,在RA的发病机制中起重要作用[2]。牡丹皮作为我国传统药用植物,其主要成分是丹皮酚(Paeonol),具有抗炎和保护心血管等多种生物功能[3]。有研究表明,丹皮酚对皮炎、关节炎和急性感染等疾病具有治疗作用[4]。然而,丹皮酚对滑膜炎、RA的治疗效果及其作用机制尚少见报道。本研究旨在分析丹皮酚对白细胞介素(IL)−1β诱导人类风湿关节炎成纤维样滑膜细胞(HFLS−RA)及胶原诱导型关节炎(CIA)小鼠的治疗作用,为RA治疗药物的研发提供实验基础。
1 材料与方法
1.1 主要材料丹皮酚购自国家食品药品监督管理局,纯度98%;IL−1β购自美国PeproTech公司;四甲基偶氮唑盐(MTT)试剂盒和肿瘤坏死因子(TNF)−α、IL−6酶联免疫吸附测定试验(ELISA)试剂盒购自南京逸飞雪生物科技有限公司;基质金属蛋白酶(MMP)−1、MMP−3抗体购自武汉博斯特生物技术公司;Toll样受体−4(TLR4)、anti−NF−κB p65、甘油醛−3−磷酸脱氢酶(GAPDH)一抗和Alexa Fluor 488偶联的驴抗羊IgG二抗购自美国CST公司;RIPA裂解缓冲液、蛋白酶抑制剂和增强化学发光(ECL)试剂均购自南京诺唯赞生物科技有限公司;Mini−PROTEAN电泳仪购自美国Bio−Rad公司;FC酶标仪购自美国Thermo公司。
1.2 细胞培养HFLS−RA细胞购自广州吉妮欧生物科技有限公司,采用DMEM培养基置于37℃、5%CO2培养箱中培养,添加10%胎牛血清,每2 d更换1次培养基。当HFLS−RA细胞生长至融合度为95%时,采用胰蛋白酶消化,以1∶4进行传代,取第3~8代的HFLS−RA细胞用于实验。
1.3 MTT法检测细胞存活能力将HFLS−RA细胞以密度1×104个/孔接种于96孔板中,实验设空白对照组(未加IL−1β或丹皮酚处理),10μg/L IL−1β组(HFLS−RA经10μg/L IL−1β诱导)及0.1、1、10、100μmol/L丹皮酚组(HFLS−RA经10 μg/L IL−1β诱导及0.1、1、10、100μmol/L丹皮酚干预)。培养24 h后,加入25μL MTT溶液,37℃孵育4 h,吸弃上清液,每孔加入150μL DMSO溶液,振动筛上混匀15 min。采用酶标仪测量波长540 nm处的光密度(OD)值。
1.4 ELISA法测定细胞因子水平将HFLS−RA细胞以1×105个/mL接种至6孔板中,细胞分组同1.3,培养24 h,待细胞融合度约为80%时,吸取各组上清液,2 000 r/min离心20 min,置于无菌管中,−20℃保存;按照ELISA试剂盒说明书进行操作,检测HFLS−RA细胞中TNF−α、IL−6水平。
1.5 免疫荧光法观察HFLS−RA中NF−κB p65细胞核移位将HFLS−RA细胞以1×105个/mL接种于培养皿,实验设空白对照组(未加IL−1β或丹皮酚处理)、10μg/L IL−1β组(HFLS−RA经10μg/L IL−1β诱导培养30 min)及10μmol/L丹皮酚组(HFLS−RA经IL−1β诱导培养30 min后,加入10μmol/L丹皮酚作用1 h)。将HFLS−RA固定、渗透、加入anti−NF−κB p65一抗(稀释比例1∶100)孵育过夜,然后用Alexa Fluor 488偶联的驴抗羊IgG二抗(稀释比例1∶600)孵育,进行DAPI,后进行激光共聚焦显微镜拍摄,采用ImagePro Plus 6.0软件分析p65细胞核移位。
1.6 Western blot检测MMP−1、MMP−3和TLR4蛋白的表达将HFLS−RA细胞分为空白对照组,10μg/L IL−1β组,0.1、1、10μmol/L丹皮酚组以及阴性对照组,阴性对照组HFLS−RA未经IL−1β诱导,加入10μmol/L丹皮酚处理1 h,其余组处理方法同1.5。HFLS−RA经不同浓度丹皮酚预处理后,用预冷PBS清洗,添加RIPA裂解缓冲液,BCA法测定蛋白浓度并调至一致。将蛋白样品和加样缓冲液混合煮沸至变性,取等量(25μg)蛋白质进行10%~12.5%SDS−PAGE电泳,转移至聚偏氟乙烯膜,用5%(W/V)脱脂牛奶封闭2 h,MMP−1(稀释比例1∶1 000)、MMP−3(稀释比例1∶500)、TLR4(稀释比例1∶1 000)和GAPDH(稀释比例1∶1 000)一抗4℃孵育过夜。随后,TBST洗膜,用辣根过氧化物酶(HRP)结合的IgG二抗(1∶2 500)室温孵育2 h,ECL化学发光试剂显色,曝光成像。采用fluochem−HD2化学发光仪和AlphaView−SA软件对谱带光密度进行分析。
1.7 动物分组与处理24只雄性DBA/1小鼠,SPF级,体质量18~22 g,7~8周龄,购自桂林医学院实验动物中心,合格证号:SCXK桂2015−0012。动物在标准环境(24±1)℃下饲养,相对湿度(56±5)%,本研究方案经医院动物伦理委员会审核批准。采用简单随机抽样法将小鼠分为对照组、CIA组和治疗组3组,每组8只。CIA组和治疗组依据文献[5]制作CIA小鼠模型,取500μL鸡Ⅱ型胶原与不完全弗氏佐剂按1∶1充分乳化,在大鼠尾根部皮下注射0.1 mL乳剂,初次免疫当天作为第0天,第7天按上述方法、相同剂量(0.1 mL/只)加强1次;对照组仅注射等体积的生理盐水;治疗组小鼠造模成功后,于第10~48天每隔1天灌胃10 mg/kg丹皮酚。分别于第0、15、18、21、24、27、30、33、36、39、42、45、48天观察小鼠临床症状,并根据大鼠每个关节的病变程度进行累计积分(四肢累计评分)。四肢评分标准[6],0分:无关节炎;1分:有红色斑点或轻度肿胀;2分:关节部位中度肿胀;3分:严重肿胀;4分:严重肿胀且不能负重。四肢累计评分≥4分,视为造模成功。在初次免疫后第48天,采用戊巴比妥(90 mg/kg)麻醉小鼠实施安乐死。
1.8 HE染色观察关节组织病理学改变初次免疫后第48天,处死小鼠后取踝关节滑膜组织,用4%多聚甲醛固定,随后用10%乙二胺四乙酸(EDTA)脱钙,石蜡包埋,制作5μm厚切片,行常规HE染色,进行组织学观察。
1.9 ELISA法测定大鼠滑膜组织中炎性因子水平各组小鼠处死后,无菌条件下,钝性分离踝关节周围的肌腱、韧带和脂肪组织等,剥离滑膜组织,按照质量(g)∶体积(mL)1∶9加入预冷的生理盐水,制成10%匀浆液,机械匀浆,2 000 r/min离心20 min,吸取上清液保存。按照ELISA试剂盒说明书进行操作,检测小鼠滑膜组织中TNF−α、IL−1β水平。
1.10 统计学方法采用SPSS 19.0软件进行统计学处理,计量资料以x±s表示,不同时点各组间比较采用重复测量设计的方差分析;多组间比较采用单因素方差分析,组间多重比较行LSD−t检验,P<0.05为差异有统计学意义。
2 结果
2.1 MTT法检测HFLS−RA细胞增殖情况与空白对照组比较,10μg/L IL−1β可促进HFLS−RA细胞增殖(P<0.05);与10μg/L IL−1β组比较,0.1、1、10、100μmol/L丹皮酚对IL−1β诱导HFLS−RA细胞增殖无明显抑制作用(P>0.05),见图1。

Fig.1 Effects of paeonol on IL−1βinduced cell proliferation in HFLS−RA图1 丹皮酚对IL−1β诱导HFLS−RA细胞增殖的影响
2.2 ELISA法检测HFLS−RA细胞中TNF−α、IL−6水平10μg/L IL−1β组TNF−α、IL−6水平明显高于空白对照组(P<0.05);0.1、1、10、100μmol/L丹皮酚组TNF−α、IL−6水平均低于10μg/L IL−1β组(P<0.05);1、10μmol/L丹皮酚组TNF−α水平低于0.1 μmol/L丹皮酚组(P<0.05),100μmol/L丹皮酚组TNF−α水平与0.1、1、10μmol/L丹皮酚组差异均无统计学意义;0.1、1、10μmol/L丹皮酚组IL−6水平依次降低(P<0.05),100μmol/L丹皮酚组IL−6水平低于0.1μmol/L丹皮酚组,高于10μmol/L丹皮酚组(P<0.05),与1μmol/L丹皮酚组差异无统计学意义,见图2。
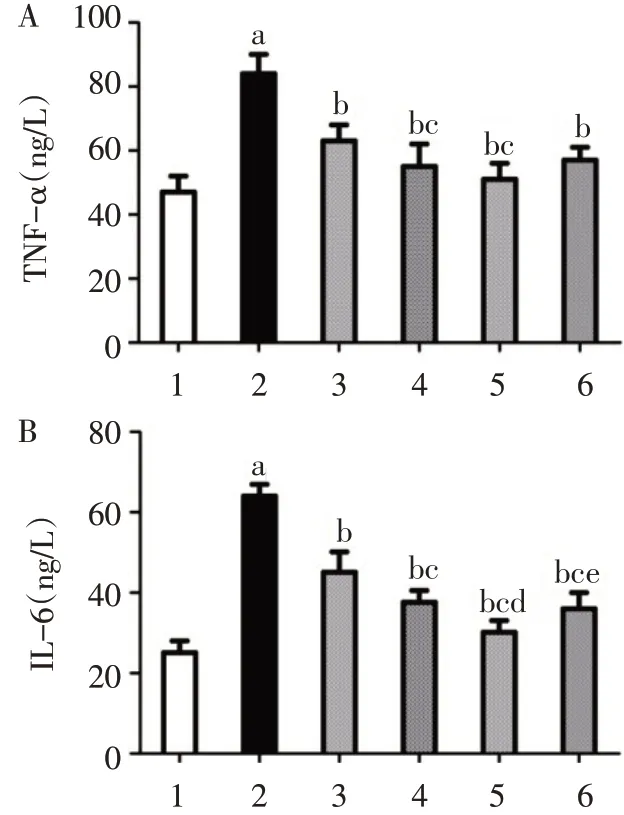
Fig.2 The concentration of TNF−αand IL−6 in cell supernatant between groups图2 各组细胞上清液中TNF−α、IL−6水平比较
2.3 免疫荧光法观察NF−κB p65核移位情况10μg/L IL−1β组HFLS−RA中NF−κB p65核移位阳性表达水平明显高于空白对照组和10μmol/L丹皮酚组(P<0.05),见图3、4。
2.4 Western blot法检测MMP−1、MMP−3和TLR4蛋白的表达10μg/L IL−1β组MMP−1、MMP−3和TLR4蛋白表达水平明显高于空白对照组(P<0.05);0.1μmol/L丹皮酚组MMP−1、MMP−3和TLR4

Fig.4 Effects of paeonol on nuclear translocation of NF−κB p65 in HFLS−RA图4 丹皮酚对HFLS−RA中NF−κB p65核移位的影响
蛋白表达水平与10μg/L IL−1β组差异无统计学意义,1、10μmol/L丹皮酚组MMP−1、MMP−3和TLR4蛋白表达水平低于10μg/L IL−1β组(P<0.05);1 μmol/L丹皮酚组MMP−1、MMP−3蛋白表达水平低于0.1μmol/L丹皮酚组(P<0.05),TLR4蛋白表达水平与0.1μmol/L丹皮酚组差异无统计学意义;10 μmol/L丹皮酚组MMP−1、MMP−3和TLR4蛋白表达水平低于1μmol/L丹皮酚组,高于阴性对照组(P<0.05),见图5、6。

Fig.5 The protein expressions of TLR4,MMP−1 and MMP−3 in HFLS−RA detected by Western blot assay图5 Western blot法检测HFLS−RA中TLR4、MMP−1和MMP−3蛋白表达
2.5 各组小鼠四肢累计评分比较初次免疫第0、15、18、21天,3组四肢累计评分差异均无统计学意义;从第24天开始,CIA组四肢累计评分明显高于对照组;从第27天开始,治疗组四肢累计评分高于对照组,低于CIA组(P<0.05);从第36天开始,CIA组和治疗组组内四肢累计评分无明显变化(P>0.05),见图7。
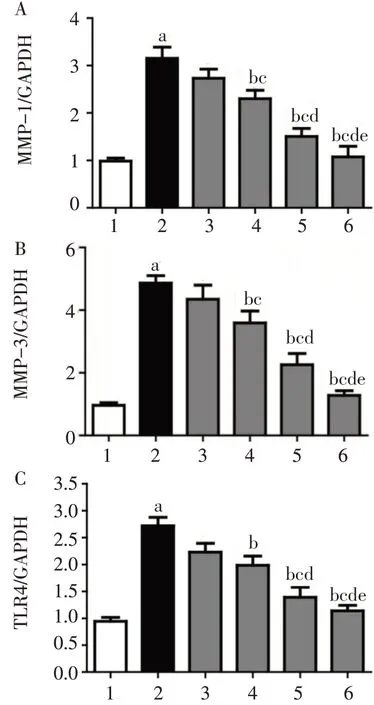
Fig.6 Comparison of TLR4,MMP−1 and MMP−3 protein expression in HFLS−RA图6 HFLS−RA中TLR4、MMP−1和MMP−3蛋白表达情况比较

Fig.7 The clinical score of arthritis in each group图7 各组小鼠四肢累计评分
2.6 HE染色观察小鼠踝关节滑膜组织病理学变化对照组小鼠踝关节滑膜组织排列整齐,未见充血、水肿、炎性细胞浸润等现象;CIA组小鼠踝关节滑膜组织有炎性细胞浸润,关节炎、滑膜增生和软骨组织病理学破坏;而治疗组在第48天时踝关节病理变化较CIA组有所改善,其中炎性细胞明显下降,软骨破坏减轻,见图8。
2.7 ELISA法检测各组小鼠滑膜组织中TNF−α、IL−1β水平与对照组相比,CIA组小鼠滑膜组织中TNF−α、IL−1β水平明显升高;与CIA组比较,治疗组TNF−α、IL−1β水平降低(均P<0.05),见图9。
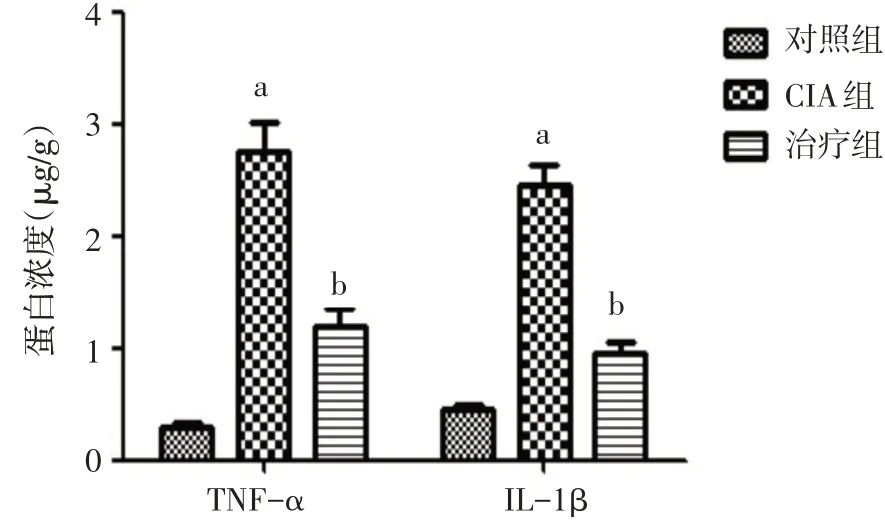
Fig.9 The TNF−αand IL−1βcontents in synovium of mice图9 小鼠滑膜组织中TNF−α、IL−1β水平
3 讨论
RA是一种病因不明的慢性全身性疾病,其基本病理改变为关节滑膜慢性炎症形成侵袭性血管翳,破坏软骨、骨及周围组织[7]。由于IL−1β、TNF−α和IL−6等各类促炎细胞因子在RA滑膜炎症中具有重要作用,因此抗炎被认为是RA的主要治疗方法[8−9]。丹皮酚是从全草和毛茛科芍药属植物牡丹、芍药根皮或萝摩科植物徐长卿干燥根中提取分离出来的活性成分,其药理学活性广泛[10]。有研究表明,丹皮酚在各种组织和细胞中具有抗炎作用[11],然而其对RA中促炎细胞因子的影响尚不明确。
在RA病理机制中,FLS活化增殖起着关键作用,其产生各种细胞因子和炎性趋化因子,如IL−6、IL−8和IL−15等,还能促进白细胞自血管内迁入滑膜、聚集于关节滑膜组织,使RA患者进入FLS过度增殖、迁移以及骨和软骨破坏的恶性循环中,最终导致残疾[12]。本研究MTT检测结果显示,10μg/L IL−1β作用48 h可显著提高HFLS−RA细胞增殖能力,而丹皮酚在0.1~100μmol/L剂量下对IL−1β诱导的HFLS−RA细胞增殖无明显抑制作用;ELISA检测结果显示,IL−1β诱导后HFLS−RA细胞中TNF−α和IL−6水平明显升高,提示炎性环境下会促使HFLS−RA释放炎性因子;而经不同浓度丹皮酚预处理后,HFLS−RA中TNF−α和IL−6水平降低,提示丹皮酚具有调节HFLS−RA介导的炎症作用;HE染色结果示CIA小鼠踝关节有炎性细胞浸润,关节炎、滑膜增生和软骨组织病理学破坏,这与ELISA检测结果基本一致。经丹皮酚治疗后能减轻CIA小鼠滑膜炎症和关节破坏,进一步提示丹皮酚具有治疗RA滑膜炎症的作用。
在调节促炎基因表达的转录因子中,NF−κB是一种能调节多种炎症和免疫基因表达的诱导性转录调节因子[13]。TLR4是天然免疫系统识别主要受体,可引起NF−κB活化和炎性因子分泌,激活NF−κB,促使其核转位,启动下游炎性因子和细胞因子的转录和翻译[14]。免疫荧光法观察发现,与空白对照组相比,IL−1β诱导HFLS−RA中NF−κB−p65核移位,而丹皮酚抑制NF−κB p65的核移位,提示丹皮酚能靶向治疗NF−κB介导的滑膜炎症。此外,Western blot结果显示,丹皮酚显著抑制IL−1β诱导的HFLS−RA中TLR−4蛋白的表达,笔者推测丹皮酚可能通过下调TLR−4表达,抑制NF−κB信号通路激活,从而抑制促炎细胞因子释放。这与ELISA检测结果基本一致,丹皮酚可显著降低小鼠滑膜组织中炎性因子TNF−α和IL−1β水平。
MMPs是一组锌离子依赖性内肽酶,滑膜细胞来源的MMPs是导致关节病理损伤的重要因素之一[15]。MMPs可降解关节骨与软骨中的胶原、蛋白多糖及其他的细胞外基质大分子,促进血管翳对软骨的侵袭[16]。另有研究报道,活化的NF−κB转位到核内与靶基因的κB基序结合,以调节包括细胞因子和炎性介质的表达,如可诱导细胞因子、趋化因子、黏附因子等的表达[17]。本研究Western blot结果显示,与空白对照组相比,IL−1β诱导HFLS−RA中MMP−1、MMP−3和TLR4蛋白表达水平升高,而1、10μmol/L丹皮酚处理后MMP−1、MMP−3和TLR4蛋白表达水平降低,提示丹皮酚可能减轻MMPs导致的关节病理损伤,这与HE观察结果基本一致。笔者推测其机制可能与丹皮酚下调TLR4表达,抑制NF−κB p65核移位,从而减少MMPs表达有关。
综上所述,丹皮酚具有抑制IL−1β诱导HFLS−RA炎性因子表达的作用,其机制可能与丹皮酚通过下调TLR4表达,抑制NF−κB信号通路激活,从而减少促炎细胞因子及MMPs释放有关。同时,丹皮酚还可以降低CIA小鼠炎性细胞浸润、滑膜增生和软骨破坏,降低关节炎临床评分,这些结果表明丹皮酚在治疗RA方面具有潜在的应用前景。
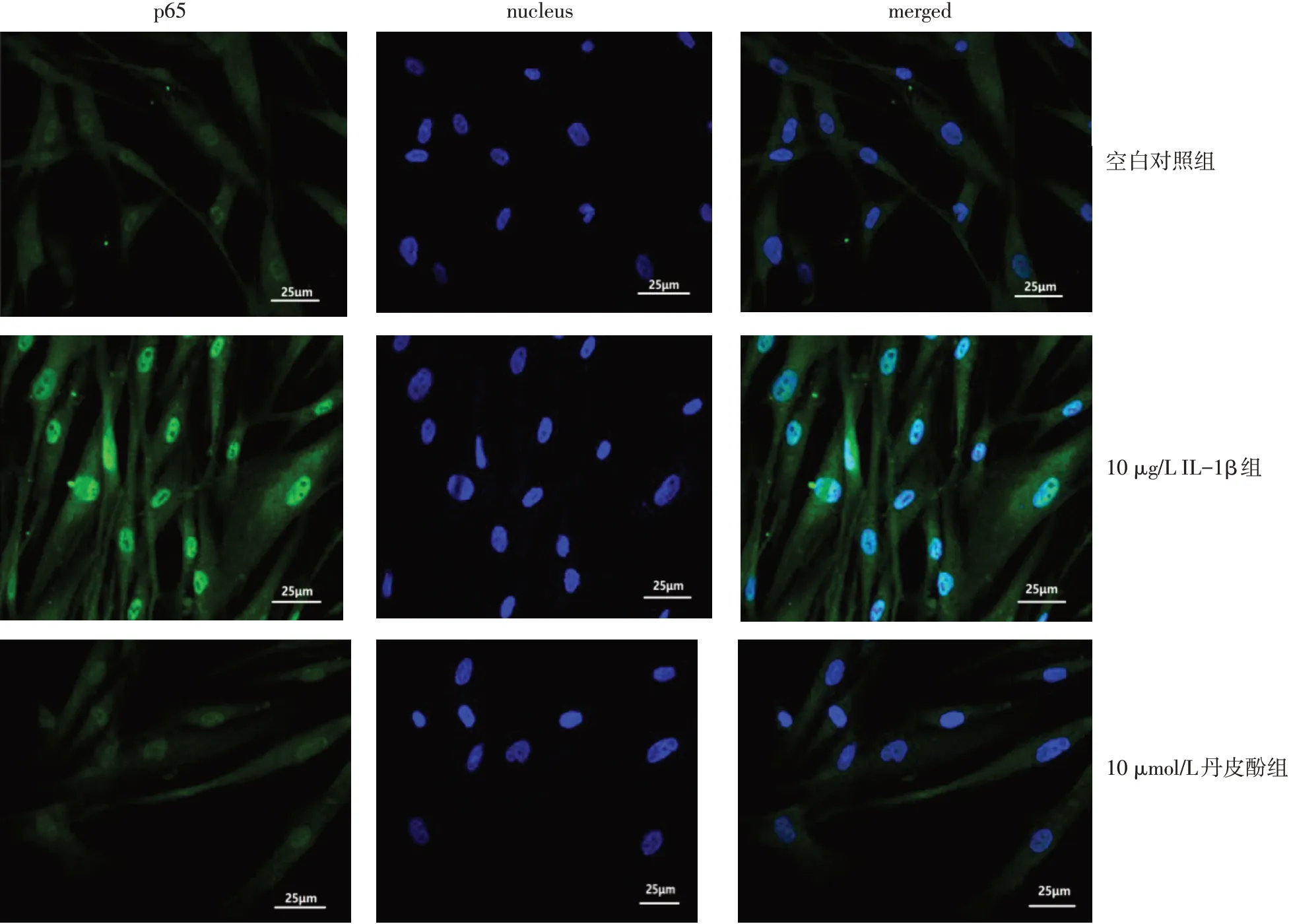
Fig.3 Subcellular localization of NF-κB p65 observed by immunofluorescence assay(×400)图3免疫荧光法观察NF-κB p65亚细胞定位(×400)

Fig.8 Effects of paeonol on joint histology of CIA mice(HE Staining,×400)图8丹皮酚对CIA小鼠关节组织学影响(HE染色,×400)

