超声内镜结合放大内镜在胃早癌内镜治疗前的评估价值
李明东,向睿,唐丙喜,陶涛,张启杰,朱萧
消化道肿瘤是威胁人类的重要疾病,而我国是消化道肿瘤高发国家,其中胃癌已成为我国发病率第一的消化系统恶性肿瘤。胃癌的早诊早治疗对降低患者病死率有重要意义。胃早癌是癌细胞浸润局限于胃壁黏膜层及黏膜下层的状态[1-3]。提高胃早癌的检出率是治疗的新方向[4-6]。随着内镜技术的普及以及操作技术的进展,越来越多的胃早癌通过胃镜诊断出来[7]。早期胃癌经有效的内镜治疗后五年生存率高达90%,内镜下黏膜剥离术(ESD)具有创伤小、简便、安全的特点,在掌握好指征的情况下能取得很好的治疗效果[8]。随着ESD技术的不断进展,相关的内镜诊断技术也发展较快,其中代表性的有超声内镜、放大内镜,超声内镜可以观察消化道的病变浸润层次。王晓虹等[9]报道其对胃肿瘤分期具有较好的诊断准确率,但对淋巴结分期诊断准确率欠佳。进一步观察病变黏膜表面微结构、微血管、边界线,确定良恶性病变并分级则需要光学放大技术,两者结合能为治疗方法的选择(内镜下微创治疗或者手术治疗)提供依据[10]。本研究旨在探讨ESD治疗胃早癌前放大内镜结合超声内镜检查评估的临床价值,现报道如下。
1 资料与方法
1.1 病例资料
回顾性分析2018年9月至2020年8月间于淄博市中心医院消化科入院拟行ESD治疗的214例胃早癌患者的临床资料,入选标准:①活检组织病理为高级别瘤变或黏膜内高分化腺癌、中分化腺癌者;②既往无胃疾病外科手术史;③心肺功能经评估能够耐受内镜治疗。排除标准:①全腹CT显示肝转移、腹腔淋巴结转移或明显肿大;②有血液系统疾病导致的凝血功能障碍或因神经、心脏疾病导致无法停用口服抗凝药物;③患者及家属拒绝参加本次研究或拒绝签字。本研究经淄博市中心医院伦理委员会批准通过,研究对象均签署知情同意书。对照组男 63例,女55例,平均年龄(55.3±10.6)岁;肿瘤位于胃窦71例,胃底体47例;肿瘤平均直径为(17.9±8.6)mm;活检高级别瘤变58例(49.2%),高分化腺癌41例(34.7%),中分化腺癌19 例(16.1%)。观察组男50例,女46例,平均年龄(52.7±14.5)岁;肿瘤位于胃窦61例,胃底体35例;肿瘤平均大小为(19.2±7.4)mm;活检高级别瘤变44 例(45.8%),高分化腺癌34 例(35.4%),中分化腺癌18例(18.8%)。两组病人在年龄、性别、肿瘤部位及活检病理的比较无统计学意义(P>0.05),具有可比性。ESD术前常规检查,评估手术风险,充分禁食准备,告知手术的注意事项、益处、风险并签署知情同意书。根据是否行ESD术前超声内镜结合放大内镜评估对患者实施分组,对照组118例行常规内镜ESD治疗,观察组96例内镜ESD治疗前行超声内镜及放大内镜评估,对两组患者内镜ESD治疗结果、病理确诊结果、是否追加外科手术进行比较。
1.2 方法
1.2.1 使用器材 Olympus CF-HQ290Z放大胃镜、CF-HQ290普通治疗胃镜、Olympus EU-ME1 20 MHz、12 MHz超声微探头、Dual刀、IT刀、注 射 针,电热止血钳、ERBE VIO 200D+APC氩气刀治疗系统。生理盐水甘油果糖注射液、止血夹、二氧化碳气泵、透明帽等。
1.2.2 操作过程 术前常规全腹CT检查提示无淋巴结转移。ESD治疗病例均采用丙泊酚麻醉诱导方式。观察组ESD前常规放大内镜结合超声内镜评估,进一步确定病变的范围,了解病变的形态、肿瘤大小,判断病灶浸润深度,对照组常规ESD治疗。放大内镜结合超声内镜评估及ESD操作均由2名300例ESD操作经验的医师共同进行,ESD步骤如下[11]:①标记病灶部位,对边界不太清晰的病变先行靛胭脂溶液染色。用氩气刀在距离病变边缘5 mm处正常黏膜烧灼出标志点。②沿标记点给予足够黏膜下注射甘油果糖+亚甲蓝+肾上腺素,使黏膜充分隆起然后在标记点外约5 mm处用针刀环行切开黏膜至黏膜下层,小病变全周隆起,可一次全周切开剥离。较大病变由于注射黏膜隆起变平,宜每次切 2~3 cm。③黏膜下层剥离可补充载膜下注射,保证在病变黏膜充分隆起的状态下,逐渐剥离至病变黏膜完全脱落,应用内镜前端的透明帽将切除组织片挡在视野之外。若遇到剥离困难的病变,为预防出现严重并发症,可分块剥离切除病变黏膜。④剥离后处理充分冲洗剥离面,手术过程中对所见血管残端出血应及时行止血钳夹和电凝止血,若出血严重且内镜下无法有效止血,应转外科行手术治疗。⑤切除标本及时展开,观察是否将标志全切干净,测量大小并拍照,用甲醛溶液浸泡固定后送病理检查。部分操作图片见图1、图2。

图1 1例胃早癌患者的超声内镜及放大内镜评估图像 A:白光内镜见胃窦前壁扁平隆起;B: NBI放大显示腺管异形,部分缺失,微血管迂曲,考虑高级别瘤变或高分化腺癌;C:超声内镜见病变局限于黏膜层,黏膜下层及固有肌层连续

图2 1例胃早癌患者ESD手术过程 A:标记病变周边黏膜;B:黏膜下注射后抬举征良好,逐步剥离黏膜下层;C:将病变完整剥离
1.2.3 术后处理 第1天禁食、禁饮,予心电监护,密切观察血压、脉搏、呼吸等生命体征,无异常者第2天进无渣食物。
1.3 评价标准
1.3.1 经超声内镜及放大内镜评估需要外科手术 如评估有以下表现之一则放弃ESD,直接转外科手术治疗:①超声内镜下黏膜下层中断、固有肌层受累;②放大内镜显示病变分化程度低且黏膜下注射抬举征阴性。
1.3.2 ESD疗效评价[12]①治愈性切除:ESD术后病理与活检结果相符,病变整块切除,切缘及基底无肿瘤细胞,浸润深度局限于黏膜层(M),黏膜下层小于500 μm(SM1);②非治愈性切除:ESD术后病理学检查若发现病变黏膜下层浸润深度大于500 μm(SM2),深切缘有肿瘤细胞,或存在脉管浸润,则追加外科手术治疗,周缘残留肿瘤细胞则行二次ESD治疗。
1.3.3 并发症 胃早癌ESD手术并发症主要有出血、穿孔等。①急性大量出血:指术中活动性渗血或喷射性出血内镜下止血困难,需中断手术和(或)输血治疗[13];②延迟出血:指术后出现出血的临床表现和(或)血红蛋白下降>20 g/L;③穿孔:术中黏膜下层浸润、粘连可导致剥离过程中肌层断裂或缺失[13]。
1.4 统计学方法
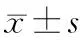
2 结果
2.1 ESD完成情况及手术、病理结果
对照组118例常规进行ESD治疗,术中由于粘连、浸润较深、抬举征阴性、术中穿孔等原因有5例(4.2%)患者终止ESD治疗转外科手术,ESD治愈性切除97例(82.2%),ESD非治愈性切除16例(13.6%),其中11例为切除病灶基底残留肿瘤细胞,故追加外科手术,术后病理均为肿瘤浸润超过黏膜下层,5例为周边残留肿瘤细胞行二次ESD治疗。观察组经术前超声内镜及放大内镜检查有6例(6.25%)不符合内镜治疗指征,放弃ESD治疗转外科手术,手术后病理为病变浸润至固有肌层或全层,有90例(93.75%)进行ESD术,其中,治愈性切除84例(93.3%),非治愈性切除6例(6.7%),其中3例切除病灶基底残留肿瘤细胞追加外科手术,3例行二次ESD治疗。所有外科手术病人术后病理肿瘤细胞浸润超过黏膜下层,ESD治愈性切除率两组相比差异有统计学意义(P<0.05),行两次治疗术(ESD+外科手术或ESD+ESD)的病人在对照组和观察组分别为21例(17.8%)和6例(6.3%),差异有统计学意义(P<0.05),见表1。

表1 两组病人ESD及手术结果的比较
2.2 并发症发生情况
2.2.1 出血 两组病人无术中急性出血。术后延迟出血发生率对照组为4例,观察组为2例,均于内镜下止血成功。
2.2.2 穿孔 对照组穿孔5例,2 例为术中发现的较小穿孔,于内镜下成功闭合,3例转外科手术,术后病理中分化腺癌,浸润固有肌层;观察组穿孔2例,内镜下成功闭合。
3 讨论
根据早期胃癌手术病例的分析可知黏膜内癌的5年存活率为99%,黏膜下层浸润癌的5年存活率为96%[14]。因此黏膜内癌中淋巴结转移率为1%以下的病灶,以及黏膜下层浸润癌中淋巴结转移率为4%以下的病灶就是ESD治疗的适应症[15]。目前认为,对于早期胃癌只要病变不超过黏膜下层1/3就可通过ESD进行根治性局部切除,但要严格选择适应证。临床中部分病人ESD术中转外科手术或ESD术后需要追加外科手术,其原因包括术前活检不充分、内镜诊断不准确、ESD指征过宽等[16]。超声内镜对术前早期胃癌可进行分期诊断,国外学者文献报道内镜超声对胃部肿瘤侵犯深度的诊断准确率为 70%~85%[17]。放大内镜对胃肿瘤及早期胃癌的诊断主要基于对表面微结构、微血管及有无明确边界线的判断[18]。苏法等[19]经过研究指出NBI放大内镜联合超声内镜对早期食管癌及癌前病变有着较高的诊断价值。受此研究结果的启发我们在此实验中将研究超声内镜结合放大内镜在胃早癌内镜治疗前的评估价值。虽然胃腔清洁度、黏膜表面出血等会影响结果的判定,但作为新兴的内镜技术,NBI放大内镜以及超声内镜已初步显示出它们的诊断价值,在消化道肿瘤的诊疗中有着广阔的临床应用价值。
评估 ESD 治疗有效性的两个关键指标是整块完整切除率和治愈性切除率[20]。病理组织学表现符合适应症的条件,且切缘阴性、脉管浸润阴性的话,就可判定为治愈性切除。国内孙迪、国外Tate等[21-22]报道 ESD术后整块完整切除率及治愈性切除率为90%左右。本研究中两组病人的结果与文献报道一致,其中对照组病人直接行ESD治疗,治愈性切除97例(82.2%),而观察组经超声内镜结合放大内镜检查后剔除6例病人不符合内镜治疗指征,直接转外科手术治疗,术后的病理结果证实超声内镜结合放大内镜的评估,病变浸润至固有肌层或全层,无内镜治疗指征。其余病人共90例ESD术,治愈性切除84例(93.3%),治愈性切除率观察组明显高于对照组,差异有统计学意义(P<0.05),我们认为这是由于ESD术前超声内镜结合放大内镜准确地评估筛查出了不具备内镜治疗指征的病人。而ESD非治愈性切除后续的治疗为如果基底有肿瘤细胞残留则需要追加手术治疗,周边切缘残留肿瘤细胞可行二次ESD治疗。不论哪种治疗,对病人来说会增加经济及身心负担。本研究中行两次治疗术(ESD+外科手术或ESD+ESD)的病人在对照组和观察组分别为21例(17.8%)和6例(6.3%),差异有统计学意义(P<0.05)。提示ESD术前超声内镜结合放大内镜检查可以提高ESD治愈性切除率,减少二次ESD术及追加手术病人比率,减轻了患者负担。
出血、穿孔是胃ESD的常见并发症。国外研究显示ESD的出血率为 4%,穿孔率为 3.8%[23];国内王一卓、孙运军等[13,24]报道ESD在治疗胃部肿瘤时其出血率为 4.7%,穿孔率为 2.6%。文献[25]报道,胃ESD发生穿孔的高危因素包括:肿瘤位于胃底体,胃壁较薄;肿瘤直径≥30 mm;病变存在溃疡瘢痕,黏膜下合并纤维化。本研究中虽有延迟性出血病例但均通过内镜下钳夹、电凝成功止血,7例穿孔病人中有4例也通过钛夹封闭,恢复良好,对照组3例术中穿孔转外科手术,病理为病变浸润至固有肌层,为ESD术中穿孔的高危因素且符合外科手术指征。对照组和观察组分别有11例、3例病人ESD术后追加外科手术,手术后病理为病变浸润至固有肌层或全层,符合外科手术指征。结合我们的临床经验,我们认为手术技巧的逐步提高及应用超声内镜及放大内镜进行精准的术前评估可以减少ESD严重并发症的出现及术中追加手术病人的几率。
综上所述,我们认为在早期胃癌内镜ESD治疗术前,超声内镜结合放大内镜诊断价值显著,能有效甄别需要外科手术的病人,提高ESD治愈性切除率,减少二次ESD术及追加手术病人比率,具有很好的临床价值。

