红松5个家系未成熟种子的胚性愈伤组织诱导研究
陈士刚 秦彩云 王聪慧 才巨锋 陶晶
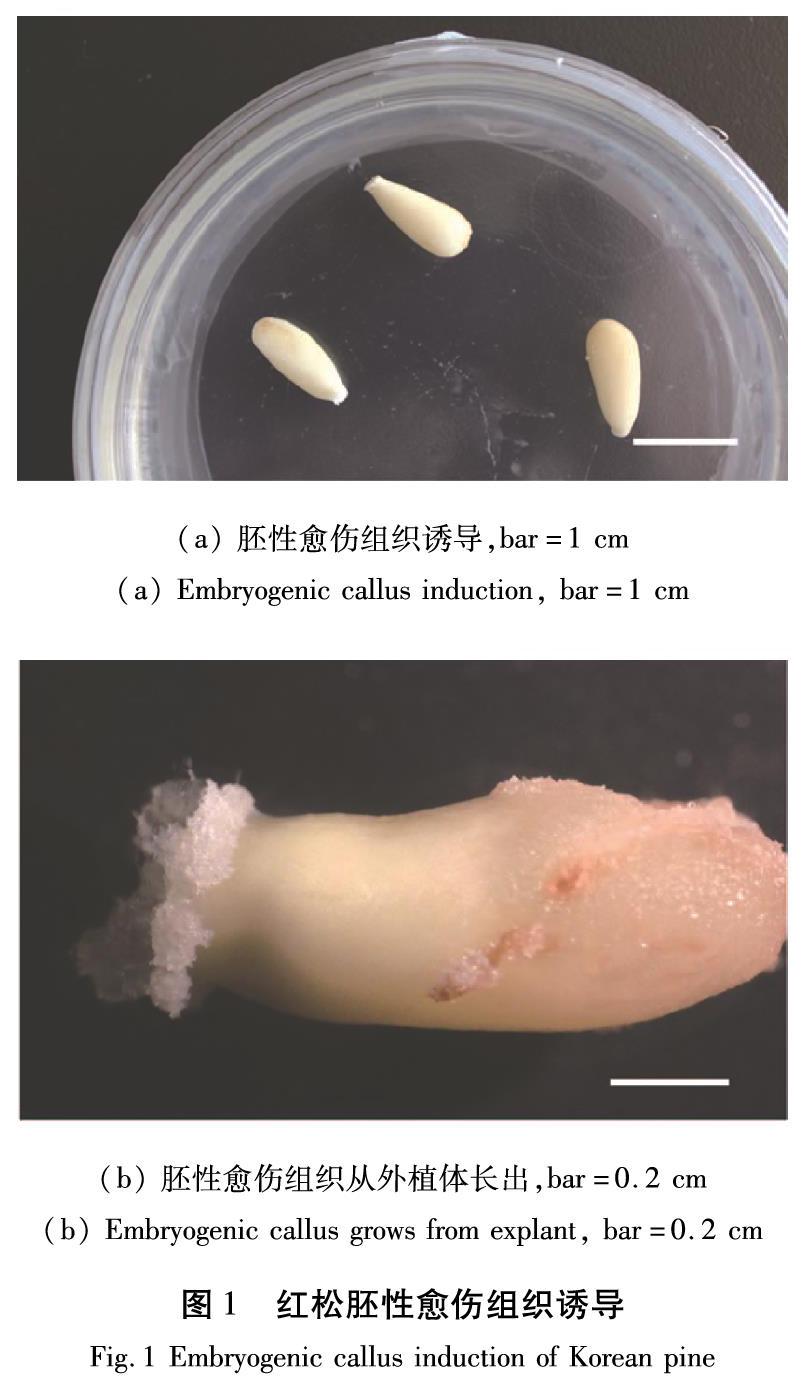

摘 要:红松是重要的用材树种和坚果经济林树种。以组织培养的方法,选用三岔子红松种子园5个家系的未成熟种子作为外植体进行胚性愈伤组织诱导研究。结果表明,不同家系未成熟种子在添加萘乙酸(NAA)2 mg/L + 6-苄氨基嘌呤(6-BA )1 mg/L的培养基上胚性愈伤组织诱导率不同,最佳诱导率为5.68 %。红松愈伤组织诱导的最适蔗糖浓度为30 g/L。选取长势良好的胚性愈伤组织进行超低温保存,在恢复培养10 d后可观察到不同细胞系均有明显新生愈伤组织,15 d后愈伤组织大量增殖。本研究为三岔子红松种子园红松优良种质资源的规模化繁殖和保存奠定了基础。
关键词:红松;红松种子园;胚性愈伤组织;超低温保存;激素组合
中图分类号:S791 文献标识码:A 文章编号:1006-8023(2021)01-0013-05
Abstract:Korean pine is an important timber tree species and nut economic forest tree species. The method of tissue culture was used, the immature seeds of five families from Sanchazi Korean pine seed orchard were selected as explants by tissue culture to study the embryogenic callus induction and cryopreservation. The results showed that immature seeds of different families had different induction rates of embryogenic callus on the medium supplemented with naphthaleneacetic acid (NAA) 2 mg/L + 6-benzylaminopurine (6-BA) 1 mg/L, and the best induction percentage was 5.68 %. The optimal sucrose concentration for the callus induction of Korean pine was 30 g/L. Embryogenic callus with good growth was selected for cryopreservation. After 10 days of recovery culture, it was observed that there were obvious new callus in different cell lines. After 15 days, a large number of callus proliferated. This study laid a foundation for large-scale propagation and conservation of fine germplasm resources of Pinus koraiensis in Sanchazi seed orchard.
Keywords:Pinus koraiensis; Korean pine seed orchard; embryonic callus; cryopreservation; hormone combination
0 引言
植物体细胞胚发生是指体细胞在特定条件下,未经性细胞融合而通过与合子胚发生类似的途径发育成新个体的形态发育过程[1-4]。体细胞胚发生具有以最低成本实现迅速繁殖大量高价值苗木的潜能[5-7]。结合传统的繁殖技术和分子细胞生物技术,体胚发生为促进商业树种的基因改善提供了一个很有价值的工具[8-9]。
红松(Pinus koraiensis Sieb. et Zucc.)为松科松属树种,树高可达40 m。红松又名朝鲜松、果松、海松,是第三纪孑遗树种,同时也是东北温带地带性顶极群落——阔叶红松林的建群种[10-14]。通过体细胞胚胎发生途径使红松优良基因型大规模繁殖,并可实现优良种质资源超低温保存,从而为优良种质资源选育、大规模繁殖以及长期保存提供依据。
本研究以三岔子红松种子园采集的5个家系球果为试材,探究不同家系胚性愈伤组织诱导差异,并进行愈伤组织超低温保存,为红松优良种质资源规模化繁育奠定基础。
1 材料与方法
1.1 试验材料
红松球果2018年7月上旬采于三岔子红松种子园的5个不同家系。球果采回后,用75%的酒精擦拭球果表面,在超净工作台上剥出种子,用75%酒精灭菌2 min,无菌水冲洗3 ~5次,然后再用10%次氯酸钠处理15 min,无菌水冲洗3~5次后待用。
1.2 胚性愈傷组织诱导
1.2.1 胚性愈伤组织诱导适宜激素浓度的筛选
以DCR为基本培养基进行红松胚性愈伤组织诱导,研究萘乙酸(NAA)和6-苄氨基嘌呤(6-BA)两种激素的不同浓度组合对胚性愈伤组织诱导的影响。
基本培养条件为:附加NAA(浓度1 mg/L、2 mg/L和5 mg/L),6-BA(浓度1 mg/L和2 mg/L),培养基内均添加500 mg/L水解酪蛋白、 30 g/L蔗糖、3.5 g/L Phytagel凝胶(Sigma-Aldrich P8169-1KG)和500 mg/L L-谷氨酰胺(过滤灭菌加入)。接种后置于23 ℃暗培养,12周后统计胚性愈伤组织诱导率。
1.2.2 蔗糖浓度对愈伤组织诱导的影响
将红松未成熟胚接种于1.2.1筛选出的最佳激素组合中,分别添加蔗糖20、30、40 g/L,培养基添加500 mg/L水解酪蛋白 、500 mg/L L-谷氨酰胺(L-谷氨酰胺过滤灭菌加入)和 3.5 g/L Phytagel凝胶。接种后置于23 ℃暗培养,12周后统计胚性愈伤组织诱导率。
1.2.3 不同基因型对愈伤组织诱导的影响
将红松5个开放式授粉家系(编号为01#、02#、03#、04#、05#)的未成熟胚分别接种于1.2.2筛选出的最佳培养基中。培养基添加500 mg/L水解酪蛋白 + L-谷氨酰胺500 mg/L + 3.5 g/L Phytagel凝胶。接种后置于23 ℃暗培养,12周后统计胚性愈伤组织诱导率。
1.3 红松愈伤组织超低温保存技术
将长势良好的红松愈伤组织放入无菌的锥形瓶中,加入12 mL的0.4 mol/L 山梨糖醇,25 ℃条件下震荡18 h,加入0.8 mol/L 山梨糖醇1.125 mL、二甲基亚砜(DMSO)1.125 mL,加入0.4 mol/L 山梨糖醇0.75 mL,分装到灭菌的冷冻管中,装于程序降温盒中,然后将程序降温盒放在-80 ℃冰箱2 h后转入液氮中保存。液氮中保存1 d后取出材料进行复苏培养(复苏培养方法为将冷冻管从液氮中取出,放在37 ℃水中3 min,然后转接到愈伤组织增值培养基中)。在培养过程中定期观察愈伤组织状态和增殖情况。
1.4 数据统计与分析方法
试验数据采用 Excel 计算平均值和胚性愈伤组织诱导率。用SPSS 22.0统计分析软件进行单因素方差分析。
胚性组织诱导率=产生胚性愈伤组织的外植体数/接种未染菌外植体数×100% 。
2 结果与分析
2.1 激素浓度对红松胚性愈伤组织诱导的影响
外植体接种(图1(a))后15 d左右胚性愈伤组织开始长出(图1(b))。激素浓度对红松胚性愈伤组织诱导影响较大(表1)。当6-BA浓度为1 mg/L 时,随着NAA浓度的升高,胚性愈伤组织诱导率呈现先增大后减小趋势。当6-BA浓度为2 mg/L时胚性愈伤组织诱导率低于1 mg/L处理。在本试验的6个处理中,NAA 2 mg/L + 6-BA 1 mg/L的胚性愈伤组织诱导率最高(5.68 %),为红松胚性愈伤组织诱导的适宜激素浓度。
2.2 蔗糖浓度对红松胚性愈伤组织诱导的影响
蔗糖浓度对红松愈伤组织诱导率的影响见表2,随着蔗糖浓度的升高,愈伤组织诱导率呈现先升高后降低趋势。当蔗糖浓度为30 g/L时,愈伤组织诱导率最高,为红松愈伤组织诱导的适宜蔗糖浓度。
2.3 红松不同家系未成熟种子胚性愈伤组织诱导比较
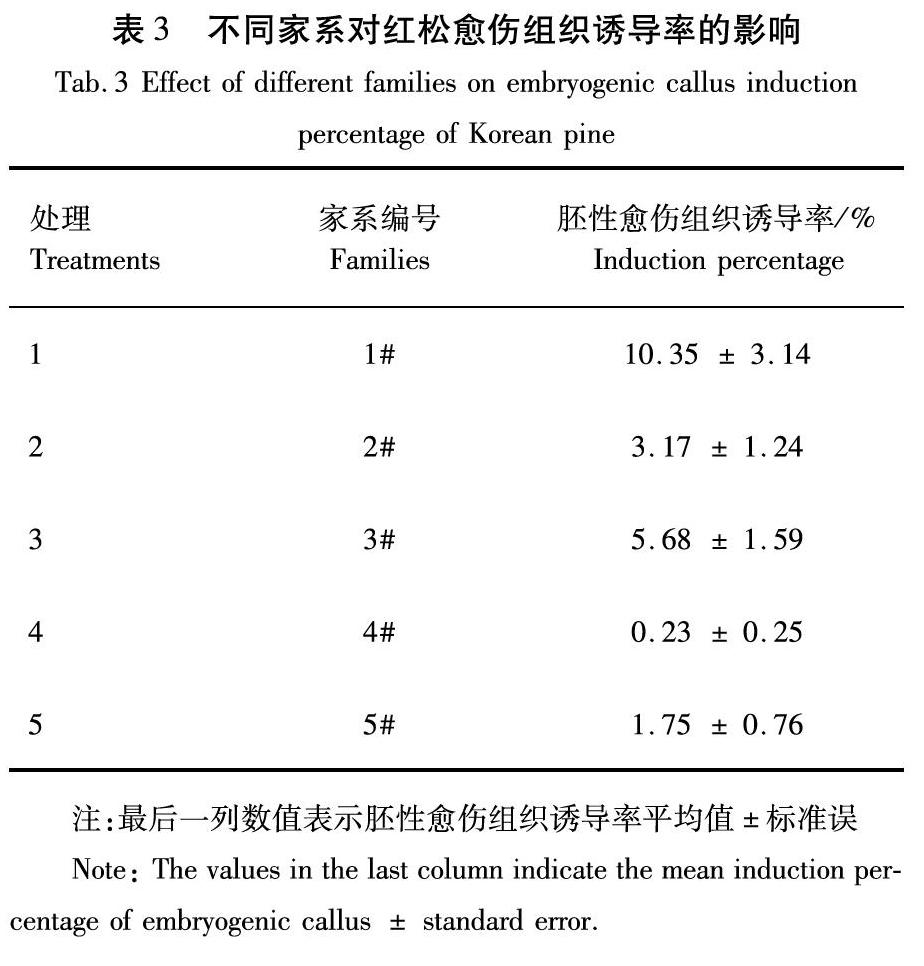
针对红松不同家系未成熟种子胚性愈伤组织诱导率差异见表3。红松5个家系未成熟胚均可诱导胚性愈伤,但是诱导率差距很大。1#家系胚性愈伤组织诱导率最好,是易于诱导出胚性愈伤组织的基因型;3#的诱导率次之;4#家系愈伤组织诱导率最低。
2.4 红松胚性愈伤组织增殖和超低温保存
选取长势良好的胚性愈伤组织(图2(a))进行超低温保存,将37 ℃水浴解冻好的冷冻管中愈伤组织用移液枪取出,吸干表面水分后置于增殖培养基上恢复培养,为降低冷冻保护剂对愈伤组织的伤害,培养1 d后转移至新的增殖培养基上。10 d后可以观察到不同细胞系均有明显的新生愈伤组织,15 d后大量增殖,表明不同家系胚性愈伤组织经过超低温保存后细胞可以恢复活力(图2(b))。
3 讨论
植物生长调节物质的种类与浓度是愈伤组织诱导的关键因素[11]。在试验过程中,较低浓度的细胞分裂素6-BA与较高浓度的生长素2,4-D或NAA等的组合被证明是针叶树种愈伤组织诱导的适合植物生长调节物质配比[11]。在长白落叶松(Larix olgensis)胚性愈伤组织诱导过程中发现,2,4-D浓度对胚性愈伤组织诱导率影响显著[15]。在本试验的6个处理中NAA 2 mg/L + 6-BA 1 mg/L组合愈伤组织诱导率最高,为红松愈伤组织诱导的适宜激素浓度。
培养基的渗透压影响着植物的脱分化、再分化及器官的形成,针叶树种也不例外[9],糖不僅是渗透调节物质,还是培养基的碳源和能源[16-17],蔗糖浓度对愈伤组织的诱导率具有重要的影响[18-24],在胚性愈伤组织诱导过程中一般以蔗糖作为主要碳源[25-26]。研究发现,蔗糖30 g/L为胚性愈伤组织诱导的适宜浓度,这个结果与高等研究结果不同[24]。
针叶树愈伤组织在增殖过程中常出现体胚发生能力逐渐减弱的现象[25],因此需要将活力旺盛的胚性愈伤组织进行超低温保存,当需要时从液氮中取出恢复培养,以备随时开展试验。本研究以红松不同家系的胚性愈伤组织为试材,实现了红松胚性愈伤组织超低温保存与恢复培养,超低温保存后细胞可以恢复活力,这为红松优良胚性愈伤组织保存提供了保障。
【参 考 文 献】
[1]LELU-WALTER M A, GAUTIER F, ELIOV K, et al. High gellan gum concentration and secondary somatic embryogenesis: two key factors to improve somatic embryo development in Pseudotsuga menziesii [Mirb.][J]. Plant Cell, Tissue and Organ Culture (PCTOC), 2017, 132(1): 137-155.
[2]REEVES C, HARGREAVES C, TRONTIN J F, et al. Simple and efficient protocols for the initiation and proliferation of embryogenic tissue of Douglas-fir[J]. Trees, 2018, 32(1): 175-190.
[3]MONTEUUIS O. Micropropagation and production of forest trees[M]. Suwon: Vegetative Propagation of Forest Trees, 2016.
[4]KLIMASZEWSKA K, OVERTON C, STEWART D, et al. Initiation of somatic embryos and regeneration of plants from primordial shoots of 10-year-old somatic white spruce and expression profiles of 11 genes followed during the tissue culture process [J]. Planta, 2011, 233(3): 635-647.
[5]ELHITI M, STASOLLA C. The use of zygotic embryos as explants for in vitro propagation: an overview [J]. Methods in Molecular Biology, 2010, 710: 229-255.
[6]SALAJ T, MATUSOVA R, SALAJ J. Conifer somatic embryogenesis - an efficient plant regeneration system for theoretical studies and mass propagation[J]. Dendrobiology, 2015, 74: 69-76.
[7]HERINGER A S, SANTA-CATARINA C, SILVEIRA V. Insights from proteomic studies into plant somatic embryogenesis[J]. Proteomics, 2018, 18(5-6): 1700265.
[8]MONTALBN I A, GARCA-MENDIGUREN O, GOICOA T, et al. Cold storage of initial plant material affects positively somatic embryogenesis in Pinus radiata[J]. New Forests, 2015, 46(2): 309-317.
[9]KLIMASZEWSKA K, HARGREAVES C, LELU-WALTER M A, et al. Advances in conifer somatic embryogenesis since year 2000[J]. Methods in Molecular Biology, 2016, 1359: 131-166.
[10]李常准,陈立新,段文标,等.氮磷湿沉降对2种林型红松林土壤活性有机碳及养分的影响[J].东北林业大学学报,2020,48(2):47-53.
LI C Z, CHEN L X, DUAN W B, et al. Effects of wet deposition of N and P on soil active organic carbon and nutrients in two types of Korean pine forests[J]. Journal of Northeast Forestry University, 2020, 48(2): 47-53.
[11]高芳,沈海龙,刘春苹,等.红松成熟胚愈伤组织诱导外植体选择及培养条件优化[J].南京林业大学学报(自然科学版),2017,41(3):43-50.
GAO F, SHEN H L, LIU C P, et al. Optimization of culture conditions and selection of suitable explants for callus induction from mature embryo of Pinus koraiensis[J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2017, 41(3): 43-50.
[12]付羚,張訸,罗旭璐,等.樟叶越桔愈伤组织诱导及其细胞悬浮培养体系建立[J].西部林业科学,2019,48(5):119-124.
FU L, ZHANG H, LUO X L, et al. Callus induction and establishment of suspension culture system of vaccinium dunalianum[J]. Journal of West China Forestry Science, 2019, 48(5):119-124.
[13]闫平玉,王鹏,杨维满,等.红松种子园结实性状分析及优良无性系选择[J].森林工程,2020,36(6):19-29.
YAN P Y, WANG P, YANG W M, et al. Analysis of seeding characters of Korean pine seed orchard and selection of excellent clones[J]. Forest Engineering, 2020, 36(6):19-29.
[14]王祎,赵彤彤,杨魏,等.红松成熟合子胚愈伤组织诱导的适宜培养条件[J].森林工程,2015,31(2):5-7.
WANG Y, ZHAO T T, YANG W, et al. Proper condition for callus induction from mature zygotic embryo explants of Pinus koraiensis[J]. Forest Engineering, 2015, 31(2):5-7.
[15]宋跃,甄成,张含国,等.长白落叶松胚性愈伤组织诱导及体细胞胚胎发生[J].林业科学,2016,52(10):45-54.
SONG Y, ZHEN C, ZHANG H G, et al. Embryogenic callus induction and somatic embryogenesis from immature zygotic embryos of Larix olgensis[J]. Scientia Silvae Sinicae, 2016, 52(10): 45-54.
[16]魏黔春,江泽平,刘建锋,等.侧柏古树扦插试验及插穗营养物质变化[J].南京林业大学学报(自然科学版),2020,44(1):63-71.
WEI Q C,JIANG Z P,LIU J F,et al.Effects of several factors on rooting of cutting propagation of ancient Platycladus orientalias and the changes of nutritive material[J].Journal of Nanjing Forestry University(Natural Science Edition),2020,44(1):63-71.
[17]KUBE M, DRN N, KONRDOV H, et al. Robust carbohydrate dynamics based on sucrose resynthesis in developing Norway spruce somatic embryos at variable sugar supply[J]. In Vitro Cellular & Developmental Biology - Plant, 2014, 50(1): 45-57.
[18]李琰,杨广隶,冯俊涛,等.碳源及植物生长调节剂对雷公藤愈伤组织生长和次生代谢产物含量的影响[J].林业科学,2010,46(9):34-39.
LI Y, YANG G L, FENG J T, et al. Effects of carbon sources and plant growth regulators on callus growth and secondary metabolite content of Tripterygium wilfordii[J]. Scientia Silvae Sinicae, 2010, 46(9): 34-39.
[19]JAYARAMAN S, DAUD N H, HALIS R, et al. Effects of plant growth regulators, carbon sources and pH values on callus induction in Aquilaria malaccensis leaf explants and characteristics of the resultant calli[J]. Journal of Forestry Research, 2014, 25(3): 535-540.
[20]佘露露,王偉娟,宋静静,等.低温驯化对西藏绵头雪莲愈伤组织抗冻性及抗氧化能力的影响[J].南京林业大学学报(自然科学版),2019,43(5):181-186.
SHE L L,WANG W J,SONG J J,et al.Effect of cold acclimation on freezing tolerance and antioxidant enzyme activities of callus of Tibet Saussurea laniceps Hand.-Mazz[J].Journal of Nanjing Forestry University(Natural Science Edition),2019,43(5):181-186.
[21]史昆,杨模华,李志辉,等.蔗糖与肌醇对马尾松胚性细胞系增殖的影响[J].植物生理学报,2014,50(6):785-791.
SHI K, YANG M H, LI Z H, et al. Effects of sucrose and myo-inositol on proliferation of embryogenic cell lines in Pinus massoniana[J]. Plant Physiology Journal, 2014, 50(6): 785-791.
[22]谭亚婷,尚俊可,罗旭璐,等.生长素对樟叶越桔离体培养物次生代谢物含量的影响[J].西部林业科学,2020,49(1):133-139.
TAN Y T, SHANG J K, LUO X L, et al. Effects of auxin on the content of secondary metabolites in vitro culture of vaccinium dunalianum[J]. Journal of West China Forestry Science, 2020, 49(1):133-139.
[23]季孔庶,王潘潘,王金铃,等.松科树种的离体培养研究进展[J].南京林业大学学报(自然科学版),2015,39(1):142-148.
JI K S, WANG P P, WANG J L, et al. Review on in vitro culture of tree species in Pinaceae[J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2015, 39(1): 142-148.
[24]PULLMAN G S, BUCALO K. Pine somatic embryogenesis: analyses of seed tissue and medium to improve protocol development[J]. New Forests, 2014, 45(3): 353-377.
[25]GAO F, PENG C, WANG H, et al. Key techniques for somatic embryogenesis and plant regeneration of Pinus koraiensis[J]. Forests, 2020, 11(9):912.
[26]LI Q F, DENG C, ZHU T Q, et al. Dynamics of physiological and miRNA changes after long-term proliferation in somatic embryogenesis of Picea balfouriana[J]. Trees, 2019, 33(2): 469-480.

