克氏原螯虾嗜水气单胞菌噬菌体的分离鉴定和应用
霍诗天 焦厚琪 李 清 顾泽茂 刘学芹
(1.华中农业大学水产学院水生动物医学系, 武汉 430070; 2.湖北省水生动物病害防控工程技术研究中心, 武汉 430070;3.水产养殖国家级实验教学示范中心, 武汉 430070)
克氏原螯虾(Procambarus clarkii)隶属于节肢动物门, 甲壳纲, 十足目, 爬行亚目, 螯虾科。随着克氏原螯虾养殖业的迅速发展, 克氏原螯虾的病害问题也随之增多, 其中一些疾病暴发原因尚不明确,疾病防治也只是采用一些常规水产动物疾病防治手段, 缺少针对克氏原螯虾病害的有效措施, 致使养殖产量锐减, 目前国内报道引起克氏原螯虾大规模发病的病原主要有嗜水气单胞菌(Aeromonas hydrophilia)[1]、副溶血弧菌(Vibrio parahaemolyticus)[2]和弗氏柠檬酸杆菌(Citrobcter freundii)[3]等。
嗜水气单胞菌(Aeromonas hydrophila)隶属于弧菌科(Aeromondaceae)、气单胞菌属(Aeromonas)[4,5],是有运动能力, 两端钝圆, 极端单鞭毛的革兰氏阴性杆菌[6]。在感染鱼类后主要引发细菌性败血症和肠炎, 还能够引起皮肤溃烂和坏死等症状[7], 是淡水养殖中重要的条件致病菌, 能引起斑点叉尾鮰、草鱼、青鱼、团头鲂和鲫等多种淡水养殖鱼类出血性败血症的暴发[8]。该病原对克氏原螯虾也有较大的危害, 感染嗜水气单胞菌的克氏原螯虾在发病初期无明显症状, 感染后期不摄食, 反应迟钝, 应激能力减弱, 螯足及附肢无力, 解剖后可见肝胰腺颜色淡黄, 腹节背部肌肉苍白[9], 可造成严重的经济损失[1]。
噬菌体是病毒的一种, 其特别之处是以细菌、支原体、螺原体和蓝细菌等为宿主的病毒[10], 因此又被称为细菌病毒, 广泛存在于自然界中[11—13]。由于现在抗生素的大量使用, 致使许多细菌产生耐药性, 甚至出现了许多的超级细菌。由于噬菌体专一性等特点, 噬菌体治疗逐渐被应用, d’Herelle[14—16]和Twort[17]最早通过治疗实验证实了噬菌体的安全性, 并且证实噬菌体具有治疗细菌病的作用。在水产养殖中, 细菌性疾病自始至终是制约大规模养殖的一个重要因素, 抗生素的长期使用使许多细菌产生了耐药性, 因此在抗生素治疗无效后, 噬菌体治疗成为一个首选的治疗方案。
嗜水气单胞菌噬菌体在国内外已有较多研究,我国于1994年首次分离出嗜水气单胞菌噬菌体[18]。王志丽等[19]从中华鳖中分离到嗜水气单胞菌噬菌体, 前者对其理化性质进行了研究, 后者发现分离的噬菌体对嗜水气单胞菌具有明显的抑制效果[20]。在治疗实验中, 高珊珊[21]通过动物试验评估了噬菌体疗法的安全性和有效性, 一些实验表明, 在用噬菌体处理感染细菌的泥鳅以后, 泥鳅的死亡率显著下降[22], 用噬菌体治疗感染细菌的斑马鱼后, 其存活率显著提高[23]。此外, 新研发的新型噬菌体制剂BAFADOR®对鱼类机体具有良好的耐受性, 可刺激细胞和体液免疫, 降低嗜水气单胞菌感染后欧洲鳗的死亡率[24]。而且有些噬菌体对细菌的抑制作用强于抗生素, 并且在使用之后没有出现不良的免疫反应[25]。对于一些携带内源性抗生素耐药基因的嗜水气单胞菌临床分离株引起的生物膜, 所分离到的一些新型噬菌体证明能够对其造成有效的破坏[26]。
因此, 本研究以本课题组之前从患病克氏原螯虾组织中分离到的致病性嗜水气单胞菌Ah-0为宿主菌, 对从湖泊河流中分离到的一株烈性噬菌体Ph-0进行了分离和鉴定, 及生物学特性的分析, 随后研究了噬菌体Ph-0对人工感染Ah-0克氏原螯虾的保护效果研究。以期为噬菌体治疗克氏原螯虾细菌性疾病的防治和治疗提供基础和依据。
1 材料与方法
1.1 菌株和实验动物
嗜水气单胞菌Ah-0于本实验室保存。
健康克氏原螯虾购自武汉白沙洲水产品市场,体长11.0—14.0 cm, 体重30.0—38.0 g, 水族箱中盛入少量水, 暂养1周以后, 挑选无异常健康的克氏原螯虾供试验使用。
1.2 主要仪器与试剂
本研究使用的主要试剂(蛋白胨、酵母提取物、氯化钠、琼脂粉等)、培养基(LB、LA、半固体等)、仪器(培养箱、摇床、离心机等)均参考文献[19, 27]。
1.3 噬菌体的分离及纯化
分离步骤参考文献[27—29], 首先将采集的水样经无菌纱布过滤掉明显的杂质, 再5000 r/min, 离心10min后, 收集上清, 得到噬菌体的原液; 取噬菌体原液300 mL, 加入到3倍营养物质的LB液体培养基中, 加入宿主菌, 培养4—6h, 收集菌悬液5000 r/min,离心10min, 收集上清液, 即得到增殖后的噬菌体原液。取噬菌体原液200与500 μL的嗜水气单胞菌Ah-0混合, 室温放置10min后与8 mL LB半固体培养基混合均匀, 倾倒于LB固体培养基上, 待凝固后,倒置放入恒温培养箱培养12—24h, 直到出现噬菌斑。用接种环挑取形态大小有明显差异的噬菌斑,纯化3次。纯化后的噬菌体按8∶2的比例加入噬菌体和甘油, -80℃保存。
1.4 噬菌体生物学特性的测定
最佳感染复数的测定: 取处于对数生长期的宿主菌悬液, 分别加入MOI值为0.0001、 0.001、0.01、0.1、1、10、100的噬菌体原液, 放置于恒温振荡培养箱中, 28℃, 180 r/min震荡培养8h, 5000 r/min离心10min, 收集上清液。双层平板法测定噬菌体的滴度, MOI值最高的即为噬菌体最佳感染复数。
一步生长曲线的测定: 以感染复数为0.1 MOI加入宿主菌和噬菌体, 放置于28℃恒温水浴锅中培养20min, 使噬菌体充分的吸附在宿主菌上; 之后12000 r/min离心5min, 去除上清液。加入1 mL LB培养基悬浮菌体沉淀, 重复离心, 去上清2次, 去除未吸附的噬菌体。最后用5 mL LB液体培养基重悬沉淀, 放置于28℃恒温震荡培养箱中培养, 并开始计时, 每隔10min取样100 μL, 直到3h后停止, 用双层平板法测定噬菌体的滴度。最后以感染时间为横坐标, 噬菌体的滴度为纵坐标绘制噬菌体的一步生长曲线, 得出噬菌体的潜伏期、裂解期。
噬菌体的热稳定性: 将等量的噬菌体原液分装于EP管中, 分别于4℃、20℃、40℃、50℃、60℃、70℃、80℃水浴中作用1h。在时间结束后, 立刻取出, 测定噬菌体的滴度。
噬菌体的pH稳定性: 按10%的比例将噬菌体加入pH分别为3、5、7、9、11的培养基中。28℃水浴1h。测定噬菌体的滴度。
噬菌体对紫外线的敏感性: 将噬菌体置于紫外灯下进行照射, 时间分别为10s、20s、30s、1min、2min、3min、6min、9min、12min、15min、18min和21min, 测定噬菌体的滴度。
噬菌体对氯仿的敏感性: 取1 mL的噬菌体原液, 加入终浓度为5%的氯仿, 28℃水浴, 时间分别为0、3min、6min、9min、12min、15min和18min,测定噬菌体的滴度。
1.5 噬菌体核酸基因组片段大小鉴定
取纯化的噬菌体颗粒, 采用《分子克隆实验指南》(第三版)中λ噬菌体DNA提取方法提取噬菌体核酸, 将提取的噬菌体核酸在8 g/L的琼脂糖凝胶中电泳检测。
1.6 嗜水气单胞菌Ah-0对克氏原螯虾LC50的测定
注射实验设置102—108CFU/mL 7个等比浓度梯度的菌液, 每组投放克氏原螯虾10只, 腹部注射, 20 μL/只虾, 此外注射等量的PBS作为对照,每隔6—12h观察一次, 并对于死亡数进行记录, 在试验结束后, 将结果进行统计, 采用寇氏法计算菌株Ah-0 72h内的LC50。
浸泡实验设置6个浓度梯度和一个对照组,浓度为0和1×107—3.2×108CFU/mL六个等比浓度梯度菌液, 每组投放克氏原螯虾20只, 每24h换一次菌液, 每隔6—12h观察一次, 在试验结束后, 将结果进行统计, 采用寇氏法计算菌株Ah-0 72h内的LC50。
1.7 噬菌体Ph-0的对克氏原螯虾的安全性试验
克氏原螯虾腹节背部注射不同滴度的噬菌体原液20 μL, 噬菌体的滴度为104—108PFU/mL 5个等比浓度梯度的噬菌体, 对照组注射等量PBS 缓冲液, 每组投放克氏原螯虾10只, 每隔6—12h观察其行为和症状, 72h后剖检观察体内器官的临床变化并选其鳃、肝胰腺、心脏做切片观察病理变化。
1.8 噬菌体治疗人工感染克氏原螯虾试验
注射噬菌体注射治疗人工感染克氏原螯虾试验分为6组, 两组对照组包括空白对照PBS组和攻毒Ah-0组, 菌液注射浓度为2.1×107CFU/mL,腹节背部注射20 μL/只, 设置4个治疗梯度, 分别注射0.001、0.01、0.1和1 MOI的噬菌体, 腹节背部注射20 μL/只, 每组投放克氏原螯虾10只, 每隔6—12h观察其行为和症状, 将结果进行统计, 72h后剖检观察体内器官的临床变化并选其鳃、肝胰腺、心脏做切片观察病理变化。
浸泡噬菌体浸泡治疗人工感染克氏原螯虾试验分为6组, 两组对照组包括空白对照组和攻毒Ah-0组, 菌液浸泡浓度为3.5×108CFU/mL, 设置4个治疗梯度, 分别加入0.001、0.01、0.1和1 MOI的噬菌体, 每组投放克氏原螯虾20只, 每隔6—12h观察其行为和症状, 将结果进行统计, 试验结束后剖检观察体内器官的临床变化并选其鳃、肝胰腺、心脏做切片观察病理变化。
1.9 组织病理观察
取克氏原螯虾的鳃、心脏、肝胰腺于4%的多聚甲醛中, 固定24h后送武汉百仟度生物科技有限公司进行HE染色并拍照。
2 结果
2.1 噬菌分离和纯化
以Ah-0为宿主菌分离纯化到一株烈性噬菌体,将其命名为Ph-0。在28℃恒温培养箱中与宿主菌Ah-0共培养12h后可形成具有明显边界的圆形噬菌斑, 经测量, 噬菌斑的直径约为4 mm, 外层存在1 mm左右的半透明晕环(图1)。
2.2 噬菌体的最佳感染复数
如表1所示, 在与宿主菌共培养4h后, 当MOI为0.1时, 噬菌体Ph-0的滴度最高, 为4.85×107PFU/mL,因此噬菌体Ph-0的最佳感染复数为0.1 MOI。
2.3 噬菌体的一步生长曲线
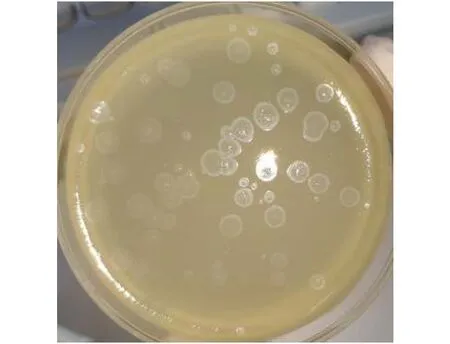
图1 噬菌体Ph-0噬菌斑形态Fig.1 Plaques shape of phage Ph-0
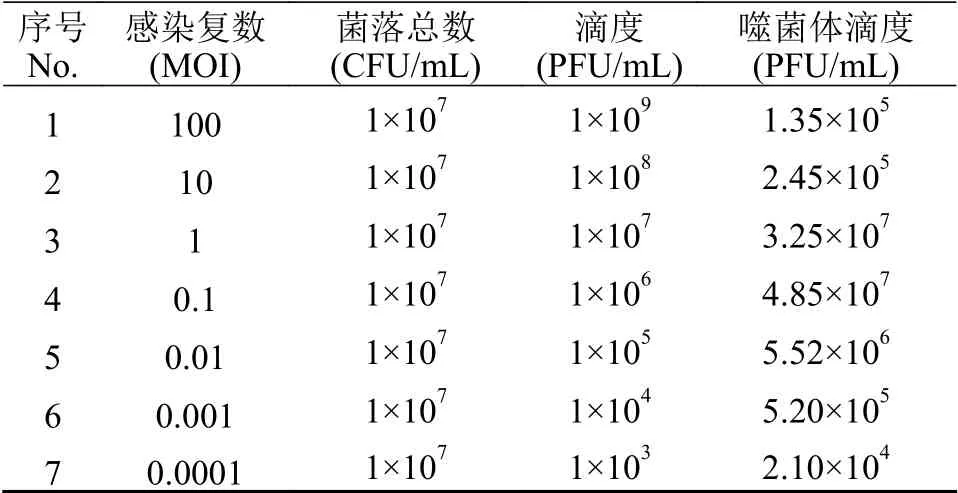
表1 噬菌体Ph-0的最佳感染复数Tab.1 The optimal MOI of phage Ph-0
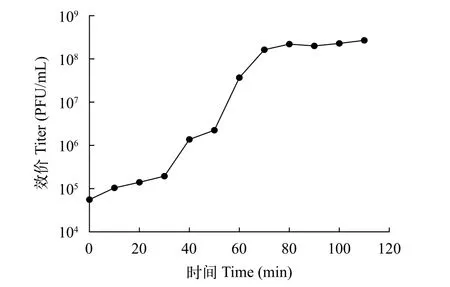
图2 噬菌体Ph-0的一步生长曲线Fig.2 One-step growth curve of phage Ph-0
如图2所示, 噬菌体 Ph-0的潜伏期约持续20min, 裂解期约持续70min, 90min后进入平台期。
2.4 噬菌体的热稳定性
如图3所示, 从结果中可以看出, 当温度处于4—40℃时噬菌体的滴度无明显变化, 当温度上升到50℃时噬菌体滴度下降到1×106PFU/mL左右, 当温度大于等于60℃, 噬菌体Ph-0的滴度出现明显的降低, 当温度超过70℃时, 已经观察不到明显的噬菌斑。
2.5 噬菌体的酸碱稳定性
如图4所示, 在经过梯度PH处理后, 噬菌体的活性在pH 3—11没有太大的变化, 相对稳定, 噬菌体Ph-0的滴度仍保持在1× 107PFU/mL左右, 与pH=7相比较, 在pH=3时, 噬菌体的滴度下降到1×106PFU/mL左右, 在pH=11时, 噬菌体的滴度下降到1×105PFU/mL左右, 总体来说, pH在3—9时,所分离噬菌体的滴度范围处于1×106—1× 107PFU/mL,未出现明显的改变。
2.6 噬菌体对紫外线的敏感性
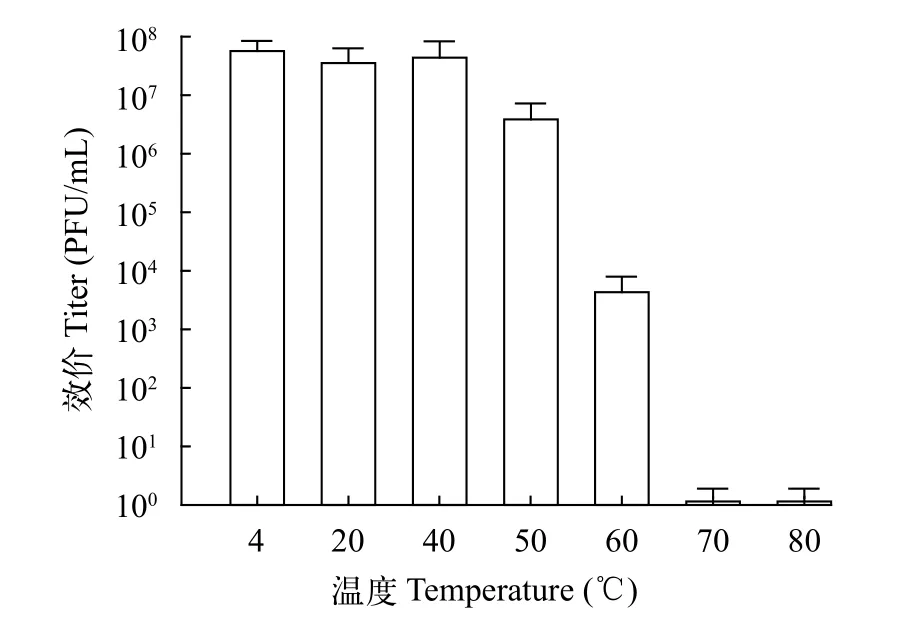
图3 噬菌体Ph-0的热稳定性Fig.3 Thermo-stability of phage Ph-0
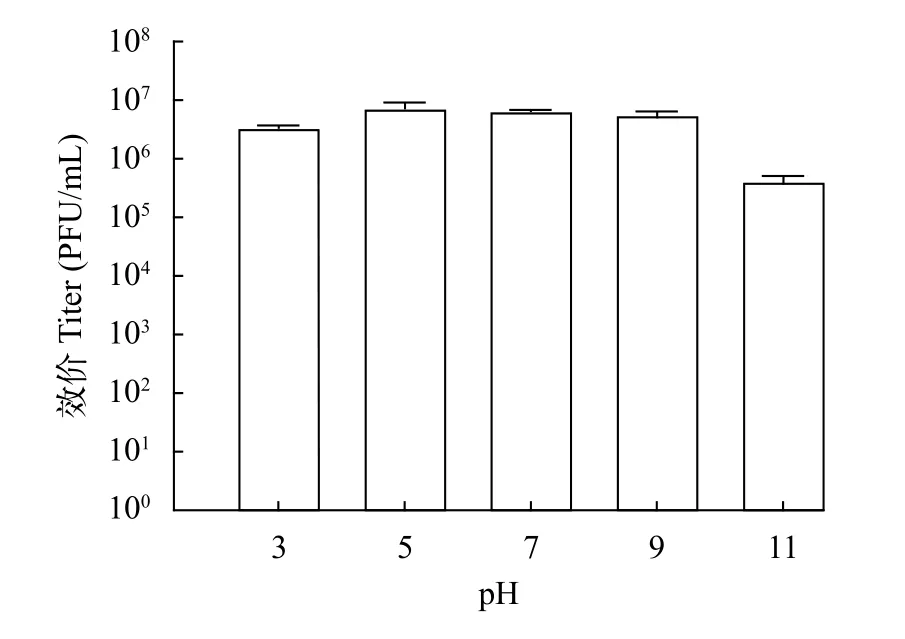
图4 噬菌体Ph-0的酸碱稳定性Fig.4 The pH stability of Ph-0
结果表明经过不同时间的紫外线处理后(图5),噬菌体的活性有明显的变化, 从结果中可以看出,当在紫外线处理3min后, 噬菌体的滴度从107降到102PFU/mL左右, 在紫外线处理9min后, 在平板上已经观察不到明显的噬菌斑。
2.7 噬菌体对氯仿的敏感性
噬菌体经有机试剂氯仿处理后(图6), 噬菌体的活性受氯仿的影响很大, 结果显示, 当处理时间为3min时, 当时间达到6min时, 只能形成几个噬菌斑, 当处理时间进一步延长, 已经无法形成明显的噬菌斑。
2.8 噬菌体核酸类型的鉴定
噬菌体基因组利用蛋白酶K/SDS的方法提取,由图7可知, 噬菌体Ph-0核酸基因组能被DNaseⅠ完全降解而不能被RNase A和Mung Bean Nuclease降解, 因此噬菌体Ph-0的核算类型为双链DNA。
2.9 嗜水气单胞菌对克氏原螯虾在72h之内的LC50
采用注射法, 嗜水气单胞菌对克氏原螯虾在72h之内的LC50为1.5×106CFU/mL; 采用浸泡法, 嗜水气单胞菌对克氏原螯虾在72h之内的LC50为5.6×107CFU/mL。
2.10 噬菌体对克氏原螯虾的安全性试验结果
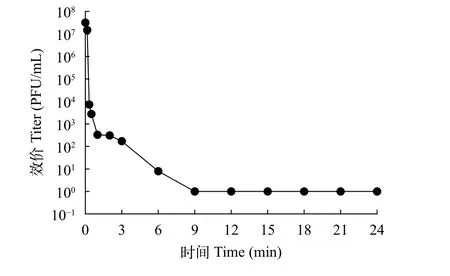
图5 紫外线对噬菌体活性的影响Fig.5 The effect of UV on the phage activity
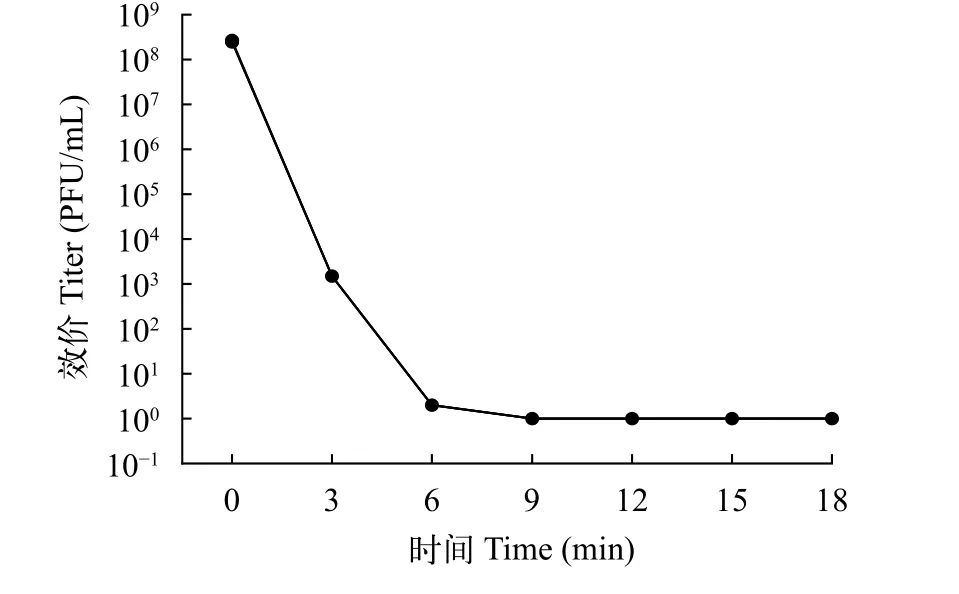
图6 氯仿对噬菌体活性的影响Fig.6 The effect of trichloromethane on the phage activity
克氏原螯虾在注射噬菌体Ph-0后, 各浓度下都没有死亡, 在解剖以后, 各组织从观察结果来看与阴性对照组在表观上没有明显的差别, 由图8的组织切片可知, 与注射PBS的阴性对照组相比, 注射噬菌体后克氏原螯虾的鳃、心脏和肝胰腺均未出现明显的病理变化, 未对上述器官造成明显的损伤,说明该噬菌体对克氏原螯虾没有明显的毒性。
2.11 噬菌体注射治疗对人工感染嗜水气单胞菌的克氏原螯虾的保护效果
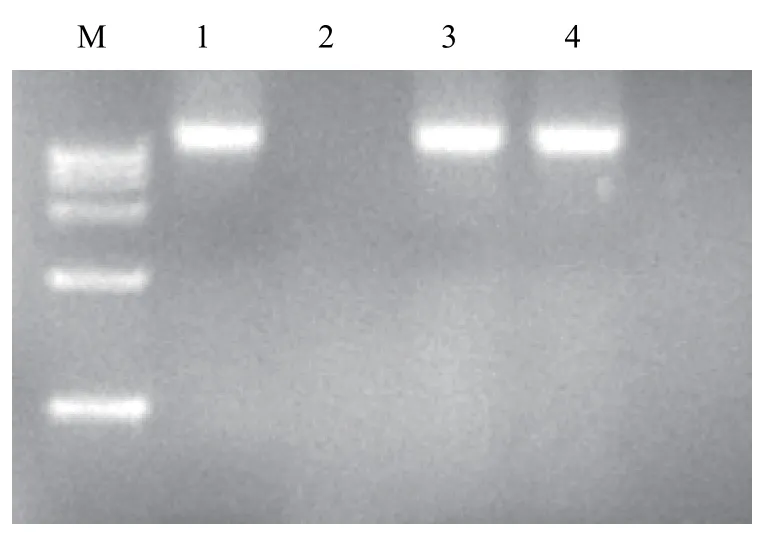
图7 噬菌体Ph-0基因组琼脂糖凝胶电泳图Fig.7 Agarose gel electrophoresis of Ph-0 genomic
从图9中可看出, 在只注射嗜水气单胞菌的攻毒组中, 克氏原螯虾全部死亡, 而经过噬菌体Ph-0注射治疗组中, 均有一定的保护效果, 对感染嗜水气单胞菌的克氏原螯虾的保护作用与噬菌体Ph-0的浓度有关, 当噬菌体的浓度达到3.5×106CFU/mL时, 对于克氏原螯虾的保护效果最好, 保护效率可以达到66%。
2.12 噬菌体注射治疗对人工感染嗜水气单胞菌的克氏原螯虾的病理观察
鳃组织的病理变化: 由图10可知, 对照组中正常克氏原螯虾的鳃丝结构完整, 排列整齐, 鳃丝内细胞分布均匀, 无聚集现象(图10A); 感染细菌组克氏原螯虾的鳃丝有断裂出现, 鳃丝略显肿大, 大量细胞脱落死亡, 造成组织空泡化现象, 有多处明显的血淋巴细胞浸润, 此外角质膜也有增厚的现象(图10B); 在治疗组Ah+Phage中, 虽仍有细胞聚集的现象, 但没有出现大量的血淋巴细胞浸润, 细胞间界限明显, 鳃丝除部分边缘模糊外, 整体保持完整, 无断裂现象, 角质膜的厚度也恢复到正常水平,总体结构保持完整(图10C)。
心脏组织的病理变化: 对照组正常克氏原螯虾的心脏结构完整, 肌丝均匀排列(图10D); 注射细菌组克氏原螯虾的心脏肌丝排列不均与, 心肌纤维出现弯曲肿大且断裂的现象, 横纹肌模糊, 出现脓染血细胞(图10E); 在治疗组Ah+Phage中, 克氏原螯虾心脏的结构保持完成, 但心肌纤维肿大现象明显,仍然有部分细胞聚集(图10F)。
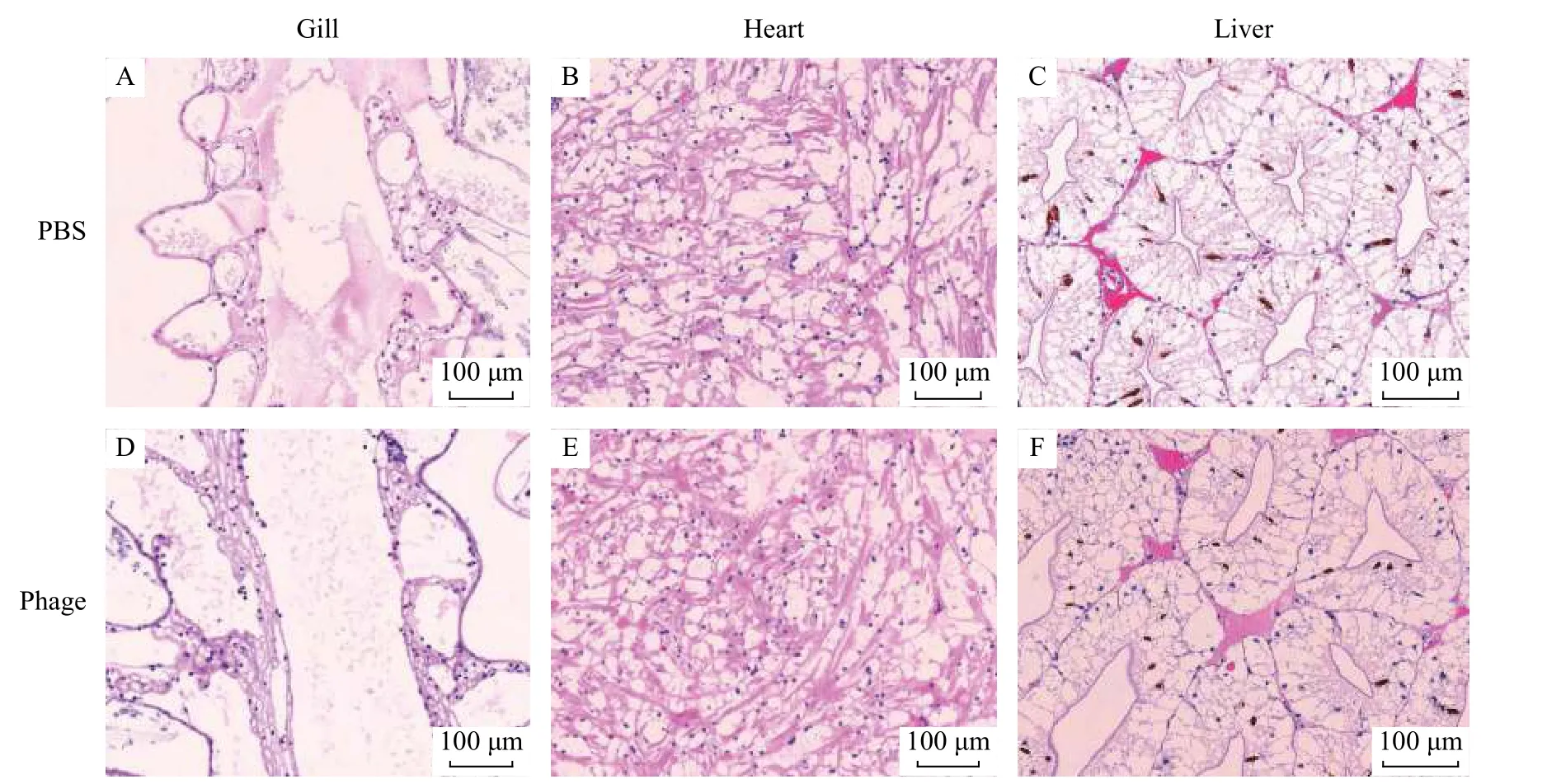
图8 克氏原螯虾注射噬菌体Ph-0后的组织切片观察结果Fig.8 Tissue section observation of Procambarus clarkii after injection of phage Ph-0
肝胰腺组织的病理变化: 对照组正常克氏原螯虾的肝胰腺肝小管间界限明显清晰, 肝小管之间通过正常的结缔组织连接, 细胞分布均匀饱满, 形态正常(图10G); 注射细菌组克氏原螯虾的肝胰腺中无成型的细胞, 大量细胞死亡, 脱落, 使得组织中出现大量的空泡, 管腔中棕色颗粒物质颜色加深且数量增多, 肝小管之间间隙明显增大并且界限模糊不清, 肝小管及连接肝小管的结缔组织全部坏死, 已经无明显的结构特征(图10H); 在治疗组Ah+Phage中的肝胰腺基本恢复到正常的形态, 部分细胞脱落死亡, 肝小管有收缩现象, 连接肝小管的结缔组织部分被破坏(图10I)。
2.13 噬菌体浸泡治疗对人工感染嗜水气单胞菌的克氏原螯虾的保护效果
由图11可知, 在对照组全部死亡的前提下, 只有当加入噬菌体的量为0.1 MOI时有一定的保护效果, 保护效率20%左右。
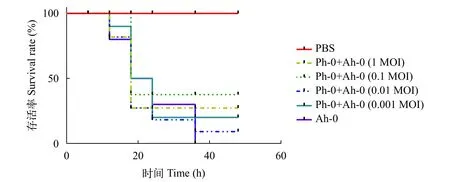
图9 克氏原螯虾存活率及死亡时间Fig.9 Survival rate and time of death of Procambarus clarkii
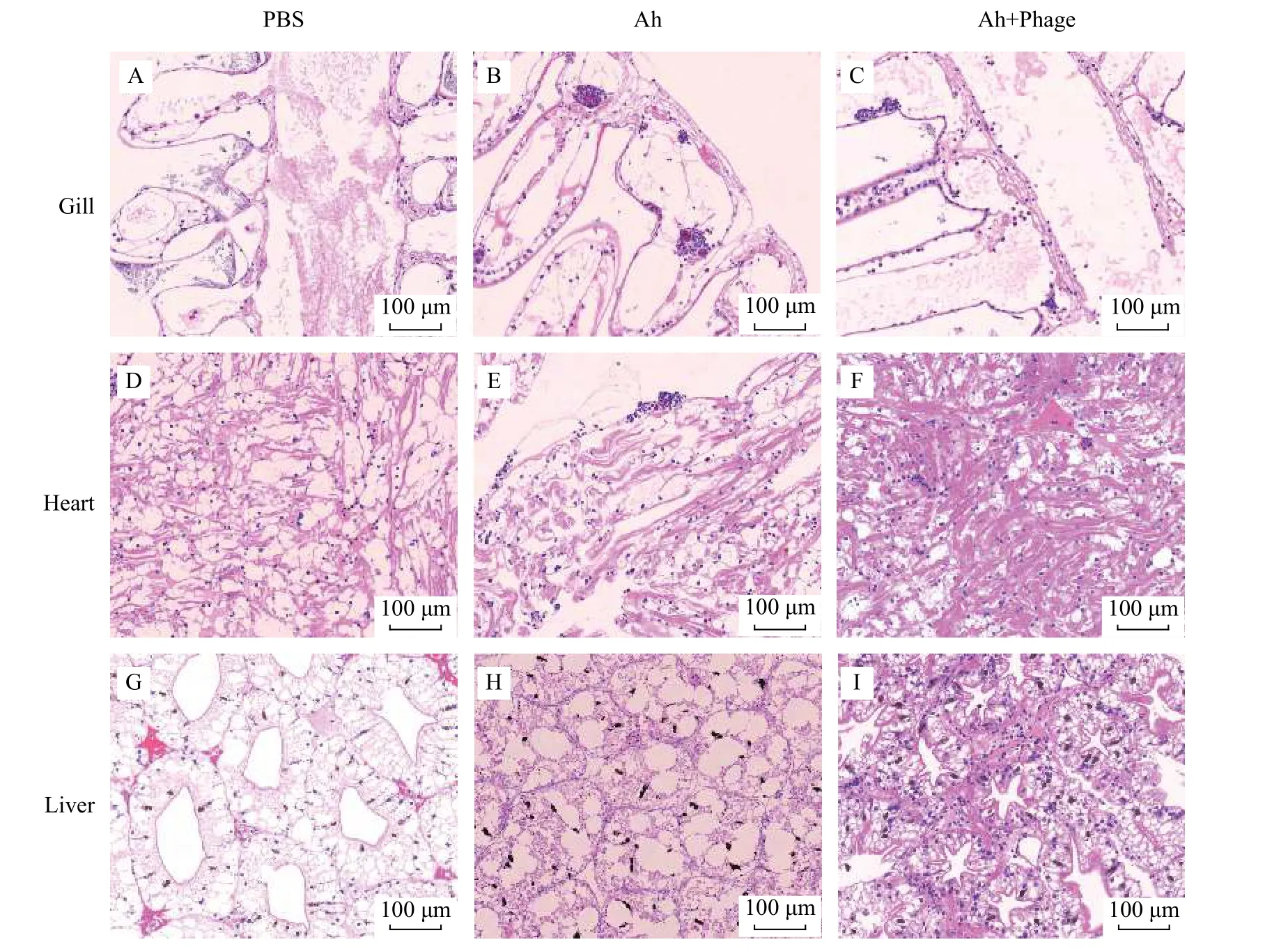
图10 组织切片观察结果Fig.10 Observation results of tissue sections
2.14 噬菌体浸泡治疗对人工感染嗜水气单胞菌的克氏原螯虾的病理观察
鳃组织的病理变化: 对照组克氏原螯虾的鳃丝结构正常(图12A); 细菌浸泡组克氏原螯虾的鳃丝部分肿大, 鳃丝内有大量细胞脱落死亡, 角质膜增厚, 无明显的血淋巴细胞浸润(图12B); 在治疗组Ah+Phage中, 死亡脱落的细胞减少, 鳃丝整体结构保持完整, 只有少数角质膜增厚(图12C)。
心脏组织的病理变化: 对照组克氏原螯虾的心脏结构完整(图12D); 注射细菌组克氏原螯虾的心脏肌丝肿胀明显, 心肌纤维弯曲肿大, 断裂现象明显, 横纹肌模糊(图12E); 在治疗组Ah+Phage中, 克氏原螯虾心脏中细胞的体积偏大, 心肌纤维肿大现象明显, 仍然有部分细胞聚集(图12F)。
肝胰腺组织的病理变化: 对照组正常克氏原螯虾的肝胰腺组织结构完整(图12G); 细菌浸泡组克氏原螯虾的肝胰腺中肝小管收缩, 肝小管之间的结缔组织被破坏, 部分细胞体积增大, 有空泡化现象但无注射组明显(图12H); 在治疗组Ah+Phage中肝小管之间的结缔组织恢复正常, 细胞形态正常, 基本无死亡脱落现象, 整体结构完整(图12I)。
3 讨论
对噬菌体进行生物学特性的鉴定, 有助于了解所分离噬菌体的特点, 进而筛选出有应用价值的噬菌体。本研究以本课题组之前从患病克氏原螯虾分离到的致病性嗜水气单胞菌为宿主菌, 从水体中分离到一株烈性噬菌体, 并命名为Ph-0, 经过多次纯化富集之后, 经双层平板培养可见形态为圆形,有明显晕环的噬菌斑, 这与已报到的噬菌体相似[30]。温度、pH和有机试剂等一些化学和物理因素对噬菌体的活性具有重要影响, 通过不同梯度的温度水浴处理噬菌体Ph-0之后, 噬菌体的滴度从低温到高温有一个明显的变化, 当温度低于40℃时, 噬菌体Ph-0的滴度无明显波动, 当温度大于50℃时, 噬菌体Ph-0的滴度开始下降, 当温度大于70℃时, 噬菌体无法形成明显的噬菌斑。与王志丽等[19]分离到的噬菌体不同, 其分离到的嗜水气单胞菌噬菌体在50℃时已经失活。与Easwaran等[23]所分离的噬菌体的耐受温度相似, 在60℃时噬菌体的滴度有所下降, 在80℃时已基本无噬菌斑。经过不同梯度pH处理噬菌体后, 结果显示所分离噬菌体Ph-0的滴度无论是在酸性还是在碱性的溶液中(pH3—11), 滴度无明显的下降, 表明所分离噬菌体有耐酸耐碱的特性, 与Chandrarathna等[25]所分离的噬菌体对于温度的耐受度相近, 相比于Easwaran等[23]所分离到的噬菌体(pH5—11)对于碱性环境更耐受。在经过不同时间紫外处理后, 噬菌体的滴度下降迅速且明显,在照射时间达到3min时, 噬菌体已经下降近5log噬菌体数目, 到9min之后, 已经基本无噬菌斑的形成,这与已有研究报道的噬菌体等病毒对紫外线敏感的结论一致。用5%的氯仿处理不同时间的噬菌体,结果显示, 噬菌体Ph-0对氯仿及其敏感, 在处理3min时噬菌体的滴度已经大幅下降, 处理6min后,只能形成个别噬菌斑, 当处理时间进一步加长, 已经无噬菌斑的形成。感染复数作为病毒感染与病毒产量的一个标准, 是一个重要的生物学指标, 在本研究中, 当感染复数为0.1 MOI时, 所增殖的噬菌体滴度最高, 即最佳感染复数为0.1 MOI。当感染复数过高, 即宿主菌较少, 噬菌体比较多, 噬菌体的裂解量偏低的可能原因是噬菌体之间的相互竞争和相互抑制造成[31]。一步生长曲线对于噬菌体的研究和应用具有重要的意义, 通过测定噬菌体一步生长曲线, 可以使噬菌体产量达到最高值的同时,也使得生产周期达到最短, 同时, 相关研究发现, 当培养基的营养成分越丰富, 子代噬菌体的裂解量可能会更大, 且潜伏时间也会相应缩短[32]。经过测定,所分离噬菌体的潜伏期时间适中, 持续时间约为20min, 裂解期持续70min, 在90min之后其生长趋势趋于稳定。之前有研究表明, 潜伏期的长短取决于噬菌体类型、宿主类型和环境条件[23]。本结果与以前报道的IHQ1噬菌体相似[33]。

图11 克氏原螯虾存活率及死亡时间Fig.11 Survival rate and time of death of Procambarus clarkii
本实验分别采用注射和浸泡两种方法探究噬菌体的治疗效果, 结果表明2种方式均有一定的保护效果。采用注射治疗时的最好保护率可以达到66%, 浸泡方法为20%, 当采用注射的方式进行治疗时, 保护率相较于浸泡方式更高, 可能原因是采用注射法时噬菌体可直接进入机体, 作用细菌, 而采用浸泡法时, 进入机体的噬菌体数量相对较少, 治疗效果较差。组织切片结果显示, 对照组中各组织损伤现象明显, 与已有研究相似[34], 相比于对照组,治疗组克氏原螯虾的鳃中血淋巴细胞浸润减少, 细胞形态恢复正常, 细胞间界限明显, 鳃丝整体保持完整; 治疗组克氏原螯虾肝胰腺中肝小管形态正常, 管与管之间的结缔组织大部分保持正常, 细胞分布均匀且大小无异常变化。相比于攻毒组, 治疗组克氏原螯虾的心脏治疗效果不明显, 仍存在心肌纤维肿大, 细胞形态异常且聚集的现象。
噬菌体专一性强的特点是噬菌体治疗的优势,同时也是其不足之处, 由于大多数的噬菌体裂解谱范围很窄[35], 在治疗过程中很难找到合适的噬菌体,此外噬菌体的制备条件要求很高, 在噬菌体的增殖过程中, 需要利用其宿主菌来增殖相应的噬菌体,宿主菌的营养物质较高, 宿主菌才能增殖, 而且噬菌体裂解宿主菌后的裂解液里含有大量的细菌碎片及细菌的一些内毒素等, 在实际的应用中效果都会有影响[36]。以上问题也是导致噬菌体难以应用的原因。因此要筛选出宽裂解谱的噬菌体或制备噬菌体鸡尾酒, 实际应用中制备成储存周期长且稳定的噬菌体制剂, 以拌料和泼洒相结合的方式进行使用[22], 从而达到治疗细菌病的目的。
综上所述, 本研究以嗜水气单胞菌为宿主菌分离到一株烈性噬菌体, 对其生物学特性进行了分析,并分别采用注射和浸泡2种感染和治疗方式探究噬菌体的治疗效果, 可以为克氏原螯虾细菌性疾病的防治和治疗提供依据。
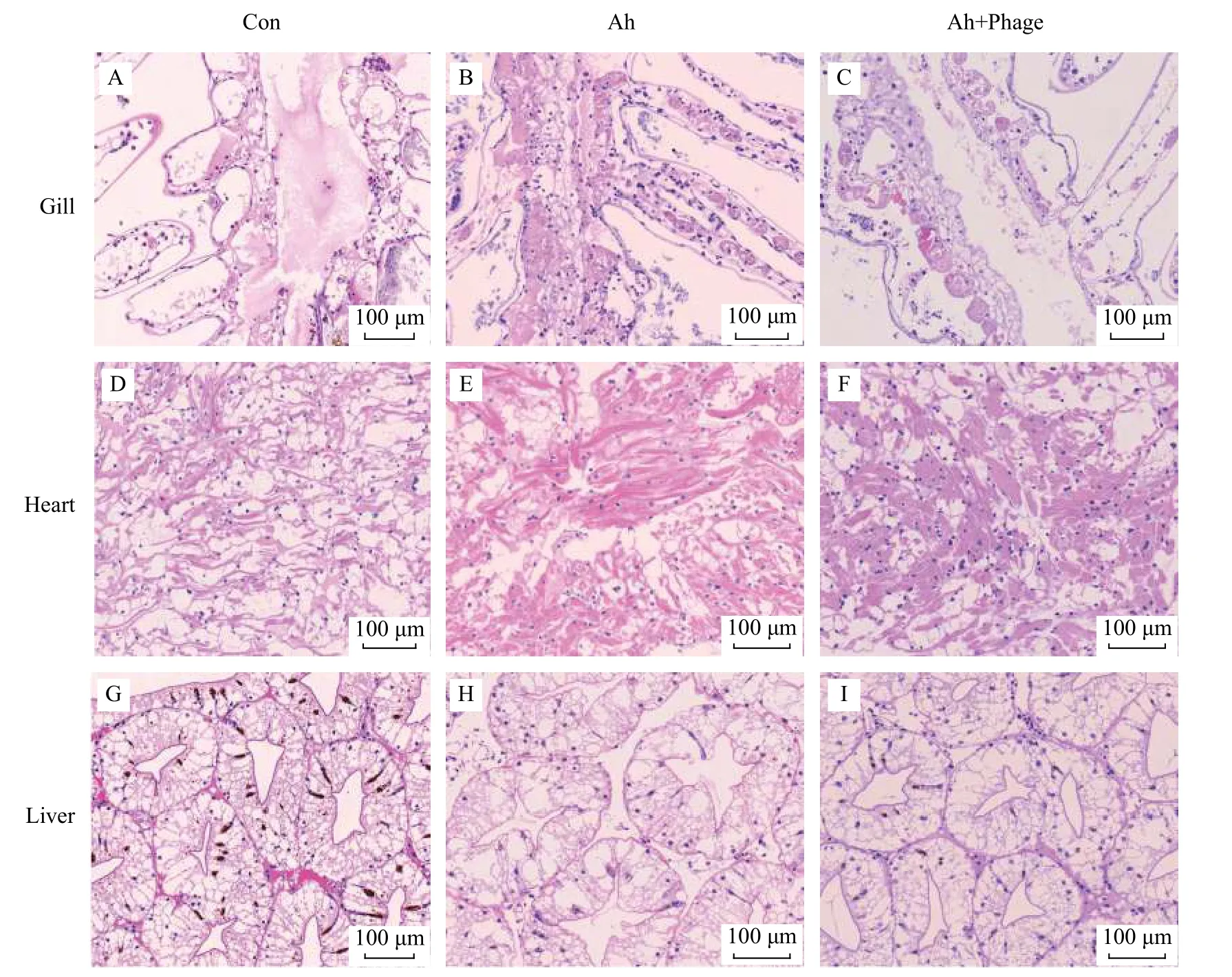
图12 组织切片观察结果Fig.12 Observation results of tissue sections

