降尿酸肽对高尿酸血症的作用及研究进展
骆贤亮,刘 滔,钱忠英,冯凤琴
(浙江大学生物系统工程与食品科学学院,农业农村部农产品采后处理重点实验室,浙江省农产品加工技术研究重点实验室,浙江 杭州 310058)
高尿酸血症是嘌呤代谢混乱或尿酸排泄减少所致的一种代谢疾病,已成为继高血压、高血糖、高血脂之后的第四大健康风险因素[1]。现今,多数上班族长期摄入富含嘌呤的食物(如肉类、海鲜、内脏、啤酒等[2-3]),且存在久坐不运动的习惯,这些情况会导致尿酸排泄减少,尿酸水平不断升高,从而引发高尿酸血症及并发的痛风、高血压、肾病、心血管疾病等多种代谢综合征疾病[4-5]。经调查研究发现,全球范围内高尿酸血症的发病率和患病率呈逐年上升趋势并趋于年轻化,2015—2016年,中国高尿酸血症的总患病率为15.85%,男性和女性患病率分别为24.35%和6.15%;美国总患病率为20.1%,其中男性和女性患病率分别为20.2%和22.0%[6-8],高尿酸血症已逐渐成为威胁人类健康的主要疾病,因此,对该疾病的防治与研究日益重要。
目前临床上用于治疗高尿酸血症的降尿酸药可分为两类:黄嘌呤氧化酶(enzyme xanthine oxidase,XOD)抑制剂(例如别嘌呤醇和非布司他)和排尿酸药物(例如丙磺舒和苯溴马隆)。其中别嘌呤醇是世界公认的降尿酸标准药物,具有一定的治疗效果,但别嘌呤醇会引起胃肠道不适、皮疹和肾毒性等不良反应[9-10],同时还会引起别嘌呤醇超敏综合征过敏反应,可能危及生命,极大限制了其临床应用。因此,寻找更有效和安全的替代疗法来降低血清尿酸盐水平对控制高尿酸血症具有重要意义[11]。
食源性生物活性肽是指食物蛋白质来源的氨基酸序列片段,通常包含2~20 个氨基酸[12]。研究表明,生物活性肽在降血压[13]、降尿酸[14]、抗炎[15]、抗菌[16]、降低胆固醇[14]等疾病防治中具有显著的功效。与易引起诸多不良反应的化学合成药物相比,生物活性肽具有高生物活性、低毒性和易于消化吸收等优点,因此生物活性肽的研究也受到越来越多的关注[12,17-18]。在中国知网、Web of Science、ScienceDirect和PubMed 4 个数据库中输入关键词“降尿酸肽”“XOD抑制肽”“uric acid-loweringpeptide”“anti-hyperuricemic peptide”“xanthine oxidase inhibitor peptide”等进行检索,发现降尿酸肽的研究从2017年开始逐年增多,且自2017年后最相关研究达20余篇。研究证明,降尿酸肽能很好地与XOD结合并抑制其活性,下调高尿酸血症小鼠的血尿酸水平,具有不可估量的应用前景。本文首先简要阐述了高尿酸血症的发病机理及其研究模型的构建,随后简述了食物来源降尿酸肽的制备及体外活性,并讨论降尿酸肽可能的分子机制,最后概述目前降尿酸肽研究存在的问题及未来的研究方向,为降尿酸肽的研究、开发及其在高尿酸血症临床应用提供参考。
1 高尿酸血症发病机理与防治
1.1 尿酸的合成与排泄
尿酸是一种有机弱酸,为嘌呤代谢的终产物。如图1[19]所示,嘌呤腺苷酸经一系列酶的催化,依次经过次黄苷、次黄嘌呤和黄嘌呤等中间产物,最终氧化得到尿酸。人体内有80%的尿酸是由内源性嘌呤代谢产生,20%则来自食物中的核苷酸[20]。肾脏是尿酸排泄的主要器官,约有2/3~3/4的尿酸由肾脏排泄。由于尿酸是带负电荷的极性分子,不能穿过细胞膜[21],目前研究认为肾脏中相关尿酸盐转运蛋白,如有机阴离子转运蛋白家族成员(organic anion transporter,OAT)、尿酸盐阴离子转运蛋白1(urate anion transporter 1,URAT1)、葡萄糖转运蛋白9(glucose transporter 9,GLUT9)等,参与了尿酸的跨膜转运、重吸收和再分泌,在维持体内尿酸稳态中起到关键作用[21];因此,尿酸盐转运蛋白也是促尿酸排泄药物的主要作用靶点[22-23]。

图 1 尿酸代谢机理图[19]Fig. 1 Mechanism of uric acid metabolism[19]
1.2 尿酸代谢混乱与高尿酸血症的形成
高尿酸血症主要是由于尿酸产生(如富含嘌呤的食物)与排泄(如肾功能降低)之间的不平衡造成的[21]。也就是说,嘌呤代谢异常或尿酸排泄时,体内尿酸、尿酸前体(次黄嘌呤和黄嘌呤)水平增加引起的血尿酸水平升高会导致高尿酸血症,临床的诊断标准为:在正常嘌呤饮食状态下,非同日两次空腹的血尿酸水平,男性高于420 μmol/L(0.7 mg/L)或女性高于357 μmol/L(0.6 mg/L)[24-26]。长期的高尿酸血症会使尿酸盐结晶沉积于关节腔及软组织,促使血小板凝集,诱发高血压、高血脂、痛风及胰岛素抵抗等一系列代谢综合征疾病[27-28]。
1.3 高尿酸血症疾病的防治
控制高尿酸血症的形成主要通过控制饮食、调节生活方式以及药物辅助治疗。在饮食方面,由于食物中的嘌呤类型及含量都存在差异,所以对尿酸的影响也不同[29]。根据日本高尿酸血症和痛风营养疗法治疗指南的建议,每天饮食中嘌呤应少于400 mg[30]。因此,患有痛风的人应避免食用内脏、甜面包、高果糖玉米糖浆、甜味饮料和酒精,尤其在痛风发作频繁时应完全避免饮酒,同时应限制肉类及肉类产品、海鲜、食用糖、甜味饮料和食用盐的摄入量,鼓励食用低脂或脱脂的乳制品和蔬菜[31]。此外,食物嘌呤含量还会随着食品加工、烹饪和贮存而变化[3]。Ren Zhongyu等[32]研究发现,生鱼片和烤鱼的摄入与血尿酸水平成正相关,而水煮鱼和炸鱼则没有显著差异,因此高尿酸血症患者也应注意日常饮食的烹饪方式。通过饮食干预高尿酸血症是长期的过程,需要患者管理与控制自身饮食习惯。另外,由于饮食习惯只能在长期干预下起作用,因此当尿酸代谢混乱且危害到身体其他器官时,需要外源药物介导治疗。目前用于临床治疗的降尿酸药物主要是尿酸生成抑制剂和促尿酸排泄制剂,包括西药和中药,但实际只有少数几种药物起到治疗效果,且同时还伴随许多副作用和不良反应[33]。因此,开发食源性、绿色安全高效的降尿酸功能食品辅助治疗高尿酸血症是未来研究的新方向。
2 高尿酸血症研究模型的构建
高尿酸血症动物模型的造模方法主要有以下4 种:增加尿酸前体物质如黄嘌呤、次黄嘌呤[34]等,促进尿酸生成;抑制肾脏排泄尿酸,如乙胺丁醇[35];抑制尿酸酶活性,如氧嗪酸钾[36];诱导机体代谢混乱致高尿酸血症发生,如酵母浸粉[37]、果糖[38]等。本文主要对两种常用的造模方法(氧嗪酸钾和酵母浸粉)进行概述。
2.1 氧嗪酸钾诱导构建高尿酸血症动物模型
氧嗪酸钾即尿酸酶抑制剂,是目前最常用的高尿酸血症建模药物。朱祥祥等[39]对比不同造模因素,发现连续造模7 d后,250 mg/kgmb氧嗪酸钾、300 mg/kgmb次黄嘌呤+250 mg/kgmb氧嗪酸钾均可使小鼠血清尿酸水平显著升高,成功诱导高尿酸血症模型,且后者效果更佳。XOD抑制剂别嘌呤醇是治疗高尿酸血症的临床药物,通常选择其作为阳性对照组。构建模型时一般可通过灌胃或注射氧嗪酸钾形成急性和非急性两种高尿酸血症模型,具体的模型构建需根据样本特点及实验需求进行。
2.1.1 氧嗪酸钾非急性模型的构建
如图2A所示,非急性模型是先给受试动物灌胃或饲料给予氧嗪酸钾,当血尿酸浓度达到110 μmol/L时,视为造模成功。造模成功后开始正式灌胃实验样品,实验周期一般为7~30 d不等,具体给药时间根据药物的不同做相应调整。实验期间连续给予造模剂可使动物血清中尿酸持续保持在高于正常的水平,可能会诱导慢性肾病的发生[40]。Yang Fei等[41]给模型组每日灌胃氧嗪酸钾溶液600 mg/kgmb,对照组给予相同体积的羧甲基纤维素钠溶液。实验观察时间点设置为7、14、21 d和28 d,每个时间点从大鼠眼眶后静脉收集血液样品,发现第7天模型组的尿酸水平较对照组明显增加,虽然随时间的延长模型鼠尿酸水平有所降低,但仍高于对照组。Long Hongyan等[42]探究甘草素在预防高尿酸血症及其对肾脏的保护作用时,首先灌胃大鼠氧嗪酸钾溶液250 mg/kgmb,并于1 h后灌胃实验样品(甘草素和别嘌呤醇),实验维持7 d。该模型简单方便,但每日灌胃两次对实验大鼠造成的机械伤害较大。同样,Wang Huijuan等[43]为研究中药泻浊方对高尿酸血症性肾病的治疗机制,采用了与文献[42]基本相同的造模方法,但实验周期延长至3 周。Lu Xiaohui等[4]研究了羟基积雪草苷对痛风性关节炎和高尿酸血症的治疗作用,实验以ICR小鼠作为实验对象,每天灌胃一次300 mg/kgmb尿酸酶抑制剂氧嗪酸钾,连续7 d造模后每天一次给予小鼠受试样品及阳性对照别嘌呤醇溶液(持续2 周),实验模型组的血清尿酸水平明显高于对照组,且出现肾小管萎缩、间质性炎症和肾小管上皮细胞积液等肾脏损伤现象。对于非急性模型,需要注意的一点是,如果每日间隔12 h持续给予造模剂,可能会引起动物血尿酸不断升高[44],促使肾衰竭,造成动物死亡。因此,正式实验前建议先做造模剂剂量及给药时间筛选的预实验。
2.1.2 氧嗪酸钾急性模型的构建
如图2B所示,急性模型是先对模型鼠进行受试样品干预,周期一般为7~30 d,干预后在腹腔注射或灌胃造模剂诱导急性高尿酸血症。一次性给药后大鼠血尿酸在造模后12 h内基本高于正常水平,Chau等[45]在研究岩藻低聚糖时,先灌胃实验样品干预SD大鼠21 d,再于第21天干预后1 h,通过灌胃剂量为300 mg/kgmb的氧嗪酸钾和次黄嘌呤诱导急性高尿酸血症模型,对照组灌胃羧甲基纤维素钠溶液,并于24 h内收集尿液样本。第22天进行与第21天同样的处理后,收集尿液样本,处死小鼠收集血清及组织,测定尿酸浓度、血尿素氮和肌酐含量。该造模方式下,体内高尿酸水平在6 h达到最高峰,并且4 h时的尿酸水平与0 h相比有极显著差异,因此研究者选用4 h作为诱导期。Wan Yin等[46]以咖啡酸为样品,实验分为模型组、正常对照组(生理盐水)、别嘌呤醇组(5 mg/kgmb)以及低、中、高剂量咖啡酸组(含量分别为20、50 mg/kgmb和100 mg/kgmb),连续灌胃实验样品7 d后,在灌胃给药1 h后进行腹膜内注射氧嗪酸钾以诱导高尿酸血症,并于建模1 h后进行最后一次给药,处死实验鼠。该建模方法发现模型组的尿酸水平高达354.66 μmol/L,较正常对照组(150.50 μmol/L)显著增加。
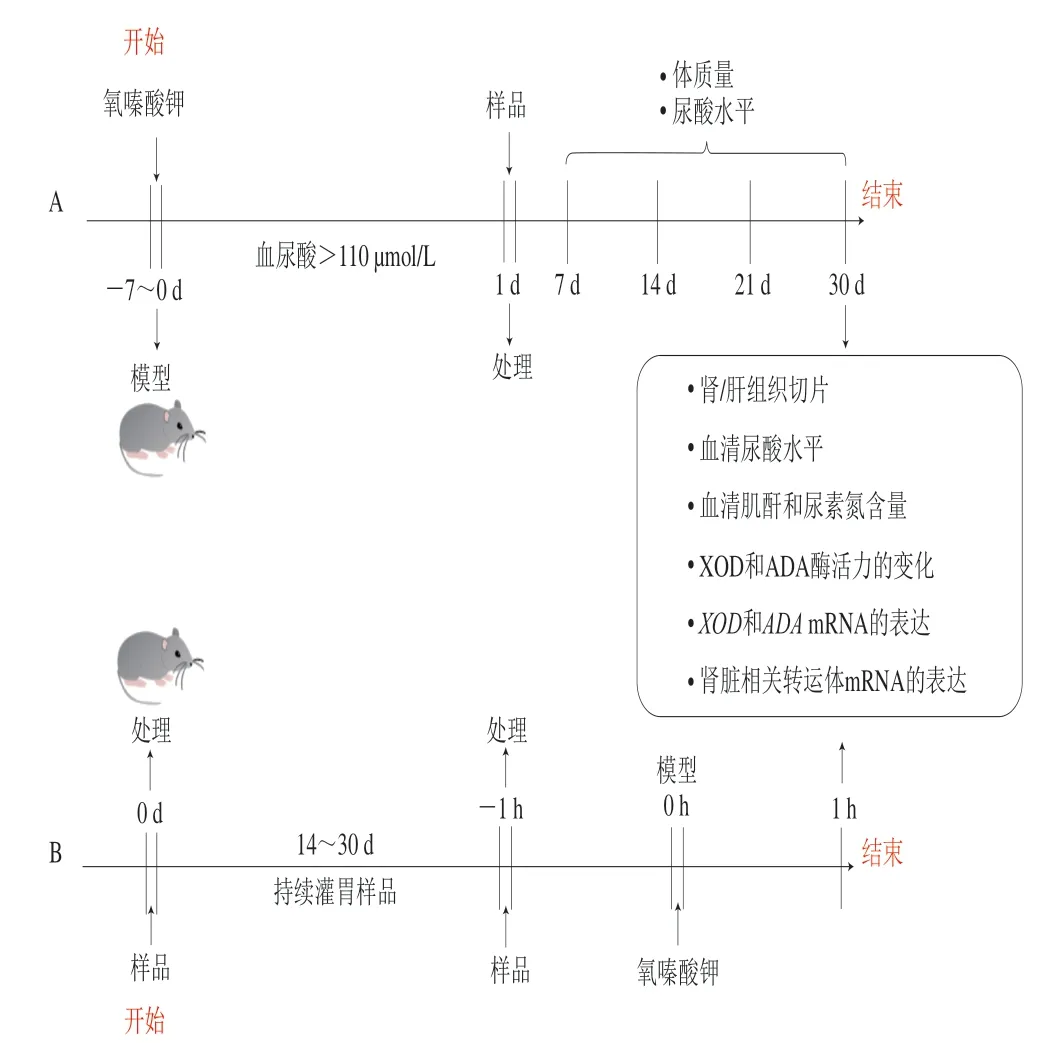
图 2 氧嗪酸钾诱导高尿酸血症动物模型构建Fig. 2 Construction of animal models of hyperuricemia induced by potassium oxonate
2.2 酵母浸粉诱导构建高尿酸血症动物模型
酵母浸粉中含有丰富的蛋白质、核苷酸和B族维生素,在体内能水解产生嘌呤碱类、嘧啶碱类和磷酸,大量摄入酵母浸粉会干扰机体正常的嘌呤代谢,表现为XOD活性和尿酸含量升高,研究表明酵母浸膏和酵母浸粉均能很好地构建高尿酸血症模型[37,47]。张灏[48]以饲料喂食的方式,给予对照组动物喂食标准饲料,其余各模型组均喂食含有质量分数20%酵母浸粉的高尿酸血症标准饲料,实验组在模型组饲料的基础上,分别添加质量分数0.1%的海参皂苷、0.3%的海参多糖以及0.02%的海参脑苷脂。持续喂食14 d,发现在第9天时,模型组小鼠体内血尿酸水平显著高于对照组。同样,Zhang Yuan等[49]也在其模型组的饲料中加入酵母作为高嘌呤饮食,但其样品的摄入方式是灌胃。Pan Libin等[50]通过给予大鼠含质量分数10%酵母粉和0.15%腺嘌呤的饮食6 周,发现模型组血浆尿酸、肌酐和血尿素氮的水平显著增加,且模型组左肾指数(脏器质量与体质量比)高于对照组,说明酵母饮食能有效建立高尿酸血症诱导的肾脏疾病模型。酵母浸粉作为造模饲料,具有安全和机械伤害小等优点,但造模耗时较长,模型不稳定,有一定的局限性。此外,还有研究表明,除了酵母浸粉,长期摄入高果糖也会提高体内血尿酸水平,使肾尿酸排泄值降低,在时间允许的情况下,也可以利用果糖构建高尿酸血症动物模型[38,51-52]。

表 1 降尿酸肽的制备方法及其活性功能Table 1 Preparation and activity of uric acid-lowering peptide
3 降尿酸肽的制备与结构、活性功能及作用机制
3.1 降尿酸肽的制备与结构
化学合成药物具有内在的毒副作用,能够引起肾脏或肝脏功能受损、肌肉萎缩和中枢神经系统功能障碍。降尿酸肽作为有效安全的替代物,近些年对其研发逐渐增多。研究发现,底物和制备方法不同会影响生物活性肽的含量和特性。目前,常用酶解法从蛋白质中获得生物活性肽,因为酶法在水解、释放和获得目标肽段方面更具可控性[53]。近几年,关于食源性降尿酸肽的制备方法及其活性功能的相关研究见表1。大量研究发现,降尿酸肽的活性与其分子质量有很大的关系。盛周煌[56]利用5 000 Da和3 000 Da的超滤膜对罗非鱼皮胶原蛋白酶解液进行分离,截留了分子质量高于5 000 Da、3 000~5 000 Da和低于3 000 Da的3 种组分,发现低于3 000 Da组分的XOD抑制率最佳。同样,邹琳[57]发现鲣鱼酶解原液XOD的半最大抑制浓度(half maximal inhibitory concentration,IC50)为14.88 mg/mL,其中高于3 000 Da的组分仅占0.17%,超过95%的组分分子质量低于1 000 Da,进一步膜分离纯化后,分子质量在600~1 000 Da的组分XOD抑制活性最高(IC50为9.18 mg/mL)。不同来源降尿酸肽的氨基酸序列不同,XOD抑制率也存在差异(表1)。Nongonierma等[61]发现含有Trp的二肽具有XOD抑制活性,其中Val-Trp和Trp-Val的抑制率分别为37.2%和36.7%,单独分析Val和Trp的抑制率时,发现Val的XOD抑制率只有5.3%,而Trp则高达70.3%。这提示在制备降尿酸肽时,应结合肽的空间结构、分子质量、氨基酸组成等进行综合分析,将有助于找到抑制XOD活性最佳的肽段。
3.2 降尿酸肽与XOD的分子对接及构效关系
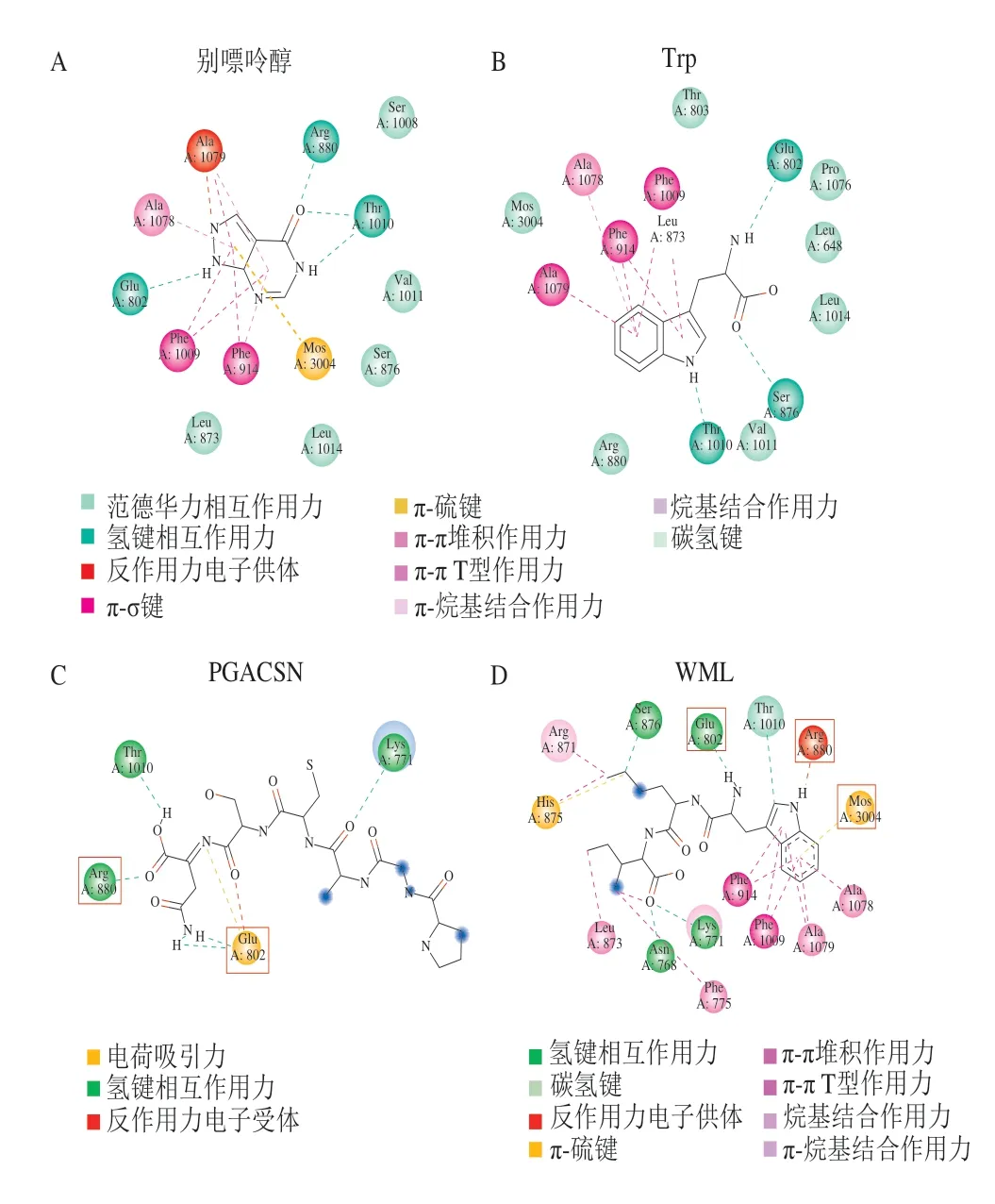
图 3 XOD与抑制剂别嘌呤醇(A)、色氨酸(B)、PGACSN(C)、WML(D)分子对接二维可视化图[57,61,64]Fig. 3 Two-dimensional visualization of molecular docking of xanthine oxidase with inhibitors allopurinol (A), tryptophan (B),PGACSN (C) and WML (D)[57,61,64]
XOD也称黄嘌呤氧化还原酶,是一种限速酶,广泛存在于肝、肠、血清和乳腺中,可催化尿酸的产生并同时产生活性氧[62],因此,抑制XOD的活性对于高尿酸血症和氧化应激相关疾病的治疗至关重要。经大量研究表明,降尿酸肽通过与XOD特异性结合抑制其活性,从而抑制尿酸的合成。He Weiwei等[14]通过碱性蛋白酶水解金枪鱼肉获得混合肽TPH,TPH中包含12 个二肽和三肽,能有效抑制XOD。其中含苯丙氨酸(Phe)的肽比含色氨酸(Trp)的肽能更有效地抑制XOD活性,苯丙氨酸-组氨酸(Phe-His)具有最强的XOD抑制活性(IC50=25.7 mmol)。分子对接研究揭示了XOD中两个氢键及其与Phe-914的一个π-π堆积相互作用是活性肽起到抑制作用的关键点。此外,Li Qingyong等[63]研究发现含有Trp的核桃蛋白肽能够有效抑制XOD活性,且抑制活性随着Trp的数量增加而增强。与别嘌呤醇相似[61],Trp能与XOD中心钼蝶呤周围的关键残基谷氨酸(Glu)-802、亮氨酸(Leu)-873、丝氨酸(Ser)-876、精氨酸(Arg)-880、Phe-914、Phe-1009、苏氨酸(Thr)-1010、缬氨酸(Val)-1011、Leu-1014、丙氨酸(Ala)-1078、Ala-1079等有效结合和作用(图3A、B)。因此,含Trp的肽具有较高的XOD抑制活性和抗氧化能力,此结果与He Weiwei等[14]的研究结果一样。Li Yujuan等[64]分别评估鱼水解物、脱酚核桃水解物和大豆水解物的降尿酸功效,发现鱼水解物中有两种肽与XOD有结合位点,其中疏水肽WML较亲水肽PGACSN更容易进入XOD的活性位点,且使XOD的二级结构发生显著变化,这可能是疏水相互作用所致(图3C、D)。Itsuki等[60]通过消化酶从鲨鱼软骨中提取有效成分,利用无载体两性电解质等电聚焦和反相液相色谱分离出活性肽。在最终纯化的碱性蛋白酶消化物中共鉴定出18 种肽,结果发现酪氨酸(Tyr)-Leu-Asp-天冬氨酸(Asn)-Tyr和Ser-脯氨酸(Pro)-Pro-Tyr-Trp-Pro-Tyr肽段降低了血清尿酸水平,与前文提及的肽相似,可能通过疏水基团起到重要作用。Nongonierma等[61]测定的12 种二肽中,含Trp的Val-Trp肽及其反向肽Trp-Val均表现出XOD抑制活性,主要是Trp残基起作用。Trp、Val-Trp和Trp-Val 3 种肽的XOD抑制活力IC50没有显著差异,但比别嘌呤醇高约200 倍。Trp、Val-Trp和Trp-Val属于非竞争性抑制剂,而别嘌醇是竞争性抑制剂。Li Qingyong等[65]采用Sephadex G-15凝胶过滤和反相高效液相色谱法从脱酚胡桃粕水解产物中分离纯化出两种新的降尿酸肽,分别为WPPKN(640.8 Da)和ADIYTE(710.7 Da)。WPPKN和ADIYTE均表现出较高的体外XOD抑制活性,IC50分别为(17.75±0.12)mg/mL和(19.01±0.23)mg/mL。根据分子模拟的结果,WPPKN进入疏水通道,甚至阻碍了黄嘌呤和XOD之间的相互作用,而ADIYTE在B链的表面阻止底物进入疏水通道。从前文来看,生物活性肽起XOD抑制作用的原因可能是通过π-π堆积作用、疏水作用及与XOD周围残基有效结合,抑制XOD与底物黄嘌呤和次黄嘌呤结合,特别地,含有Trp氨基酸残基的活性肽抑制能力较强。同时也说明降尿酸肽的XOD抑制活性受氨基酸种类、数目及基团位置的影响[66]。因此,研究活性肽的XOD抑制活性构效关系对开发降尿酸活性肽有着不可忽视的作用。
3.3 降尿酸肽体内活性评价及作用机制
尿酸是嘌呤代谢的最终产物,体内XOD活性升高通常与尿酸水平呈正相关。研究表明,尿酸还可以与体内O2-、H2O2和OH-反应,从而引起氧化应激和肾功能受损[67]。现有的降尿酸药物会引起诸多不良反应,因此,开发新型安全高效的替代品具有积极意义。大量研究表明,活性肽具有较好的体外抑制XOD活性,近年来食源性活性肽降尿酸作用及其体内作用机制的研究也越来越受关注。Itsuki等[59]采用体积分数75%的乙醇溶液萃取分离鲨鱼软骨蛋白水解消化液中的活性肽,灌胃活性肽28 d后,发现鲨鱼软骨活性肽能显著降低高尿酸血症大鼠的血尿酸水平,且具有剂量依赖性。活性肽显著降低了血清中XOD的活性,尽管该活性肽在体外未表现出XOD抑制活性。说明活性肽进入体内后,在消化、吸收和代谢的过程中可能被转化为具有XOD抑制活性的小肽。Liu Yang等[68]通过动物实验及体外XOD抑制实验研究金枪鱼蛋白水解物(tuna protein hydrolysate,TPH)及其美拉德反应产物(TPH-M)和胃肠道消化产物(TPH-D)3 种样品的抗高尿酸血症活性。在体外XOD抑制活性实验中,TPH和TPH-D的抗高尿酸活没有显著差异,表明经胃肠道消化后TPH的XOD抑制活性不会降低。此外,TPH、TPH-M和TPH-D均可以在体内有效抑制XOD活性并下调XODmRNA的表达,这表明抗高尿酸血症作用的机制与XOD活性及XODmRNA的表达有关。Liu Naixin等[58]从大米提取物中鉴定出一种新型肽RDP1(AAAAGAKAR、785.91 Da),研究证明RDP1(最低有效含量为10 μg/kgmb)能显著降低大鼠血尿酸和肌酐,减轻高尿酸血症性肾病,其通过占据XOD与黄嘌呤的结合位点来抑制尿酸的形成。更有研究发现,鲣鱼肽能显著降低模型鼠的血清尿酸水平((95.4±27.4)μmol/L),甚至低于别嘌呤醇组((114.3±53.0)μmol/L),而大豆肽则没有表现出抗高尿酸血症活性[64]。
最近研究发现,金枪鱼寡肽(TMOP)能够减轻高尿酸血症和肾脏炎症,改变尿酸代谢途径,抑制NLRP3炎性小体的活性和Toll样受体4(Toll-like receptor 4,TLR4)/髓样分化因子88(myeloid differentiation factor 88,MyD88)/核因子κB(nuclear factor κB,NF-κB)信号通路的表达,并抑制p65-NF-κB的磷酸化。此外,研究还发现经TMOP处理的小鼠粪菌也具有抗高尿酸的作用[69]。与Han Jiaojiao 等[69]的研究结果相似,Wan Haitao等[70]从两种不同品种的海参中提取寡肽。结果表明,两种寡肽均能下调促炎因子和上调抗炎因子的表达,抑制TLR4/MyD88/NF-κB信号通路,促使尿酸盐吸收和分泌的转运蛋白转录恢复正常水平,同时还增加了乳杆菌等有益菌的丰度。综上,目前对降尿酸肽的作用机制已有初步研究,但主要集中于其对XOD活性的抑制及对相关表型的影响,在体内的确切作用机制尚未可知,将来可以通过肠道菌群、尿酸转运蛋白及相关信号通路等途径做进一步的探究,为明确降尿酸肽的体内作用机制提供充足的科学依据。
3.4 降尿酸肽研究遇到的问题及展望
现有研究表明部分降尿酸肽虽然没有显著性的体外XOD抑制活性,但在动物实验中却能明显降低高尿酸血症动物的尿酸[54],因此,目前对降尿酸肽经体内消化酶消化吸收后发挥作用的结构和形式尚不明确。
针对上述问题,今后研究需重点关注以下3 个方面:1)提高对降尿酸肽的综合性研究。在体外研究降尿酸肽的结构与功能的同时,探索其经胃肠道消化后,活性肽的存在形式及其在体内的作用机理。2)利用包埋、微胶囊等技术,制造传递降尿酸肽的递送系统,避免活性肽被水解,提高其生物利用率。如Zhang Xiaopei等[71]利用非共价键相互作用,使单体和交联剂在蛋白质分子周围聚集形成网络薄壳,形成尿酸氧化酶纳米胶囊。该技术不仅可确保有效的酶促反应,把尿酸盐分子有效转运至胶囊核心与尿酸氧化酶充分反应,还能延长纳米胶囊在体内的循环时间,从而为高尿酸血症和慢性痛风提供有效的治疗方法。3)活性肽对高尿酸血症模型鼠尿酸转运蛋白的影响。丁坤等[72]发现祛湿涤浊汤能显著下调URAT1和GLUT9的表达,上调OAT1、ABCG2和八聚体结合转录因子1水平,降低高尿酸血症大鼠的血尿酸水平,说明祛湿涤浊汤可能是通过抑制XOD的活性及调节相关转运蛋白的表达来发挥抗高尿酸血症作用。但目前尚不明确降尿酸肽是否影响尿酸盐转运蛋白的表达和功能,可结合前人研究结果从该方面展开深入研究。
4 结 语
高尿酸血症不仅能引起肾脏受损,同时还可能诱发心脏病、糖尿病、高血脂等疾病,严重影响人类健康。目前临床治疗的药物对人体有明显的副作用,因此开发绿色、安全、有效的替代物显得尤为重要。活性肽属于食源性活性物质,大量研究证实其具有易吸收、安全和高生物活性等特性。近年来,国内外许多研究显示,降尿酸肽可能通过π-π堆积作用、疏水作用及与XOD周围残基有效结合起到XOD抑制作用,且含Trp氨基酸残基的活性肽抑制能力较强。此外,降尿酸肽还能显著降低高尿酸血症模型鼠的血清肌酐和尿素氮水平,抑制XOD活性以及保护肾脏,表明降尿酸肽在高尿酸血症中具有良好的应用前景。但目前对降尿酸肽的研究主要集中在制备、结构分析、体外XOD抑制活性(包括分子对接)及简单的体内降尿酸方面,虽有一些个别的人体试食效果研究,但缺乏充足的临床应用数据,对机体确切的作用机制也不清楚,需进一步深入研究并开展临床应用实验,从而为降尿酸肽的应用提供扎实有力的科学依据。

