扩散峰度成像与DWI 在卵巢实性病灶良恶性鉴别诊断中的应用
郭娟娟
(中国人民解放军联勤保障部队第九八八医院影像医学科,河南 郑州 450000)
卵巢良恶性病变种类繁多,2014 年WHO 女性生殖器官肿瘤分类指出卵巢病变主要来源于上皮性肿瘤、生殖细胞肿瘤、转移瘤及性索间质肿瘤,其中卵巢癌发病率居妇科恶性肿瘤第3 位[1]。由于卵巢位置较特殊、病症隐匿,初次确诊时66.7%以上患者处于中晚期,术后5 年生存率仅43%,因此卵巢疾病良恶性的早期诊断是提高患者生存率的关键[2]。超声对卵巢恶性肿瘤的诊断敏感度、特异度相对较低。MRI 可清晰显示卵巢病变特征,有多方位成像、分辨力高等优势,其中DWI 可通过ADC 值对水分子受限情况进行定量分析,有助于肿瘤良恶性病变的诊断[3]。扩散峰度成像(diffusion kurtosis imaging,DKI)可描述非高斯分布,其参数,如平均扩散峰度(mean kurtosis,MK)和平均扩散率(mean diffusivity,MD),也有助于良恶性病变的鉴别诊断[4]。但目前国内有关DKI 与DWI 在卵巢良恶性病变鉴别诊断中的应用价值研究尚处于初步探索阶段,为此本文进行临床对照研究,报道如下。
1 资料与方法
1.1 一般资料 收集2018 年1 月至2019 年6 月我院收治的87 例卵巢良恶性病变患者,年龄35~65 岁,平均(51.02±3.19)岁。临床主要表现为下腹部包块82 例、腹胀腹痛73 例、月经紊乱32 例、腹水症24 例。手术病理证实为良性病变39 例,恶性48 例,共96 个病灶,均为实性病灶。
纳入标准:均经手术病理证实为卵巢实性肿瘤;病理检查前2 周内行DKI 及DWI 检查;检查前未行手术、穿刺活检或放化疗治疗;临床资料完善。排除标准:妊娠期或哺乳期女性;图像运动伪影严重;躁狂症或重度精神疾病患者。
1.2 仪器与方法 采用Siemens Aera 1.5 T MRI扫描仪及腹部联合相空阵线圈。患者取仰卧位,检查前进行呼吸训练,加用腹带控制呼吸伪影,分别行常规MRI 平扫、DWI、DKI 扫描和动态增强扫描,均为轴位扫描。扫描序列及参数:常规平扫T2WI 快速反转恢复序列,TR 5 600 ms,TE 65 ms,TI 170 ms,层厚4 mm,层距4.8 mm,翻转角142°,矩阵340×374;常规平扫T1WI 三维梯度回波序列,TR 8.7 ms,TE 4.76 ms,层厚、层距均为4 mm,翻转角20°,矩阵340×374;EPI-DWI,b 值取0、1 000 s/mm2,TR 4 200 ms,TE 65 ms,层厚4 mm,层距1 mm,翻转角90°,矩阵192×144;EPI-DKI,b 值取0、600、1 200、1 800、2 400 s/mm2,TR 6 200 ms,TE 100 ms,层厚4 mm,层距4.8 mm,翻转角90°,矩阵192×72,激励次数3。增强扫描:采用高压注射器经肘静脉团注Gd-DTPA,剂量0.2 mmol/kg 体质量,流率3 mL/s,后推注10 mL生理盐水冲管;采用三维精准频率反转恢复梯度回波T1WI 序列,TR 4.55 ms,TE 1.55 ms,层厚3 mm,无间隔,翻转角10°,矩阵336×448,每次扫描时间30 s,共扫描9 次。
1.3 图像分析与观察指标 采用Siemens Syngo 工作站及Matlab-DKI 软件分析图像,由2 名具备10 年工作经验的影像学医师对图像进行分析。图像分析参照2013 版BI-RADS-MRI 标准[5],借助DWI 单指数模型生成ADC 图,选中最大层面病灶,在DWI 图像中放置ROI,避免坏死、囊变、出血区及周围正常组织或脂肪组织的干扰,测量ADC 值,测3 次取平均值。将不同b 值DWI 资料导入DKI 软件中,自动生成MK 图、MD 图、伪彩参数图及平均DWI 参数图,以强化图像作参考,选取病灶最大层面,在平均DWI 图中手动放置ROI,避免与ADC 图中ROI 相同,后同步复制至MK、MD 图中并对参数进行记录。
观察指标包括:①卵巢良恶性病变的ADC、MK、MD 值;②ADC、MK、MD 值对卵巢良恶性病变的诊断效能。
1.4 统计学分析 应用SPSS 20.0 软件进行数据分析,计数资料以率(%)表示,组间比较行χ2检验,计量资料以表示,组间比较行独立样本t 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 卵巢良恶性病变的ADC、MK、MD 值比较(表1)与卵巢恶性病变比较,良性病变的ADC、MD 值明显升高,MK 值明显降低(均P<0.05)。
表1 卵巢良恶性病变的ADC、MK、MD 值比较()

表1 卵巢良恶性病变的ADC、MK、MD 值比较()
注:MK,平均扩散峰度;MD,平均扩散率。
2.2 ADC、MK、MD 值对卵巢良恶性病变的诊断效能(表2)MK 值联合MD 值诊断卵巢良恶性病变的AUC 大于单一ADC、MK、MD 值诊断,三者联合诊断卵巢良恶性病变的AUC 大于三者单一诊断及MK 值联合MD 值诊断(图1)。
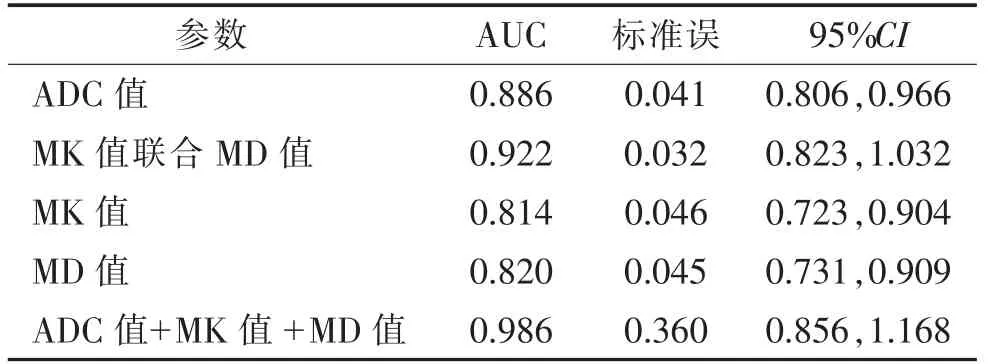
表2 ADC、MK、MD 值对卵巢良恶性病变的诊断效能
3 讨论
卵巢肿瘤是目前危害女性健康的常见肿瘤之一,在妇科恶性肿瘤中死亡率最高,其种类及组织学来源众多,因卵巢位置较深,加之卵巢肿瘤患者出现阳性症状的概率小且缺乏特异性,临床确诊时多已处于中晚期,失去根治性手术切除机会[6-7],因此尽早准确地对卵巢肿瘤良恶性病变进行鉴别诊断是临床关注的焦点。
近年来,随着MRI 技术的不断改进,DWI、DKI已普遍应用于肿瘤良恶性鉴别诊断中。但目前国内关于DWI、DKI 对卵巢良恶性病变诊断价值的研究仍较少。ADC 值是量化符合高斯分布假设的水分子扩散运动的参数,卵巢恶性肿瘤细胞生长旺盛,组织内细胞异型性、细胞核多形性相对更明显,细胞核质比明显增大,间质血管增生更丰富、结构较紊乱,对分子扩散运动影响较明显,因此卵巢恶性病变患者ADC 值相对良性病变更低[8]。DKI 基于体内水分子运动符合非高斯分布的假设,MD 值可有效反映组织水分子的整体扩散水平及扩散阻力[9],MK 值则可间接反映组织结构的复杂性,因此DKI 对肿瘤良恶性病变的鉴别诊断有一定价值[10]。王丽芳 等[11]指出,DKI 在卵巢良恶性病变鉴别诊断中有明确价值,而DKI 联合DWI 等可提高病变诊断的特异度。杨思华等[12]研究证实,MK、MD 及ADC 值均有利于卵巢良恶性病变的鉴别诊断,其中MK 值对乳腺良恶性的诊断效能最大。由于肿瘤恶性病变患者ROI 内组织结构越复杂、非正态分布水分子扩散受限更为明显,因此MK 值越大,MD 越低[13-14]。
本研究显示,卵巢良性病变的ADC 值、MD 值较恶性病变明显升高,MK 值较卵巢恶性病变者明显降低,MK 联合MD 诊断卵巢良恶性病变的AUC 大于ADC、MK、MD 的单独应用,且三者联合诊断卵巢良恶性肿瘤的AUC 大于单独应用,提示DKI 在卵巢良恶性病变鉴别诊断中的价值略高于DWI,但两者联合可提高对卵巢良恶性病变的鉴别诊断效能。DKI对卵巢病变良恶性鉴别诊断效能略高于DWI,或与体内水分子扩散运动影响因素众多、较难符合高斯分布、对DWI 诊断结果准确性有较大影响,而DKI的MK、MD 参数结合分析可提高肿瘤病变良恶性鉴别诊断效能有关[15-16],提示DWI 联合DKI 检测可 提高卵巢病灶定性诊断的准确率,有助于治疗方案的制订。
综上所述,DWI 联合DKI 可提高对卵巢病变良恶性的鉴别诊断效能。但本研究存在样本量较小、病例主要来源于同一医院等局限性,需进一步完善。
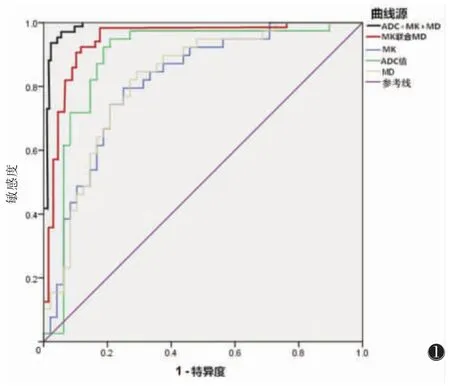
图1 ADC、平均扩散峰度(MK)值、平均扩散率(MD)诊断卵巢良恶性病变的ROC 曲线分析

