禽致病性大肠杆菌Hcp2b对雏鸡气管黏膜细胞因子-细胞因子受体相互作用通路的影响
宋祥军,沈 啸,蒋胡艳,陈 哲,刘 华,邵 颖,涂 健,祁克宗*
(1. 兽医病理生物学与疫病防控安徽省重点实验室,合肥 230036; 2. 安徽省动物疫病预防与控制中心,合肥 230091)
禽致病性大肠杆菌(avian pathogenicEscherichiacoli,APEC)属于肠道外致病性大肠杆菌,可引起禽类急性或亚急性感染,引发一系列的临床症状,如肝周炎、心包炎、腹膜炎和出血性肠炎等,已对全球养禽业造成巨大的经济损失[1-3]。同时,APEC可以感染人类,对人类的健康造成严重威胁。APEC的致病机制复杂且多种多样,迄今已发现的APEC的毒力因子包括摄铁系统、耶尔森强毒力岛(HPI)、鞭毛毒素、脂多糖、黏附素、外膜蛋白等[4-7]。随着深入研究,发现二元调控系统(TCS)、群体感应系统及分泌系统等在APEC的致病过程中也发挥着重要作用[8]。分泌系统可将各种效应蛋白分泌到外界环境或直接注入宿主细胞内[9],分泌系统效应蛋白可促进细菌获取营养、合成细胞器、防御宿主免疫并协助精准输入毒力因子[10-12]。
VI 型分泌系统(type VI secretion system,T6SS)于2006 年在霍乱弧菌中首次发现,其广泛存在于革兰阴性菌变形菌门中,分泌的多种效应蛋白可作为分子武器攻击宿主细胞[13]。T6SS通常由13~25个蛋白构成的核心组件和若干辅助组件组成[14-15],溶血素共调节蛋白(hemolysin-coregulated protein,Hcp)是T6SS复合体中重要的结构蛋白,构成T6SS针管状结构,将效应因子注入邻近的靶细胞内部,或利用自身作为效应蛋白发挥作用[16-17]。Andersson等[18]已在研究中证实,鼠疫杆菌(Yersiniapestis)的 Hcp蛋白在诱导宿主细胞的细胞毒性、抗鼠巨噬细胞的吞噬以及巨噬细胞内存活等方面发挥作用。Gallique等[19]发现荧光假单胞菌(Pseudomonasfluorescens)的Hcp1可以降低细菌的运动能力。猪肠外致病性大肠杆菌分离株PCN033的Hcp蛋白缺失会影响细菌对细胞的入侵和胞内增殖[20-21]。T6SS-2hcp基因的缺失会导致 APEC的F1菌毛表达下降,黏附Hela细胞能力下降,并促进Hela细胞肌动蛋白重排[22]。
APEC在侵入宿主后,细菌附着并侵入禽类呼吸道,进入血液感染其他重要器官[23]。APEC黏附气管是APEC感染过程中发挥重要作用的步骤[24]。细胞因子作为小分子多肽或糖蛋白,通过与靶细胞膜表面的受体结合,将信号传递到细胞内部,以此调节免疫应答并参与机体的炎症反应[25],阻碍APEC侵袭进程。本实验室前期研究发现,APEC感染雏鸡气管黏膜可导致气管黏膜出现病理变化,并导致Cytokine-cytokine receptor interaction通路基因表达量发生变化[26]。然而,T6SS效应蛋白Hcp在APEC感染禽气管黏膜中发挥的作用尚不清楚,有待进一步研究。
本研究构建了hcp2b的基因缺失株及回复株,检测了hcp2b基因缺失后对生长能力的影响。同时,通过转录组测序分析了hcp2b缺失后对鸡气管黏膜细胞mRNA表达谱的影响,并对数据进行了生物信息学分析。旨在为进一步探究T6SS-2效应蛋白Hcp在APEC感染宿主过程中的致病性研究提供理论依据。
1 材料与方法
1.1 试验菌株与主要仪器、试剂
禽致病性大肠杆菌野生株AE17菌株由安徽农业大学兽医病理生物学与疫病防控安徽省重点实验室保存,质粒pKD3、pKD46、pCP20、低拷贝质粒pSTV-28均由本实验室保存。超净工作台、37 ℃恒温培养箱、摇床、紫外分光光度仪等仪器由本实验室提供。胶回收试剂盒、质粒小提取试剂盒购自天根生化科技有限公司。其他试剂有氨苄青霉素、氯霉素、琼脂糖、胰蛋白胨、氯化钠、无菌PBS、酵母浸粉、液氮等。
1.2 试验动物
所用试验雏鸡购自安徽省安禽禽业有限公司的1日龄罗曼蛋公鸡,饲养地点为安徽农业大学动物科技学院动物房。使用清洁无污染饲具,饲养过程中使其自由饮水和采食(无抗生素饲料),挑出身体异常或精神委顿的雏鸡,其余雏鸡7日龄进行攻毒试验[26]。
1.3 引物设计
参照GenBank上APEC O1基因组中hcp2b基因序列,使用软件Primer Premier 5.0设计上游和下游引物,引物序列详见表1。设计引物由安徽通用生物公司合成。

表1 用于基因敲除和回复的引物序列
1.4 hcp2b缺失株的构建
采用Red重组方法[27]构建缺失株,以质粒pKD3为模板,hcp2b-C-F/hcp2b-C-R为引物扩增目的基因hcp2b的氯霉素抗性片段;以hcp2b-U-F/hcp2b-U-R、hcp2b-D-F/hcp2b-D-R为引物分别扩增出hcp2b的上下游同源臂。利用overlap方法,以hcp2b的上下游同源臂及氯霉素抗性片段为模板,hcp2b-U-F/hcp2b-D-R为引物扩增出打靶片段hcp2b-Up-cat-Down。将所扩增的打靶片段电转入AE17-PKD46感受态细胞中并涂布于含有氯霉素抗性的平板上,并用hcp2b-out-F/hcp2b-out-R引物对其进行PCR验证。将验证正确的阳性重组子接种于含有氯霉素的LB液体培养基中,置于42 ℃的摇床中过夜培养,以消除pKD46。将消除pKD46的阳性重组子制备成感受态细胞,导入pCP20 质粒,将其涂布于含有氯霉素和氨苄青霉素的平板中进行筛选,将所筛选的重组子用hcp2b-in-F/hcp2b-in-R、hcp2b-out-F/hcp2b-out-R进行PCR验证,验证正确的菌株命名为Δhcp2b。
1.5 hcp2b回复株的构建
以AE17基因组为模板,含有EcoRⅠ和HindⅢ酶切位点的hcp2bm-F/hcp2bm-R为引物扩增回复片段EcoRⅠ-hcp2b-HindⅢ,并胶回收、纯化目的片段。使用EcoR Ⅰ酶和Hind Ⅲ酶分别酶切EcoRⅠ-hcp2b-HindⅢ片段和低拷贝质粒pSTV-28,连接后产物电转入感受态细胞DH5α中,涂布于含有氯霉素抗性的培养基上[27]。用hcp2bm-F/hcp2bm-R对重组载体进行验证,将验证正确的重组载体导入提前制备好的感受态细胞Δhcp2b中,利用hcp2b-in-F/hcp2b-in-R、hcp2b-out-F/hcp2b-out-R分别对阳性单菌落进行验证,验证正确的菌株命名为Chcp2b。
1.6 生长曲线的测定
野生株AE17、缺失株Δhcp2b、回复株Chcp2b在 37 ℃分别进行过夜培养,次日按1∶100的比例转接入新培养基中。37 ℃静置培养转接后的菌液至OD600 nm=1.0,用无菌PBS洗涤两遍。将菌液离心、重新注入培养基,进行两倍浓缩,并在半固体培养基中央滴加2 μL菌液[28],小心移入恒温培养箱,37 ℃培养9 h后取出并测量拍照。采集数据,使用绘图软件绘制生长曲线图。
1.7 鸡气管黏膜转录组学测序
将野生株AE17和缺失株Δhcp2b置于37 ℃摇床中过夜培养,次日按1∶100的比例转接入新配制液体培养基。37 ℃震荡培养至OD600 nm=1.0,无菌PBS洗涤三遍后调整菌液浓度为1×106cfu·mL-1。7日龄罗曼蛋雏鸡随机分为4组(野生株2组,缺失株2组),处理好的菌液分别通过气管注射AE17和Δhcp2b的方式感染7日龄雏鸡,注射剂量为0.5 mL·只-1。 感染后12、24 h收集气管黏膜,提取总RNA[25]。液氮速冻后置于-80 ℃保存,送杭州联川生物测序公司采用Illumina HiSeq4000进行转录组学测序。根据FPKM(fragments per kilobase of exon per million fragments mapped)算法得到基因表达量(FPKM值),进行样本间差异分析,以∣log2fold change∣≥1,P≤0.05为标准筛选得到差异表达基因。
1.8 Real-time PCR验证
实时PCR用于验证所选基因(IL-12b、IL-1β)的转录水平,使用软件Primer Premier 5.0设计实时PCR引物,引物序列详见表2。设计引物交由安徽通用生物公司合成。使用DNase进行总RNA的处理,M-MLV将1 μg总RNA反转录。采用AccuPower 2×Greenstar qPCR主混合物以25 μL反应体积在StepOnePlus实时PCR系统上进行实时PCR,以β-actin为内参,采用2-ΔΔCt方法[29]计算差异转录基因的相对转录量。
1.9 生物信息学分析
筛选出的差异基因进行GO和KEGG富集分析,计算GO和KEGG数据库中各个条目映射的差异表达基因数目,并进行超几何检验。与整个基因组比对,筛选差异表达基因显著富集的GO和KEGG条目。
2 结 果
2.1 hcp2b缺失株及回复株的鉴定
采用内侧引物hcp2b-in-F/hcp2b-in-R和外侧引物hcp2b-out-F/hcp2b-out-R鉴定hcp2b缺失株,结果显示:Δhcp2b内侧未扩增出片段,外侧扩增出大小为711 bp的片段,AE17内侧扩增出193 bp的片段,外侧扩增出1 045 bp大小的片段,与预期相符,表明已成功构建Δhcp2b菌株(图1)。使用hcp2b内侧引物hcp2b-in-F/hcp2b-in-R和外侧引物hcp2b-out-F/hcp2b-out-R以鉴定Chcp2b菌株,结果显示,内侧扩增出大小为193 bp的片段,外侧扩增出大小为711 bp的片段,表明成功构建Chcp2b菌株(图2)。
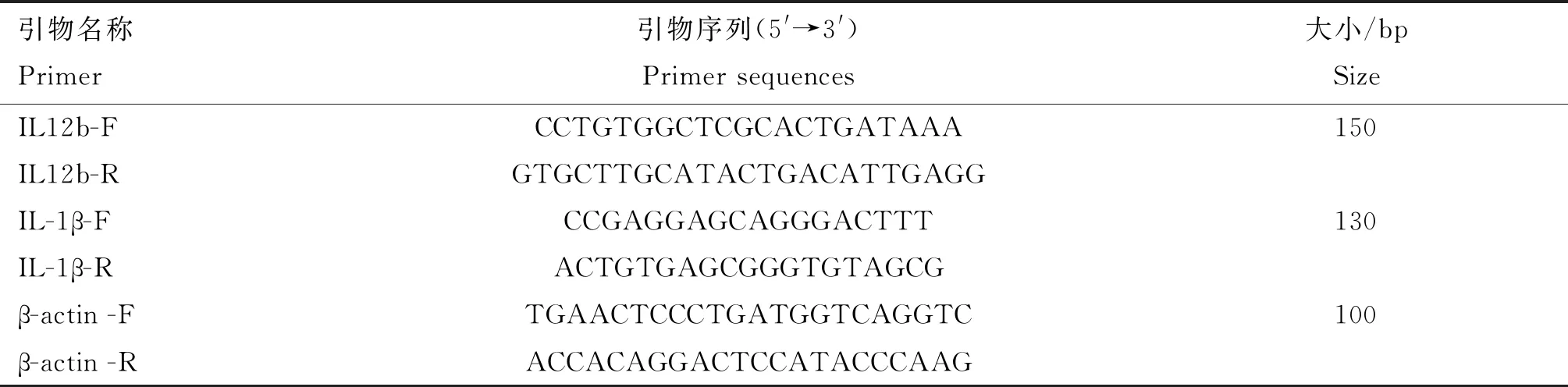
表2 Real-time PCR引物序列

M. DL2000 DNA相对分子质量标准;1.以hcp2b-in-F/ hcp2b-in-R为引物,AE17扩增出193 bp的目的片段;2.以hcp2b-in-F/ hcp2b-in-R为引物,△hcp2b扩增不出目的片段;3.阴性对照;4. 以hcp2b-out-F/ hcp2b-out-R为引物,AE17扩增出1 045 bp的目的片段;5.以hcp2b-out-F/ hcp2b-out-R为引物,△hcp2b扩增出1 724 bp的目的片段;6.阴性对照 M. 2000 bp DNA marker; 1. Using hcp2b-in-F/ hcp2b-in-R as the identification primer, the target fragment of 193 bp was amplified from AE17; 2. Using hcp2b-in-F/ hcp2b-in-R as the identification primer, no fragment could be amplified from △hcp2b; 3. Negative control; 4. Using hcp2b-out-F/ hcp2b-out-R as the identification primer, the target fragment of 1 045 bp was amplified from AE17; 5. Using hcp2b-out-F/ hcp2b-out-R as the identification primer, the target fragment of 1 724 bp was amplified from △hcp2b; 6. Negative control图1 △hcp2b菌株hcp2b基因敲除鉴定Fig.1 Identification of hcp2b gene deletion strain (△hcp2b)

M. DL2000 DNA相对分子质量标准;1.以hcp2b-out-F/ hcp2b-out-R为引物,Chcp2b扩增出711 bp的目的片段;2.以hcp2b-out-F/ hcp2b-out-R为引物,AE17扩增出1 045 bp的目的片段;3.阴性对照;4. 以hcp2b-in-F/ hcp2b-in-R为引物,AE17扩增出193 bp的目的片段;5.以hcp2b-in-F/ hcp2b-in-R为引物,Chcp2b扩增出193 bp的目的片段;6.阴性对照 M. 2000 bp DNA marker; 1. Using hcp2b-out-F/ hcp2b-out-R as the identification primer, the target fragment of 711 bp was amplified from Chcp2b; 2. Using hcp2b-out-F/ hcp2b-out-R as the identification primer, the target fragment of 1 045 bp was amplified from AE17; 3. Negative control; 4. Using hcp2b-in-F/ hcp2b-in-R as the identification primer, the target fragment of 193 bp was amplified from AE17; 5. Using hcp2b-in-F/ hcp2b-in-R as the identification primer, the target fragment of 193 bp was amplified from Chcp2b; 6. Negative control图2 hcp2b回复株鉴定Fig.2 Identification of hcp2b complementation strain
2.2 生长曲线的测定
对野生株AE17、缺失株Δhcp2b和回复株Chcp2b生长曲线的测定结果显示,与AE17相比,Δhcp2b菌株在LB中的生长速度差异不显著(图3),表明hcp2b基因缺失后对菌株的生长性能无影响。
2.3 Δhcp2b对雏鸡气管黏膜转录组的影响
以|log2fold change|≥1,P≤0.05为筛选标准,与野生株AE17相比,hcp2b基因缺失株在感染气管的不同时间段均获得差异表达基因。在感染12 h时共筛选得到144个差异表达基因,其中,87个基因表达量上调,57个基因表达量下调(图4A);感染24 h时共筛选得到 135个差异表达基因,其中,79个基因表达量上调,56个基因表达量下调(图4B)。

图3 生长曲线测定Fig.3 Determination of growth curve
2.4 Real-time PCR验证
采用Real-time PCR验证了Cytokine-cytokine receptor interaction通路中IL-12b、IL-1β基因的mRNA水平。结果显示,在Δhcp2b感染雏鸡气管12 h后,与野生株AE17感染的鸡气管黏膜相比,缺失株Δhcp2b感染的鸡气管黏膜中IL-12b、IL-1β的mRNA转录均上调(图5),Real-time PCR结果与测序数据一致。
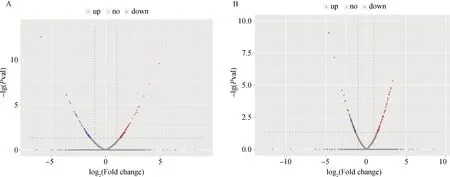
红色为上调差异表达基因;蓝色为下调差异表达基因;灰色为无差异表达基因。A.雏鸡感染12 h后的结果;B.雏鸡感染24 h后的结果 Red shows the raising of gene expression; blue shows the decrease of gene expression; gray shows there is no difference of gene expression. Chart A is the result after 12 hours of chick infection; Chart B is the result after 24 hours of chick infection图4 差异表达基因火山图Fig.4 Volcano map of differentially expressed genes

图示雏鸡感染12 h的验证结果。雏鸡气管黏膜差异转录基因倍数以AE17感染组为对照(对照组设为1) Data in the Fig.are validation results of chick tracheal infection at 12 hours. The tracheal transcription level of differentially expressed genes are nomalized to AE17 (the control group is set as 1)图5 IL-12b、IL-1β实时PCR及测序结果图Fig.5 The result map of IL-12b, IL-1β real-time PCR and sequencing
2.5 GO富集分析
GO分析结果显示,12 h时差异基因富集在热休克蛋白结合、分子伴侣结合、细胞因子活性等条目(图6A);24 h时富集在胞外空间、细胞外区域、ERK1和ERK2级联的正调控等条目(图6B)。
2.6 KEGG富集分析
KEGG分析结果显示,差异基因在感染12 h时主要富集在Cytokine-cytokine receptor interaction、Protein processing in endoplasmic reticulum通路(图6A);24 h时主要在Cytokine-cytokine receptor interaction、Focal adhesion相关通路上富集(图6B)。

图6 雏鸡感染后差异表达基因GO富集性散点图Fig.6 Scatter plot of GO enrichment of differentially expressed genes of infected chick

图7 hcp2b缺失株感染后差异表达基因KEGG通路富集Fig.7 KEGG functional enrichment of differentially expressed genes after hcp2b mutant strain infection
3 讨 论
T6SS作为一种毒力效应蛋白质注射装置,在细菌与宿主、其他细菌及非生物环境的相互作用中发挥重要作用[30]。在致病过程中,T6SS主要以接触依赖的方式靶向真核宿主从而致病[31]。Hcp蛋白是T6SS中重要的管道蛋白,负责组成T6SS尾管部分,并在宿主体内起着输出受体和效应器伴侣的作用[32]。近年来的研究发现,Hcp蛋白在APEC的致病过程中发挥着重要作用,hcp的基因缺失可影响APEC对宿主上皮细胞的黏附和侵袭能力,引起细胞骨架重排[22],hcp基因与APEC的毒力表型密切相关[33]。APEC在禽的感染致病中机制复杂,APEC可以黏附并侵袭禽气管黏膜,引起动物发病[24,34-35]。然而,T6SS及其效应蛋白Hcp在该过程中对鸡气管黏膜的作用机制仍有待进一步研究。
APEC菌株CE129的hcp2突变影响APEC的生物学特性[36],本研究成功构建了hcp2b基因缺失株及回复株。通过对野生株AE17、缺失株Δhcp2b和回复株Chcp2b的生长曲线进行测定,结果显示Δhcp2b菌株在LB中的生长速度无变化。该现象说明hcp2b基因缺失后对菌株的生长性能并无影响。已有研究表明,APEC可以通过气管感染,并引起气管发生病理变化[23]。本实验室前期研究也发现,APEC感染鸡气管8和12 h后,机体出现水肿、异嗜性细胞浸润和充血;感染后24 h,充血现象和异嗜性粒细胞浸润消失[26]。hcp2b基因缺失株感染雏鸡气管黏膜转录组学数据显示hcp2b缺失影响感染雏鸡气管黏膜基因的表达。GO及KEGG的分析显示宿主细胞分子功能和细胞成分相关基因表达量发生变化。本研究中的实时PCR反映了所选基因的转录水平,IL-1β、IL-12b转录均上调,表明感染12 h后鸡气管组织处的炎症发生及相关信号途径受到了影响。
细胞因子具有免疫调节和免疫效应相关功能,可在细胞间传递信号,在抵御组织损伤过程中发挥着重要作用[37]。研究表明,T6SS一般通过基板平台的构象变化来触发细胞质鞘的收缩,从而排出一个矛状结构来刺穿靶细胞膜,并通过效应蛋白发挥作用[38]。Hcp在APEC致病过程中对宿主细胞的作用机制尚未研究清楚。本试验的研究结果显示,hcp2b缺失株感染雏鸡气管黏膜,DERL3、DNAJB1、HSP90AA1和HSPA8等表达上调,这些基因参与蛋白质的翻译、折叠、去折叠、转运和降解改变,从而导致内质网蛋白加工异常,宿主细胞发生病变[39],这为深入研究hcp2b在APEC致病中的作用提供思路。
研究表明,IL-1和IL-6在机体免疫炎病调节过程中发挥着协同作用[40],IL-1可以通过诱导IL-6、TNF-α、iNOS、COX2等多种基因表达促进先天免疫功能及细胞增殖分化[41]。本研究中白细胞介素IL-1β等转录下调,表明hcp2b可通过调节IL-1β等白介素的转录来间接影响机体的炎症与免疫过程。此外,趋化因子及其受体在机体炎症、自身免疫性疾病的病理过程中起到一定作用,可调节白细胞向炎性组织游走和向各自位置的迁移。CCL5、CCL4可以激活单核细胞和某些T细胞亚群,其中CCL5为嗜酸性粒细胞趋化因子,参与嗜酸性粒细胞向各种组织的迁移[42]。本研究中趋化因子CCL5在感染期间表达量下调,趋化因子CCL4表达上调,表明hcp2b参与宿主免疫调节中功能调节。
4 结 论
初步探究了hcp2b对禽致病性大肠杆菌AE17致病性的影响,hcp2b基因缺失对禽致病性大肠杆菌AE17的生长性能无影响;雏鸡感染hcp2b基因缺失株12、24 h后雏鸡气管黏膜mRNA表达谱发生变化。hcp2b影响细胞因子-细胞因子受体相互作用信号通路中基因转录水平的表达,IL-1β、IL-12b的表达上调。

