上层海洋浮游生物地理分布*
张武昌 赵 苑 董 逸 李海波 赵 丽 肖 天
上层海洋浮游生物地理分布*
张武昌1, 2, 3赵 苑1, 2, 3董 逸1, 2, 3李海波1, 2, 3赵 丽1, 2, 3肖 天1, 2, 3
(1. 中国科学院海洋研究所 中国科学院海洋生态与环境科学重点实验室 青岛 266071; 2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266237; 3. 中国科学院海洋大科学研究中心 青岛 266071)
确定海洋浮游生物的分布区域是海洋浮游生态学研究的首要任务之一, 本文总结了上层海洋(0—200 m)浮游生物地理分布的研究历史、已有的认知及全球变化的影响。对浮游生物地理分布的研究可以分为19世纪末期至20世纪70年代、20世纪80年代至2000年, 以及2000年以后三个时期。根据分布区资料的时间长短, 浮游生物分布区分为瞬时分布区和时段分布区。大洋浮游生物地理分布呈按纬度平行分布的九带式格局: 赤道条带、2个中心区条带、2个亚极区条带、位于中心区和亚极区之间的2个过渡区条带及位于南北极海区的2个极区条带。洋流和水团是除过渡区条带之外的生物分布格局决定因素, 而过渡区条带的可能调控机制为中尺度涡。在核心区内生物的构成相对稳定, 但在不同位置生物的丰度比例可能不同, 在环流中心可能有演替顶极。在分布区的外围, 洋流和中尺度涡使得生物远离核心区, 繁殖能力下降不足以维持种群, 从而处于流放状态。相同分布格局的生物扩散能力不同, 扩散能力最差的生物是核心种, 最强的为先锋种。相邻水团中核心种和先锋种的交汇可以有不同的情形, 交汇的位置也会经常发生周期性的变化。由于纬度的不同和陆地的阻隔, 南北半球和不同大洋的相同条带之间有不同的种类。人类活动使得有些近岸种类发生了生物入侵, 而全球变暖使得大洋浮游生物分布区向极区移动。随着分子生物学技术的普及发展, 微食物网生物的生物地理分布研究也逐渐开展。我国的海洋生态学研究正在走向大洋深海, 对全球尺度的海洋浮游生物地理分布的关注逐渐增加, 也必将有所贡献。
浮游生物; 生物地理分布; 流放; 过渡带; 水团; 中尺度涡
海洋浮游生物虽然随波逐流, 理论上讲可以被洋流输送到海洋的各个角落, 但实际上各个种类并不是在海洋各处都有分布, 而是局限在一定水平和垂直空间内。浮游生物是营浮游生活的生物的统称, 按照粒级分为极微型(<0.2 μm)、微微型(0.2—2 μm)、微型(2—20 μm)、小型(20—200 μm)、中型(200— 2000 μm)和大型(>2000 μm)浮游生物, 不同的粒级包括不同的分类类群。不同浮游生物种(或科、属等高级分类阶元)在海洋中的分布范围称为它的分布区, 确定浮游生物在海洋中的分布区范围是海洋浮游生态学研究的首要任务之一。不同浮游生物的分布区差别很大, 取决于这种生物本身适合的环境条件及其繁殖和散布能力。浮游生物地理分布研究是确定物种分布区的格局及其形成机制、历史变迁和未来变化的科学。
虽然海洋占地球表面的70%以上, 但是海洋浮游生物地理分布研究远远落后于陆地生物地理分布。我国学者长期以来主要关注空间尺度较小的近海, 2000年之前国内学者几乎没有参与国际上进行的大洋尺度海洋浮游生物地理分布研究。随着我国的海洋生态学研究走向大洋深海, 对海洋浮游生物地理分布的关注逐渐增加。海洋是立体的生境, 自表层至海底都有浮游生物生活, 但是在上层海洋 (epipelagic layer, 0—200 m)有浮游植物进行初级生产, 浮游生物的数量最大。本文着重总结上层海洋的浮游生物地理分布格局、形成机制和变化的研究成果。此外, 个体较大的浮游植物和浮游动物存在明显的形态学特征用做物种的鉴定依据, 所以浮游生物的生物地理分布主要涉及这些类群, 浮游病毒、细菌等个体较小的生物(统称为微食物网生物)大多需要用分子生物学手段进行分类, 生物地理分布研究还不充分。本文主要讲述个体较大的浮游植物和浮游动物的生物地理分布, 对个体较小的生物在文章最后作简要介绍, 以期为我国在此领域的研究提供参考和借鉴。
1 浮游生物地理分布的研究历史
19世纪末期到20世纪40年代, 西方学者在世界各大洋开展了浮游生物调查, 这一时期的主要工作是鉴定各个海区出现的浮游生物种类, 对其丰度则较少统计(Boltovskoy, 1998)。随后的三十年内, 西方学者开始着重调查世界各大洋的浮游生物丰度。但由于大洋浮游生物直接计数工作过于费力, 自1970年后逐渐被化学分析方法取代。直接计数在部分海区还有进行, 但是由于调查能力的限制, 这些工作主要局限于近海 (Boltovskoy, 1998)。因此大洋浮游生物地理分布格局的经典理论研究更多依据的是1970年以前的工作成果。
在确定多个浮游生物种类的分布区后, 学者们发现许多种类具有相似的分布区, 可以合并为一种分布区类型, 这些分布区类型综合构成了浮游生物的生物地理分布格局。1946年, Bobrinskii等认为浮游生物的分布区域可以划分成沿纬度带分布的环形区域, 他们将全球海洋划分为7个条带 (Bobrinskii, 1946)。1953年, Ekman出版了《海洋动物地理学(Zoogeography of the Sea)》一书, 提出大洋浮游生物分为极地、温带和热带三个类型, 其中极地和温带的划分为夏季温度3.5—5°C, 温带和热带的划分为夏季温度15°C, 这是海洋浮游生物地理分布的五带式格局 (Ekman, 1953)。Brinton (1962)在前人研究的基础上在亚极区和亚热带增加了过渡带(transition zone), 初步形成了海洋浮游生物地理分布的九带式格局。van der Spoel等(1979)出版了专著《浮游生物的生物地理学和多样性(Zoogeography and diversity in plankton)》,对该领域的研究进行了阶段性的总结。van der Spoel等(1983)认为1980年以前的浮游生物地理分布研究处于起步阶段。
1985—2001年是浮游生物地理分布研究的成熟期。20世纪80年代起, 浮游生物地理学研究逐渐受到国际社会重视, 一系列的国际协同研究使得浮游生物地理分布研究取得长足进步。1985年5月29日—6月5日, 联合国教科文组织在荷兰召开了首届浮游生物地理分布研讨会[The International Conference on Pelagic Biogeography (ICoPB)], 并于第二年出版了会议论文集《浮游生物地理学(Pelagic Biogeography)》(Pierrot-Bults, 1986), 代表着浮游生物地理分布学从各学者的独立探索转变为全球学者的协作和协同研究。
1990年, 海洋研究科学委员会(Scientific Committee on Oceanic Research, SCOR) 成立第93工作组“浮游生物地理分布(Pelagic Biogeography)”, 成员包括这一时期浮游生物地理学研究的主要学者Angel M V (英国), Boltovskoy D (阿根廷), Grieve J (新西兰), Johnson R K (美国), Olson D (美国), Omori M (日本), Thiede J (德国), van der Spoel S (荷兰)和Wiebe P (美国)等。1994年, 这个工作组在期刊Progress in Oceanography 发表了一个专辑, 包括多篇介绍工作组成果的综述文章(Angel, 1994; Boltovskoy, 1994; Krause, 1994; Olson, 1994; Omori, 1994; Sournia, 1994; van der Spoel, 1994a; b; Warner, 1994; White, 1994)。
1995年7月10—14日, 联合国的政府间海洋学委员会(Intergovernmental Oceanographic Commission, IOC)与SCOR联合在荷兰召开了第二届浮游生物地理分布研讨会[The Second International Conference on Pelagic Biogeography (ICoPB II)], 并出版会议论文集总结了浮游生物地理分布的最新协作研究成果 (Pierrot-Bults, 1998)。
通过这些会议, 浮游生物地理分布的九带式格局得到进一步确立, 并被写入《海洋科学百科全书(Encyclopedia of Ocean Sciences)》词条“浮游生物地理分布 (Pelagic biogeography)” (Longhurst, 2001)成为人们的共识。图1展示了Longhurst (2001) 总结的九带式格局, 主要包括赤道条带(Equatorial, EQ)、2个中心区条带(Central, CN)、2个亚极区条带[Sub (Ant) Arctic, SA]、位于中心区和亚极区之间的2个过渡区条带(Transitional, TR)和位于南北半球的2个极区条带[(Ant) Arctic, A]。由于太平洋东部有上升流, 图中还单独划出了这一区域, 标注为EQ (ETP), 即赤道区的热带东太平洋亚区 (Longhurst, 2001)。

图1 海洋浮游生物地理分布的九带式分布格局[改绘自Longhurst (2001)]
注: EQ: 赤道条带; CN: 中心区条带; SA: 亚极区条带; TR: 过渡区条带; A: 极区条带; EQ (ETP): 赤道区的热带东太平洋亚区
2001年以后, 浮游生物地理分布研究开始了新的阶段, 研究聚焦于人类活动和全球变暖的影响。人类活动可能造成生物入侵, 入侵物种凭其超强的繁殖能力和缺乏天敌捕食的优势挤占原生物种的生存空间, 造成海区浮游生物类群分布区的改变, 导致海洋食物链结构变化, 并进而威胁海洋生态系统的稳定性。全球变暖则使得浮游生物向高纬度海区扩散, 使得原有的浮游生物分布区向极区移动。这些现象是近些年来浮游生物地理分布研究的热点。分子生物学技术的发展使得微食物网生物的生物地理分布研究落入人们的视野。
2 分布区的时空结构
2.1 分布区的空间组成
Ekman (1953)根据分布区内物种的繁殖状况提出了流放状态(expatriate), 即物种的繁殖不足以补充种群数量的流失。根据流放概念, 可将浮游生物的分布区划分为: (1) 基本分布区(range basis), (2) 可繁殖流放区(reproductive expatriate area), (3) 不可繁殖流放区(non-reproductive expatriate area) (图2)。基本分布区是可以通过繁殖保持种群数量的区域; 可繁殖流放区内生物可以繁殖, 但繁殖提供的补充不足以抵消洋流造成的种群数量损失; 不可繁殖流放区处生物不能繁殖, 种群数量因洋流导致流失。(1)和(2)合称为可繁殖区 (reproductive area), (2)和(3)合称为流放区 (expatriate area) (图2)。流放状态是海洋浮游生物地理分布不同于陆地的第一个特点。
尽管概念上可以将生物分布区划分为可繁殖区和流放区, 但是在实际研究中, 很难绝对判定一个区域内的生物是否能够繁殖, 因此基本分布区、可繁殖流放区和不可繁殖流放区是连续的, 某特定物种在三个区域之间的明确界限尚无报道。
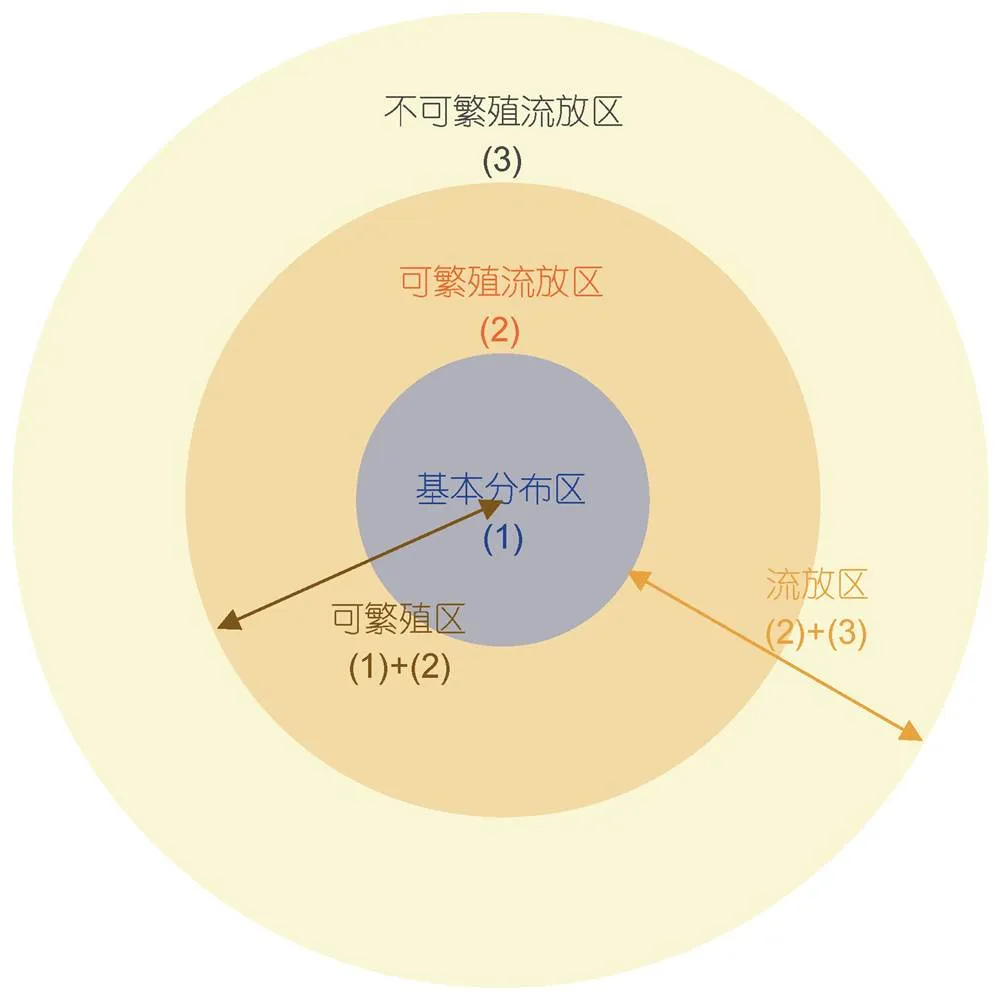
图2 浮游生物分布区的空间结构示意图
虽然分布区的范围大多根据物种有无来确定, 但是浮游生物在分布区内并不是均匀分布的, 而是有的地方丰度大, 有的地方丰度小。丰度最大的地方是最适宜它们生长的生境, 即该物种分布的核心区, 而丰度最低的地方是欠适宜的生境 (Fager, 1963)。由于基本分布区内的丰度一般大于流放区域, 所以核心区与基本分布区的范围大体一致。
2.2 分布区的时间格局
浮游生物的分布区按时间性质可以划分为瞬时(时刻)分布区和时段分布区。瞬时分布区的时间范围一般为一个航次调查期, 通常约为20—30d。由于水团边界的移动, 不同时刻的瞬时分布区位置会发生变化, 在一定时段内的瞬时分布区的叠加即为该时段的时段分布区。
海洋调查耗资巨大, 单个航次不能覆盖全球各个海区, 任何一个航次都无法明确特定物种瞬时分布区的所有边界, 因此时段分布区的确定来自很多研究者、不同时间的调查航次的瞬时分布区资料。通常是根据该种类在特定海区有和无的信息, 综合多项研究的数据在地图上标记该种类的分布并人为划上边界, 从而获得这个种类的时段分布区 (Semina, 1997)。例如Fleminger等(1977)给出的三种哲水蚤(,和)的分布区即为多个来源资料的综合。
由于时段分布区是多个瞬时分布区的汇总, 其范围大于单一时刻的瞬时分布区。此外, 瞬时分布区往往以某个区域(通常是该种类的基本分布区)为核心, 随着向周围流放的范围大小而改变, 有时流放范围大, 有时流放范围小, 其中流放范围大的几率可能较小。如果采样次数较少, 会导致对流放范围大的事件调查不足, 由此获得的时段分布区会小于该物种的最大分布范围。
浮游动物有复杂的生活史, 由于早期的研究没有分子生物学手段, 浮游生物的卵和幼体阶段很难鉴定到种, 所以获得的基本上是后期幼体或成体的分布区。但浮游生物的卵和幼体的分布区可能与后期幼体/成体的分布区不一致, 因此这些研究获得的分布区很可能是不完整的。
海洋浮游生物种类繁多, 并不是所有种类都有较好的分布区资料。丰度较高、分布范围较广的浮游生物被采集获得的几率较大, 因而研究报道较多, 分布区资料翔实。但大多数浮游生物种类的丰度较低、在样品中出现的几率较小, 因此分布区资料很少甚至缺失。
有些浮游生物具有硬质结构, 例如颗石藻、硅鞭藻、硅藻、甲藻、放射虫、有孔虫等, 可以经受住从水面向海底沉降过程的腐蚀作用并在沉积物中长期保存下来成为微化石, 可以根据沉积物中的微化石分析其历史年代分布区(Boltovskoy, 1994)。由于沉积样品比浮游样品相对难以获得, 所以用沉积物样品划定浮游生物的分布区比浮游样品的工作少。此外, 浅海沉积比深海沉积样品更易获得, 所以这一工作主要是在浅海进行(Liu, 2018)。Boltovskoy(2016, 2019)通过表层沉积物样品分析给出了放射虫和有孔虫的全球海洋地理分布。
3 分布格局的决定因素
全球海洋分为近海和大洋。近海浮游生物在环境不适宜时会形成孢子沉到海底, 待条件合适时萌发, 形成新的种群, 因此特定的近海海区有特定的浮游生物群落组成。大洋水深太大, 深水中的环境较为恒定, 如果浮游生物形成孢子沉到海底, 那么孢子将无法得到表层环境是否适宜的信号, 因此大洋中浮游生物不能以这种方式保持种群。海洋中有很多洋流, 裹挟着浮游生物不停改变位置, 但为什么一个海区总是有相同的浮游生物呢, 早期浮游生物研究者便开始思考这个问题。
闭合洋流是将浮游生物封闭在特定生存条件中的动力条件。Damas (1905)首次提到海洋的环流对浮游生物分布的重要作用, 认为在挪威海环流是能将浮游生物保持在某个特定海区的重要因素, 这一观点被随后的研究者广泛接受(Sømme, 1933; Sverdrup, 1942; Johnson, 1963; Reid, 1978; van der Spoel, 1994b)。
在Sverdrup等(1942)提出水团的概念以后, 浮游生物的地理分布就和水团紧密联系起来。De Beaufort (1943)认为水团是造成浮游生物分布格局的主要因素。海洋中的洋流及其组成的大洋环流形成水团, 从而影响浮游生物的分布格局。封闭的大洋环流将生物维持在水团之中, 在环流内部是该物种的基本分布区, 不管周边海区有没有这种生物, 该物种都能在环流内部水团持续存在。在分布区的外围, 例如相邻的大洋环流交汇处(或大洋环流和沿岸水团之间的交汇处), 环流间的混合会导致生物扩散到不同的水团, 从而进入流放状态。水团的影响范围往往决定了浮游生物的分布范围, 某物种的分布是受到水团中多种生物和非生物因子的联合调控, 而不是受单一因子的影响(Ekman, 1953; Bieri, 1959; Backus, 1986; Semina, 1997)。
目前浮游生物地理分布的九带式格局基本与大洋闭合环流的格局吻合: 赤道条带的闭合环流为南北赤道流和赤道逆流; 南北两个中心区条带的闭合环流是亚热带环流; 北半球亚极区条带的闭合环流是亚极区环流, 北极区条带的环流是贝福特环流; 在南半球, 亚极区和极区条带的环流是西风带的绕极流, 中间由极锋分割。
4 分布区内的浮游生物
4.1 核心区内的浮游生物
4.1.1 浮游生物群组 在各个条带内生活着分布区相似的种类, Fager等(1963)和Johnson等(1963)几乎同时提出浮游生物群组(group, assemblage或associations)概念, 他们认为在某水团之内往往有一致的浮游生物群组, 它们是多个浮游植物和浮游动物种类组成的联盟, 有着明确的等级丰度(rank-order abundance)。浮游生物群组往往同时发生, 对环境的变化有着相同的反应, 其形成可能是由水团的历史, 而非水团的水文特点造成的(Fager, 1963)。
分布区相似的种类在水团内的不同位置, 其相对丰度(relative abundance)或等级丰度会发生变化。Beaugrand等(2002)对北大西洋1958至1997年间使用浮游生物连续采集器(continuous plankton recorder, CPR)获得的样品进行了分析, 共发现浮游桡足类108种, 在北大西洋不同海区桡足类的相对丰度比例发生变化, 根据桡足类的种类、相对丰度等信息可划分为9个浮游桡足类群组。
分布区范围相同的两个物种, 其最大丰度所在的位置也可能不同, 例如箭虫和翼足类都是在太平洋南北纬40°之间分布, 但是箭虫在赤道区域丰度最大, 而翼足类在南北纬40°丰度较大 (Pierrot-Bults, 2013), 表明它们具有不同的分布模式。
4.1.2 演替顶极(Climax) 大洋环流跨越纬度和经度, 其空间尺度很大, 环流外缘的水体围绕环流中心进行类似椭圆的圆周运动, 这一过程中环流中心和外缘水体的光照、温度等条件都发生较大的变化, 环流不同区域的浮游生物类群也会发生变化, 有的增多, 有的减少。因此Woods (1999)提出研究环流的不同区域中生物组成的变化具有重要意义, 但由于这项研究需要较高的人力、财力投入, 至今尚无大规模实施。
与外缘相比, 环流中心的浮游生物类群是更受重视的研究内容。在环流的中心, 水体的空间变化较小, 环境因子比较稳定, 因此浮游生物的类群组成也相应较为稳定, 形成演替顶极(Climax) (Venrick, 1995)。位于亚热带北太平洋环流中心附近的ALOHA (A Long-term Oligotrophic Habitat Assessment)海洋资料观测站和北大西洋环流的中心附近的BATS (Bermuda Atlantic Time-series Study)连续观测站即着眼于演替顶极的代表性观测。在陆地上任何地点都能达到演替顶极, 但是在海洋中只有在环流核心区才能够形成演替顶极, 这是海洋浮游生物地理分布学不同于陆地的第二个重要特点。
在环流内部还可能存在着浮游生物种类组成十年际的变化, 称为稳态转换(regime shift) (deYoung, 2004), 浮游生物在几个不同的稳态之间转换, 每个稳态都能持续较长时间, 这种变化发生在环流内部, 不是由生物地理分布区的偏移造成。
4.2 导致流放的机制
水团的边缘与其内部的环境差异较大, 各个浮游生物物种的适应能力不同, 有很多种类随着环境的变化逐渐消亡。适应能力最差的种类只能存活在水团的中心区, 在向水团边缘扩散的过程中最先消失, 这些种类称为该水团的核心物种 (core species); 适应能力最强的种类分布的最远, 称为该水团的先锋物种 (pioneer species) (Li, 2016)。Semina (1997)认为核心物种没有流放区域。
4.2.1 洋流 由于大洋环流的流向和流速的差异, 在环流的不同区域, 物种向外扩散的条件不尽相同。例如北半球的亚热带环流和亚北极环流交汇区, 环流西部的流速比东部大, 且两个环流的西部流向相对, 导致此处的扩散和流放的程度较小; 而环流的东部流速较低, 浮游生物经历的环境变化较慢, 因此容易扩散和流放 (Semina, 1997)。
亚北极环流和北极环流之间的扩散在太平洋扇区和大西洋扇区有所不同。在太平洋扇区, 许多太平洋的浮游生物类群会随海水通过白令海峡进入北冰洋(Nelson, 2014), 从而进入流放状态。北太平洋亚热带环流由于阿留申岛弧的阻隔不能扩散至北冰洋, 因此北太平洋中心条带的浮游生物不能流放到北冰洋。在大西洋扇区, 大西洋的海水通过巴伦支海(Barents Sea)和弗拉姆海峡(Fram Strait)东侧进入北冰洋, 此处是大西洋浮游生物的流放区(Wassmann, 2015; Basedow, 2018), 而北冰洋的海水则可以经弗拉姆海峡西侧进入大西洋, 此处是北冰洋浮游生物的流放区(Wassmann, 2015)。由于北大西洋的亚北极环流很小, 局限于北大西洋的西侧, 因此北大西洋中心条带的热带和亚热带浮游生物会扩散到弗拉姆海峡 (Bjørklund, 2012)。
在南半球, 因为没有大陆遮挡, 亚南极环流和南极环流合并成了封闭的南极绕极流。亚热带环流和南极绕极流中的浮游生物种类可以相互扩散。与北半球不同的是, 亚热带环流中的浮游生物类群在环流西部可以扩散到绕极流中; 在环流东部, 南极绕极流中的种类可以向北扩散和流放。在南太平洋东部, 南极绕极流的浮游生物向北扩散最远, 甚至可以随秘鲁寒流到达赤道(Semina, 1997)。
浮游植物比浮游动物的流放区范围更大 (Heinrich, 1993), 部分原因是浮游植物的生理适应能力可能较强, 使他们的个体能够存活较长时间, 另一个原因可能是浮游植物能进行无性分裂生殖, 而浮游动物的完整生活史更为复杂, 相比而言不易繁殖成功 (Olson, 1994)。
4.2.2 中尺度涡 另一个造成浮游生物流放的机制是中尺度涡(mesoscale eddies)。当两个水团之间水动力条件较强时, 水团之间的边界会发生扭曲, 一个水团中的水体会以中尺度涡的形式进入另一个水团, 随之而来的是包裹在其中的浮游生物。中尺度涡会逐渐与周围的水体混合, 涡中的浮游生物随着环境的变化逐渐进入流放状态并最终走向消亡(Goldthwait, 2008)。
根据中尺度涡的位置, 可以将这类浮游生物流放机制分为三种情况: 第一种是发生在大洋水团和近岸水团之间的流放。近岸水团由于受到海岸的限制纵深较小, 主要是近岸水团以涡的形式进入大洋水团, 大洋水团则很少以涡的形式进入近岸水团。例如东北太平洋加拿大沿岸的Haida涡(Mackas, 2002, 2005)和东北大西洋西班牙沿岸的SWODDY涡(Slope Water Oceanic eDDY) (Fernández, 2004; Isla, 2004), 涡中的近岸浮游生物类群在进入大洋水团过程中大多会死亡殆尽, 但是这些涡可能又重新回到岸边, 将涡中的浮游生物类群扩散到其他近岸海区 (Batten, 2005)。第二种中尺度涡流放发生大洋水团边界处, 例如北大西洋亚热带环流和亚北极环流边界处, 有的水团进入亚热带环流, 成为冷涡, 有的水团进入亚北极环流, 成为暖涡, 暖涡和冷涡携带的浮游生物即进入流放状态(Goldthwait, 2008)。第三种是跨越大洋的涡造成浮游生物流放, 主要是指阿古拉斯涡(Agulhas ring), 它来自印度洋的阿古拉斯洋流, 在南非南部海区产生并向大西洋传播, 传播时间可以持续两年多, 到达大西洋的巴西沿岸, 导致浮游生物跨越大洋扩散和流放(Villar, 2015)。
中尺度涡会造成生物的分布与其主要的分布区不连续, 影响生物分布区的界定。中尺度涡的发现始于20世纪70年代, 而浮游生物分布区的研究在此之前就已开展, 因此以往的分布区划定可能受到了中尺度涡的影响。但是由于涡内的浮游生物处于流放状态, 随着涡远离源区, 其中的浮游生物丰度可能不大, 加之涡的面积占海面的比例较小, 被采集到的概率也不会太高, 因此中尺度涡对生物分布区界定的影响可能有限。
5 分布区边界的浮游生物
5.1 边界的交汇模式
时段分布区是多次调查结果的综合, 由于相邻水团的边界会往复移动, 加之锋面强弱变化可导致先锋物种的瞬时分布区范围变化, 所以水团边界浮游生物种类的时段分布区基本是相连或重叠的。
在特定时刻, 水团边界浮游生物瞬时分布区的交汇有几个不同模式。根据两个相邻水团中浮游生物先锋物种和核心物种的空间关系, 两个群落的交汇可以分为以下4种类型(图3): (1) 先锋物种不接触, 群落之间留有空白区, 两个群落的种类在空白区都没有分布; (2) 先锋物种接触, 但是不会混合; (3) 先锋物种混合, 但是不进入对方核心区; (4) 先锋物种混合且进入对方核心区。亚北极砂壳纤毛虫大洋群落经白令海峡进入北冰洋, 与北冰洋群落的交汇符合第一种情形(Wang, 2019)。
除了物理和化学特性之外, 由于水团和其内的浮游生物种类有良好的对应关系, 所以水团中的特有浮游生物组成被称为该水团的生物特性(Vinogradov, 1997; Keister, 2011)。早在“挑战者”号科考船环球航行的时候, Agassiz (1883)就提出浮游生物可以指示湾流的路径。Meek (1928)和Russell (1936)曾使用箭虫作为洋流的指示, Bieri (1959)认为尽管当时的相关研究仍不成熟, 利用浮游生物作为洋流或水团指示仍是很有前景的。这一观点被近年的许多研究证实, 当研究区域跨越两个水团时, 学者往往发现这两个水团中的不同种类(往往是先锋物种)可以作为水团的指示种(indicator)。例如在日本东部黑潮和亲潮的交汇锋面处, 锋面南部和北部分别是亚北极环流和亚热带环流, 其中的砂壳纤毛虫被Kato等(1993)推荐为这两个水团的指示种。在台湾海峡, 从南方吕宋海峡入侵的黑潮水和北方近岸海水形成锋面, 锋面两侧的桡足类组成有很大差别(Hsieh, 2004)。由于观测技术高速发展, 物理海洋学从未采用浮游生物指示种来指示洋流和水团, 浮游生物和水团的关系主要被浮游生物学家用来解释生物现象的成因。
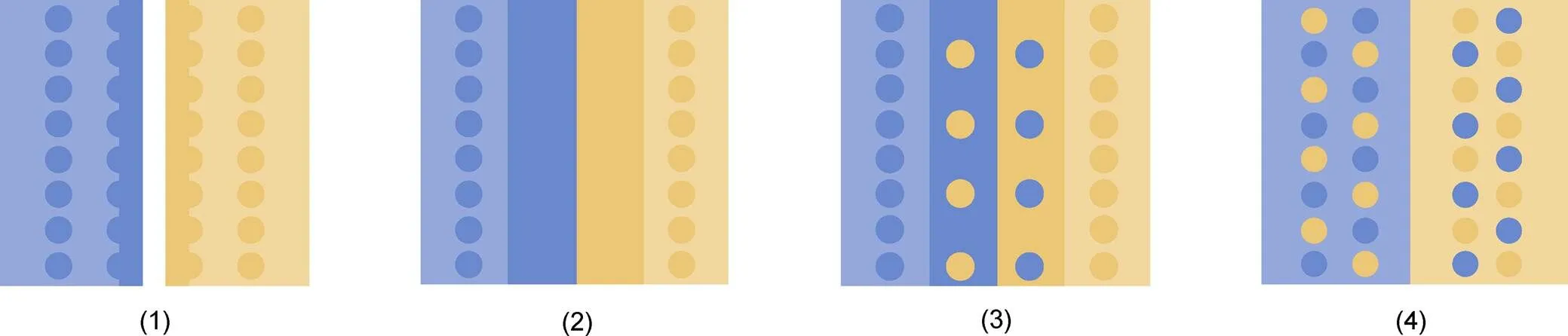
图3 水团边界浮游生物瞬时分布区的交汇模式 [仿(Li et al, 2016)]
注: 蓝点和橙点代表不同的浮游生物群落的先锋物种, 实心蓝框和橙框代表不同浮游生物群落的核心物种。(1) 两种浮游生物群落先锋物种没有交汇; (2) 两种浮游生物群落先锋物种分布区连接在一起, 但是两种群落没有混合; (3) 两种浮游生物群落的先锋物种交汇在一起, 但是均没有进入对方核心物种的分布区; (4) 两种浮游生物群落的先锋物种均进入到对方群落的核心区。
5.2 边界位置的变化
浮游生物的扩散和流放过程并不是稳定的状态, 而是时刻在改变。水团边缘向外的扩散会随水流的动态时强时弱, 导致两个水团的边界发生移动。如果一个海区(或固定观测站位)处于两个水团的边界, 水团之间边界的摆动会导致这个海区(或固定观测站位)在不同的时间被不同的水团占据, 浮游动物的组成会发生很大变化(De Puelles, 2009)。
有些边界位置的变化是周期性的, 这一情形研究最多的是北太平洋洋流(North Pacific Current)与美洲大陆的碰撞之处, 北太平洋洋流遇到美洲大陆后分裂成向南的加利福利亚寒流和向北的阿拉斯加暖流。在美国俄勒冈州和加拿大不列颠哥伦比亚外海, 浮游桡足类由暖水的南方类群和冷水的北方类群交替占据(Batten, 2011), 这一变化与由太平洋年代际振荡(Pacific Decadal Oscillation, PDO) (Batchelder, 2002; Keister, 2011)和厄尔尼诺现象(Keister, 2005)驱动的水团的变化有关。
在北海的英国诺森伯兰郡附近的浮游动物长期观测站位Station Z, 自1969年起逐月采样浮游动物样品。飞马哲水蚤在1983—1986年间出现, 到1996以后又一次出现, 在这两个时段之间是温带的浮游桡足类出现, 这一现象被认为是该站位被来自北部和南部的水团占据所导致 (Bonnet, 2004)。
6 过渡带
过渡带主要位于40°N亚热带环流与亚北极环流之间, 以及40°S亚热带环流南部边缘(图1), 目前已知的过渡带浮游生物主要是体型较大的磷虾等 (Brinton, 1962; McGowan, 1971)。过渡带处于西风带, 水体为持续向东的单向流, 西侧为过渡带浮游生物的源区。由于单向流无法形成循环, 因此过渡带中的浮游生物一直被带离源头而无法有效补充, 在东侧遇到大陆后向南北两侧分叉, 分别进入热水和冷水区域从而死亡殆尽。
过渡带提出后, 浮游生物在源头区域保持种群的机制就困扰着科学家(Reid, 1978)。Olson (1991, 2001)提出了一个假说来解释这个机制: 他认为过渡带的浮游生物都是繁殖力较强的种类, 过渡带是亚热带环流和亚极区环流的并流区, 其水动力较强, 有很多中尺度涡, 这些涡形成后会逆流而行, 从而将浮游生物从中心区和亚极区运移至过渡带源区, 并依靠其较强的繁殖力迅速补充种群。这个假说存在两个方面的不足: 第一, 这一区域的涡形成后虽然部分可以向西移动, 但还有很多涡是向北或向南移动, 并不能进入源区; 第二, 过渡带的浮游生物主要是磷虾等大型浮游生物, 生活史较长, 其繁殖力能否迅速为源头种群提供补充也受到怀疑。因而该假说并没有得到广泛认可(Boltovskoy, 1998; Longhurst, 2007), 相关机制还需要进一步研究。
在陆地生态系统中, 两个差别较大的相邻生态系统之间往往存在边缘效应(edge effect), 形成一个过渡区或称交错区。在这个过渡区除了有来自相邻群落的种类, 还会出现一些特有种类, 它们一起构成了一个新的生物群落, 称为交错群落(ecotone)。在海洋生态学研究中, 仅McGowan (1971)和Venrick (1971)在北太平洋亚热带环流和亚北极环流的交汇区分别发现了特有的浮游动物和硅藻种类, 但在此后这个区域的多次调查却未再次发现这一现象。除上述研究外, 在绝大多数交汇区研究都没有发现有不同于相邻区域的浮游生物种类。交错群落缺失是海洋浮游生物地理分布不同于陆地的第三个特点。
7 大洋条带之间的种类差异
在同一大洋内部的亚热带和亚北极带之间大部分浮游生物种类都不相同。部分广布种可以跨条带分布, 例如有些浮游生物种类在热带没有分布, 但是在南北两个亚极区(或极区)条带内都有分布, 称为两极分布(bipolarity), 这可能是由于两极的表层海水通过大洋深层水连接导致的(Stepanjants, 2006)。
由于有陆地阻隔, 北半球的亚极区和中心区条带以及南半球的中心区条带都被切割成了不同的部分, 不同的部分之间有一些特有的种类。北半球亚极区条带被分为北大西洋和北太平洋部分, 这两个部分有明显的差异, 北大西洋部分的桡足类优势种是飞马哲水蚤, 而北太平洋部分则为新哲水蚤(spp.)和邦氏真哲水蚤()(Mackas, 1999)。不同大洋之间的热带区域很少有特有种(Shih, 1979; Longhurst, 1987)。南北半球的中心区条带在大西洋、印度洋和太平洋的种类差异未见太多资料, 但印度洋和太平洋之间有印尼贯穿流连接, 有一些与大西洋不同的种类, 称为印太种类, 如浮游桡足类(Frost, 1968)和硅藻(Semina, 1997)。在印度洋北部表层的浮游桡足类中与太平洋共有的种类约占91%, 而与大西洋共有的种类只有60% (Madhupratap,1986)。在印度洋和太平洋之间由于印尼群岛的阻隔, 在印尼群岛的两侧进化出特有的近岸种类(Fleminger, 1986)。
8 时段分布区的变化
浮游生物的时段分布区不是固定不变的。时段分布区发生变化有两种情形: 如果新的分布区与原来的分布区不相连, 一般称为生物入侵; 如果新的分布区与原来的分布区相连, 则称为分布区的移动(shift), 主要是指全球变暖导致的分布区的向极移动。
8.1 生物入侵
生物入侵的例子都来自近岸种类, 大洋种类尚无报道。浮游生物入侵研究最早和最著名的生物是瓣水母, 原生于大西洋的美洲沿岸(北起美国的大西洋马萨诸塞州沿岸到南美洲的巴塔哥尼亚沿岸), 1982年在黑海的克里米亚半岛沿岸首次发现, 后迅速蔓延到整个黑海、亚速海、爱琴海、东地中海, 目前已经进入北海、波罗的海(Graham, 2008; 张芳等, 2009; Shiganova, 2019), 对渔业资源造成了很大损失。砂壳纤毛虫中的有角拟壳虫(), 可能由压舱水从海参崴扩散到了日本近海、中国近海、埃及近海、黑海沿岸、最终到达墨西哥湾 (Pierce, 1997; Saccà, 2013)。在印度洋和太平洋分布的两种硅藻和也被报道入侵至地中海(Čalić, 2018)。
8.2 向极移动
随着全球变暖对生态系统影响的研究兴起, 海洋浮游生物分布区的向极移动成为研究关注的焦点之一。全球变暖导致分布区向极区移动可以根据分布区边缘位置或核心区位置的变化来确定。为了确定这两个位置是否发生变化, 需要有长期的监测资料。边缘位置向极移动可能只是流放区域的移动, 也可能是分布核心的移动。由于分布区的北移可能与环流位置摆动有关, 在研究变暖造成的分布区向极移动时要考虑这一因素(Hátún, 2009)。
此外, 由于历史采样不足可能漏失流放范围大的事件, 所以一个时刻的瞬时分布区大于时段分布区也不能作为时段分布区移动的依据。有的研究发现在某个时刻浮游生物的分布区向极区移动, 可能是由较强的流放作用造成的, 由于这些极端事件持续时间短, 在过去也可能发生过, 但是由于调查不足没有发现, 因此这种偶尔发现的极端事件不能作为分布区向极区移动的证据。例如在北冰洋的大西洋扇区, 热带的放射虫可以到达斯瓦尔巴群岛北部海域, 不一定是分布区向极移动(Bjørklund, 2012)。
高纬度海区浮游生物分布区的向极移动在本世纪得到了科学界的高度重视, 为了监测南大洋生物地理分布的变化, 南极研究科学委员会(Scientific Committee on Antarctic Research, SCAR)于21世纪制作了《南大洋生物地理分布图集(Biogeographic atlas of the Southern Ocean)》, 作为分布区北移的基线(De Broyer, 2014)。在北冰洋的太平洋扇区入侵海流路径上设置了分布式生物监测断面(distributed biological observatory, DBO)进行长期监测(Grebmeier, 2019), 北冰洋的大西洋扇区的DBO也已规划完成准备实施。
8.2.1 北半球的向极移动
(1) CPR调查发现的浮游生物向极移动
现有最完善的时段分布区长期变化资料来自北大西洋及其近岸海区的CPR长期调查。CPR在水面下6.5 m左右进行拖曳, 工作速度为10 节, 每个样品过滤的水体为3 m3。CPR采样始于1931年的科考调查, 从二战结束后的1946年起, 英国科学家开始在商用船只上搭载CPR, 积累了时间最长、物种最多、覆盖范围最广的浮游生态调查资料(Beaugrand, 2002, 2009; Richardson, 2008)。
英国学者利用每2或4年为一个时段, 将浮游哲水蚤分成不同分布特征的群组, 去除北大西洋涛动(North Atlantic Oscillation, NAO)导致的分布区变化的周期性的影响后, 发现从1960—1999年的约40年间, 北大西洋暖水桡足类群落向北移动了1100 km, 平均每10年260 km (Beaugrand, 2002, 2009), 在比斯开湾附近的亚热带桡足类和向北移动速度则为每10年157 km (Lindley, 2005; Richardson, 2008), 与此同时极地群落向高纬度退缩。Hinder等(2012)利用CPR样品, 发现北大西洋砂壳纤毛虫的亚热带类群网袋虫在2003—2009时段比1996—2002时段分布区域向北移动, 同期冷水类群拟网纹虫向南移动。与陆地生物鸟类、蝴蝶和高山植物平均每10年向北移动6.1 km的速度相比, 海洋浮游生物分布区的向极移动速度更快 (Richardson, 2008)。
在20世纪90年代, CPR资料显示北极海区的冷水桡足类在西北大西洋向南移动, 1998年分布到了39°N的乔治浅滩(Georges Bank), 这是50年来最南的位置(Johns, 2001)。冷水类群向南分布的原因可能是太平洋和大西洋向北冰洋的入流水增加导致出流水增加, 从而将冷水种类带向南方。因为拉布拉多和纽芬兰(Labrador- Newfoundland)海区在此期间经历了异养低温, 拉布拉多洋流(Labrador Current)增强, 冷水向南扩散, 因此不能作为极区浮游动物分布区向赤道方向移动的确实证据 (Richardson, 2008)。
(2) 遥感观测颗石藻分布北移
随着科技的发展, 卫星遥感技术成为海洋浮游生物研究的有力工具。30多年的连续卫星观测表明, 随着大西洋海水的流入和温度的升高, 海洋球石藻()在巴伦支海的分布区发生了显著的向极移动, 已向北扩展到76°N, 比1989年向北扩展了5°。在近30年内, 颗石藻的分布前缘北移了501 km, 并且近十年来分布范围移动的速度明显加快(Neukermans, 2018)。随着海洋温度的持续上升,和其他温带源浮游植物很可能成为北冰洋的常规类群。
(3) 沉积物记录的浮游生物分布区变化
如果沉积物微化石记录的采样点位于两个水团的边界, 虽然不能反演其分布区的全貌, 但是可以获知某一位置在历史时期分布边界的变动。通过对弗拉姆海峡的沉积物柱状样的检测分析, 学者观察到浮游硅藻、颗石藻和放射虫的分布在过去2000年中有几次向北移动的现象, 分别在公元46—455年、1166—1434年及1736年至今, 其时段恰好与气候记录史上的三个著名的暖期(罗马暖期后期、中世纪暖期和近期变暖)相对应 (Matul, 2018)。
8.2.2 南半球分布区南移 在南半球, 南大洋的南部是南极大陆, 部分浮游生物类群的分布区紧邻南极大陆, 无法再向南移动。在这种情况下, 分布区向极移动的依据是核心区位置的移动。在南大洋的大西洋扇区(20°—80°W), 南极磷虾在1926—1939年、1976—1995年和1996—2016年这三个时段的分布区没有改变, 但是其丰度最大值所在的区域(即核心区)向南移动, 90年间平均移动了大约440 km, 变化最大的时期是20世纪70年代 (Atkinson, 2019)。Tarling等(2018)对比了1926—1938年间和1996—2013年间在南大洋德雷克海峡(Drake Passage)和斯科舍海(Scotia Sea)间海域的浮游生物拖网样品, 虽然两个时期间表层温度升高了0.74°C, 但是浮游生物丰度最大值所在位置保持不变, 并没有向南移动, 表明除了温度之外, 可能还有其他的因素影响浮游动物的分布。
9 微食物网生物的地理分布
20世纪80年代微食物网概念(Azam, 1983; Sherr, 1988)出现以后, 微食物网生物的生物地理分布学研究逐渐开展起来。微食物网生物在分类学上的最大难点是由于其个体微小、缺乏明显的形态特征而很难根据形态学定种(Dolan, 2005, 2006)。微食物网生物中, 砂壳纤毛虫个体最大且具有形态各异的壳作为分类依据, 所以是微食物网生物中分类资料最好的类群, Pierce等(1993)和Dolan等(2013)研究了砂壳纤毛虫属水平的生物地理分布, 没有发现过渡带, 也没有区分极区和亚极区条带, 而是统称为北方和南方。
分子生物学方法在微食物网生物的生物地理学研究中具有良好的应用前景, 进入21世纪后, 相关研究正在兴起(Caron, 2009; Rodríguez-Martínez, 2013; Brown, 2014; Chow, 2015; Thaler, 2015; Kent, 2016; Righetti, 2019; Wu, 2020)。但目前还鲜见这些微小生物的明确分布区, 更没有见到它们的条带分布格局, 因此, 微食物网生物的地理分布研究尚处于起步阶段, 还有很长的路要走。
10 结语
浮游生物地理学一直缺乏科学界和大众的认同, 造成这一现象的原因主要有三个: 第一, 浮游生物地理学有其不严谨的一面, 例如前面所述无法明确核心区和流放区的界限, 时段分布区的时空覆盖度没有统一的标准等; 第二, 生物地理分布研究依赖各个种类分布区的确定, 需要进行耗资巨大、花费时间长的海洋调查, 并不是所有机构都有条件进行这类调查, 加之20世纪70年代之前的政治环境和科技条件使得人们只能看到部分种类的分布区图示, 无法获得原始资料进行进一步的综合或对比分析, 使得浮游生物地理分布成为局限在少数人范围内的研究; 第三, 浮游生物地理学与其他学科的结合非常少, 也没有产生出大众和产业部门感兴趣的产品(Krause, 1994)。
我国科学家在21世纪进行了我国四大海区的浮游生物分布区北移的探索性研究(Ma, 2009; 周进等, 2009; 李云等, 2009; Zhang, 2010; Gao, 2011; Liu, 2012), 因为几乎没有时段分布区的资料, 所以这些研究尚无法得出确定的结论。随着我国大洋深海生态学研究的逐渐深入, 必将对全球尺度的海洋浮游生物地理分布研究有所贡献。
李 云, 徐兆礼, 高 倩, 2009. 长江口强壮箭虫和肥胖箭虫的丰度变化对环境变暖的响应. 生态学报, 29(9): 4773—4780
张 芳, 孙 松, 李超伦, 2009. 海洋水母类生态学研究进展. 自然科学进展, 19(2): 121—130
周 进, 徐兆礼, 马增岭, 2009. 长江口拟长脚数量变化和对环境变暖的响应. 生态学报, 29(11): 5758—5765
Agassiz A, 1883. Exploration of the surface fauna of the Gulf Stream, under the auspices of the Coast Survey. III. Part I. The porpitidae and velellidae. Memoirs of the Museum of Comparative Zoölogy at Harvard College, 8(2): 1—16
Angel M V, 1994. Editorial. Progress in Oceanography, 34(2—3): 79—80
Atkinson A, Hill S L, Pakhomov E A, 2019. Krill () distribution contracts southward during rapid regional warming. Nature Climate Change, 9(2): 142—147
Azam F, Fenchel T, Field J G, 1983. The ecological role of water-column microbes in the sea. Marine Ecology Progress Series, 10: 257—263
Backus R H, 1986. Biogeographic boundaries in the open ocean. In: Pierrot-Bul A C, van der Spoel S, Zahuranec B Jeds. Pelagic Biogeography. UNESCO technical papers in marine science 49. Paris: UNESCO, 9—13
Basedow S L, Sundfjord A, von Appen W J, 2018. Seasonal variation in transport of zooplankton into the Arctic basin through the Atlantic gateway, Fram Strait. Frontiers in Marine Science, 5: 194
Batchelder H P, Barth J A, Kosro P M, 2002. The GLOBEC Northeast Pacific California current system program. Oceanography, 15(2): 36—47
Batten S D, Crawford W R, 2005. The influence of coastal origin eddies on oceanic plankton distributions in the eastern Gulf of Alaska. Deep Sea Research Part II: Topical Studies in Oceanography, 52(7—8): 991—1009
Batten S D, Walne A W, 2011. Variability in northwards extension of warm water copepods in the NE Pacific. Journal of Plankton Research, 33(11): 1643—1653
Beaugrand G, Ibañez F, Lindley J A, 2002. Diversity of calanoid copepods in the North Atlantic and adjacent seas: species associations and biogeography. Marine Ecology Progress Series, 232: 179—195
Beaugrand G, Luczak C, Edwards M, 2009. Rapid biogeographical plankton shifts in the North Atlantic Ocean. Global Change Biology, 15(7): 1790—1803
Bieri R, 1959. The distribution of the planktonic Chaetognatha in the pacific and their relationship to the water masses. Limnology and Oceanography, 4(1): 1—28
Bjørklund K R, Kruglikova S B, Anderson O R, 2012. Modern incursions of tropical Radiolaria into the Arctic Ocean. Journal of Micropalaeontology, 31(2): 139—158
Bobrinskii N A, Zenkevich L A, Birshtein Y A, 1946. Geografiya zhivotnykh [The geography of animals]. Moscow: Sovetskaya Nauka, 455 (in Russian)
Boltovskoy D, 1994. The sedimentary record of pelagic biogeography. Progress in Oceanography, 34(2—3): 135—160
Boltovskoy D, 1998. Pelagic biogeography: background, gaps and trends. In: Pierrot-Bults A C, van der Spoel S eds. Pelagic Biogeography ICoPB II: Proceedings of the 2nd International Conference. Final report of SCOR/IOC Working Group 93 “Pelagic Biogeography”. Paris: UNESCO, 53—64
Boltovskoy D, Correa N, 2016. Biogeography of Radiolaria Polycystina (Protista) in the World Ocean. Progress in Oceanography, 149: 82—105
Boltovskoy D, Correa N, 2019. Worldwide distribution patterns of the planktonic shelled protists radiolaria (polycystina) and foraminifera: Similarities and contrasts. Paleontological Journal, 53(8): 768—773
Bonnet D, Frid C, 2004. Seven copepod species considered as indicators of water-mass influence and changes: results from a Northumberland coastal station. ICES Journal of Marine Science, 61(4): 485—491
Brinton E, 1962. The distribution of Pacific euphausiids. Bulletin of the Scripps Institution of Oceanography, 8(2): 21–270
Brown M V, Ostrowski M, Grzymski J J, 2014. A trait based perspective on the biogeography of common and abundant marine bacterioplankton clades. Marine Genomics, 15: 17—28
Čalić M, Ljubimir S, Bosak S, 2018. First records of two planktonic Indo-Pacific diatoms:andin the Adriatic Sea. Oceanologia, 60(1): 101—105
Caron D A, Gast R J, Countway P D, 2009. Microbial eukaryote diversity and biogeography. Microbe, 4(2): 71—77
Chow C E T, Suttle C A, 2015. Biogeography of viruses in the sea. Annual Review of Virology, 2: 41—66
Damas D, 1905. Notes biologiques sur les copépodes de la mer norvégienne. ICES Journal of Marine Science, S1(22): 3—23
De Beaufort L F, 1943. Zoögeographie. De verspreiding der dieren over de Aarde. Gorinchem: J. Noorduyn & Zoon, 186
De Broyer C, Koubbi P, Griffiths H J, 2014. Biogeographic atlas of the Southern Ocean. Cambridge: Scientific Committee on Antarctic Research, 498
De Puelles M L F, Lopéz-Urrutia Á, Morillas A, 2009. Seasonal variability of copepod abundance in the Balearic region (Western Mediterranean) as an indicator of basin scale hydrological changes. Hydrobiologia, 617(1): 3—16
deYoung B, Harris R, Alheit J, 2004. Detecting regime shifts in the ocean: data considerations. Progress in Oceanography, 60(2—4): 143—164
Dolan J R, 2005. An introduction to the biogeography of aquatic microbes. Aquatic Microbial Ecology, 41(1): 39—48
Dolan J R, 2006. Microbial biogeography? Journal of Biogeography, 33(2): 199—200
Dolan J R, Pierce R W, 2013. Diversity and distributions of tintinnids. In: Dolan J R, Montagnes D J S, Agatha Seds. The Biology and Ecology of Tintinnid Ciliates: Models for Marine Plankton. Chichester, West Sussex: John Wiley & Sons, Ltd, 214—243
Ekman S, 1953. Zoogeography of the Sea. London: Sidgwick & Jackson, 417
Fager E W, McGowan J A, 1963. Zooplankton species groups in the North Pacific. Science, 140(3566): 453—460
Fernández E, Álvarez F, Anadón R, 2004. The spatial distribution of plankton communities in a Slope Water anticyclonic Oceanic eDDY (SWODDY) in the southern Bay of Biscay. Journal of the Marine Biological Association of the United Kingdom, 84(3): 501—517
Fleminger A, 1986. The Pleistocene equatorial barrier between the Indian and Pacific oceans and a likely cause for Wallace’s Line. In: Pierrot-Bults A C, van der Spoel S, Zahuranec B Jeds. Pelagic Biogeography. Proceedings of an international conference. UNESCO technical papers in marine science 49. Paris: UNESCO, 84—97
Fleminger A, Hulsemann K, 1977. Geographical range and taxonomic divergence in North Atlantic(,and). Marine Biology, 40(3): 233—248
Frost B W, Fleminger A, 1968. A revision of the genus(Copepoda: Calanoida) with remarks on distributional patterns in diagnostic characters. Berkeley: University of California Press, 235
Gao Q, Xu Z L, 2011. Effect of regional warming on the abundance ofWang et Chen (Euphausiacea) off the Changjiang River (Yangtze River) Estuary. Acta Oceanologica Sinica, 30(6): 122—128
Goldthwait S A, Steinberg D K, 2008. Elevated biomass of mesozooplankton and enhanced fecal pellet flux in cyclonic and mode-water eddies in the Sargasso Sea. Deep Sea Research Part II: Topical Studies in Oceanography, 55(10—13): 1360—1377
Graham W M, Bayha K M, 2008. Biological invasions by marine jellyfish. In: Nentwig W ed. Biological Invasions. Berlin, Heidelberg: Springer, 239—255
Grebmeier J M, Moore S E, Cooper L W, 2019. The distributed biological observatory: A change detection array in the Pacific Arctic – An introduction. Deep Sea Research Part II: Topical Studies in Oceanography, 162: 1—7
Hátún H, Payne M R, Beaugrand G, 2009. Large bio-geographical shifts in the north-eastern Atlantic Ocean: From the subpolar gyre, via plankton, to blue whiting and pilot whales. Progress in Oceanography, 80(3—4): 149—162
Heinrich A K, 1993. Boundaries and structure of the oceanic plankton communities. In: Rudyakov U A ed. Comparative Ecology of Plankton Oceanic Communities. Moscow: Nauka, 6—46
Hinder S L, Manning J E, Gravenor M B, 2012. Long-term changes in abundance and distribution of microzooplankton in the NE Atlantic and North Sea. Journal of Plankton Research, 34(1): 83—91
Hsieh C H, Chiu T S, Shih C T, 2004. Copepod diversity and composition as indicators of intrusion of the Kuroshio Branch Current into the Northern Taiwan Strait in Spring 2000. Zoological Studies, 43(2): 393—403
Isla J A, Ceballos S, Huskin I, 2004. Mesozooplankton distribution, metabolism and grazing in an anticyclonic slope water oceanic eddy (SWODDY) in the Bay of Biscay. Marine Biology, 145(6): 1201—1212
Johns D G, Edwards M, Batten S D, 2001. Arctic boreal plankton species in the Northwest Atlantic. Canadian Journal of Fisheries and Aquatic Sciences, 58(11): 2121—2124
Johnson M W, Brinton E, 1963. Biological species, water masses and currents. In: Hill M N ed. The Sea, Ideas and Observations on Progress in the Study of Seas, Vol. 2. London: Interscience Publishers, 381—414
Kato S, Taniguchi A, 1993. Tintinnid ciliates as indicator species of different water masses in the western North Pacific Polar Front. Fisheries Oceanography, 2(3—4): 166—174
Keister J E, Di Lorenzo E, Morgan C A, 2011. Zooplankton species composition is linked to ocean transport in the Northern California Current. Global Change Biology, 17(7): 2498—2511
Keister J E, Johnson T B, Morgan C A, 2005. Biological indicators of the timing and direction of warm-water advection during the 1997/1998 El Niño off the central Oregon coast, USA. Marine Ecology Progress Series, 295: 43—48
Kent A G, Dupont C L, Yooseph S, 2016. Global biogeography ofgenome diversity in the surface ocean. The ISME Journal, 10: 1856—1865
Krause D C, Angel M V, 1994. Marine biogeography, climate change and societal needs. Progress in Oceanography, 34(2—3): 221—235
Li H, Zhao Y, Chen X, 2016. Interaction between neritic and warm water tintinnids in surface waters of East China Sea. Deep Sea Research Part II: Topical Studies in Oceanography, 124: 84—92
Lindley J A, Daykin S, 2005. Variations in the distributions ofand(Copepoda: Calanoida) in the north-eastern Atlantic Ocean and western European shelf waters. ICES Journal of Marine Science, 62(5): 869—877
Liu D Y, Jiang J J, Wang Y, 2012. Large scale northward expansion of warm water species(Bacillariophyceae) in China seas. Chinese Journal of Oceanology and Limnology, 30(4): 519—527
Liu D Y, Wang Y N, Wang Y Q, 2018. Ocean fronts construct spatial zonation in microfossil assemblages. Global Ecology and Biogeography, 27(10): 1225—1237
Longhurst A R, 2001. Pelagic biogeography. In: Steele J H, Turekian K K, Thorpe S A eds. Encyclopedia of Ocean Sciences, volume 4. San Diego: Academic Press, 2114—2122
Longhurst A R, 2007. Ecological Geography of the Sea. 2nd ed. San Diego: Academic Press, 542
Longhurst A R, Pauly D, 1987. Biological communities of tropical oceans. In: Longhurst A R, Pauly D eds. Ecology of Tropical Oceans. San Diego: Academic Press, 62—105
Ma Z L, Xu Z L, Zhou J, 2009. Effect of global warming on the distribution ofand(Decapoda) in the Changjiang estuary. Progress in Natural Science, 19(10): 1389—1395
Mackas D L, Galbraith M D, 2002. Zooplankton distribution and dynamics in a North Pacific Eddy of coastal origin: I. Transport and loss of continental margin species. Journal of Oceanography, 58(5): 725—738
Mackas D L, Tsuda A, 1999. Mesozooplankton in the eastern and western subarctic Pacific: Community structure, seasonal life histories, and interannual variability. Progress in Oceanography, 43(2—4): 335—363
Mackas D L, Tsurumi M, Galbraith M D, 2005. Zooplankton distribution and dynamics in a North Pacific Eddy of coastal origin: II. Mechanisms of eddy colonization by and retention of offshore species. Deep Sea Research Part II: Topical Studies in Oceanography, 52(7—8): 1011—1035
Madhupratap M, Haridas P, 1986. Epipelagic calanoid copepods of the northern Indian Ocean. Oceanologica Acta, 9(2): 105—117
Matul A, Spielhagen R F, Kazarina G, 2018. Warm-water events in the eastern Fram Strait during the last 2000 years as revealed by different microfossil groups. Polar Research, 37(1): 1540243
McGowan J A, 1971. Oceanic biogeography of the Pacific. In: Funnel B M, Riedel W R eds. The Micropaleontology of Oceans. Cambridge, MA: Cambridge University Press, 3—74
Meek A, 1928. Onandfrom the northumbrian plankton, with a note on a trematode parasite. Proceedings of the Zoological Society of London, 98(3): 743—779
Nelson R J, Ashjian C J, Bluhm B A, 2014. Biodiversity and biogeography of the lower trophic taxa of the Pacific Arctic region: Sensitivities to climate change. In: Grebmeier J M, Maslowski W eds. The Pacific Arctic Region: Ecosystem Status and Trends in a Rapidly Changing Environment. Dordrecht: Springer, 269—336
Neukermans G, Oziel L, Babin M, 2018. Increased intrusion of warming Atlantic water leads to rapid expansion of temperate phytoplankton in the Arctic. Global Change Biology, 24(6): 2545—2553
Olson D B, 1991. Rings in the ocean. Annual Review of Earth and Planetary Sciences, 19(1): 283—311
Olson D B, 2001. Biophysical dynamics of western transition zones: a preliminary synthesis. Fisheries Oceanography, 10(2): 133—150
Olson D B, Hood R R, 1994. Modelling pelagic biogeography. Progress in Oceanography, 34(2—3): 161—205
Omori M, van der Spoel S, Norman C P, 1994. Impact of human activities on pelagic biogeography. Progress in Oceanography, 34(2—3): 211—219
Pierce R W, Turner J T, 1993. Global biogeography of marine tintinnids. Marine Ecology Progress Series, 94: 11—26
Pierce R W, Carlton J T, Carlton D A, 1997. Ballast water as a vector for tintinnid transport. Marine Ecology Progress Series, 149: 295—297
Pierrot-Bults A C, Angel M V, 2013. Pelagic biodiversity and biogeography of the oceans. Biology International, 51: 9—35
Pierrot-Bults A C, van der Spoel S, 1998. Pelagic biogeography ICoPB II: Proceedings of the 2nd International Conference. Final report of SCOR/IOC Working Group 93 “Pelagic Biogeography”. Noordwijkerhout, Netherlands: UNESCO, 387
Pierrot-Bults A C, van der Spoel S, Zahuranec B J, 1986. Pelagic biogeography: Proceedings of an international conference. UNESCO technical papers in marine science 49. Paris: UNESCO, 295
Reid J L, Brinton E, Fleminger A, 1978. Ocean circulation and marine life. In: Charnock H, Deacon G eds. Advances in Oceanography. Boston, MA: Springer, 65—130
Richardson A J, 2008. In hot water: zooplankton and climate change. ICES Journal of Marine Science, 65(3): 279—295
Righetti D, Vogt M, Gruber N, 2019. Global pattern of phytoplankton diversity driven by temperature and environmental variability. Science Advances, 5(5): eaau6253
Rodríguez-Martínez R, Rocap G, Salazar G, 2013. Biogeography of the uncultured marine picoeukaryote MAST-4: temperature-driven distribution patterns. The ISME Journal, 7: 1531—1543
Russell F S, 1936. Observations on the distribution of plankton animal indicators made on Col. E. T. Peel’s yacht “St. George” in the mouth of the English Channel, July, 1935. Journal of the Marine Biological Association of the United Kingdom, 20(3): 507—522
Saccà A, Giuffrè G, 2013. Biogeography and ecology of, a presumptive invasive tintinnid ciliate. Journal of Plankton Research, 35(4): 894—906
Semina H J, 1997. An outline of the geographical distribution of oceanic phytoplankton. In: Blaxter J H S, Southward A J, Gebruk A Veds. Advances in Marine Biology. The Biogeography of the Oceans. San Diego: Academic Press, 527—563
Sherr E, Sherr B, 1988. Role of microbes in pelagic food webs: a revised concept. Limnology and Oceanography, 33(5): 1225—1227
Shiganova T A, Sommer U, Javidpour J, 2019. Patterns of invasive ctenophoredistribution and variability in different recipient environments of the Eurasian seas: A review. Marine Environmental Research, 152: 104791
Shih C T, 1979. East-west diversity. In: van der Spoel S, Pierrot-Bults A C eds. Zoogeography and Diversity in Plankton. London: Edward Arnold, 87—102
Sømme I D, 1933. A possible relation between the production of animal plankton and the current-system of the sea. The American Naturalist, 67(708): 30—52
Sournia A, 1994. Pelagic biogeography and fronts. Progress in Oceanography, 34(2—3): 109—120
Stepanjants S D, Cortese G, Kruglikova S B, 2006. A review of bipolarity concepts: history and examples from Radiolaria and Medusozoa (Cnidaria). Marine Biology Research, 2(3): 200—241
Sverdrup H U, Johnson M W, Fleming R H, 1942. The Oceans: Their Physics, Chemistry, and General Biology. New York: Prentice-Hall, 1087
Tarling G A, Ward P, Thorpe S E, 2018. Spatial distributions of Southern Ocean mesozooplankton communities have been resilient to long‐term surface warming. Global Change Biology, 24(1): 132—142
Thaler M, Lovejoy C, 2015. Biogeography of heterotrophic flagellate populations indicates the presence of generalist and specialist taxa in the Arctic Ocean. Applied and Environmental Microbiology, 81(6): 2137—2148
van der Spoel S, 1994a. History, progress and future of theory in pelagic biogeography. Progress in Oceanography, 34(2—3): 101—107
van der Spoel S, 1994b. The basis for boundaries in pelagic biogeography. Progress in Oceanography, 34(2—3): 121—133
van der Spoel S, Heyman R P, 1983. A Comparative Atlas of Zooplankton: Biological Patterns in the Oceans. Berlin: Springer-Verlag, 186
van der Spoel S, Pierrot-Bults A C, 1979. Zoogeography and Diversity of Plankton. Edward Arnold, London. 410
Venrick E L, 1971. Recurrent groups of diatom species in the north pacific. Ecology, 52(4): 614—625
Venrick E L, 1995. Scales of variability in a stable environment: phytoplankton in the central North Pacific. In: Powell T M, Steele J H eds. Ecological Time Series. Boston, MA: Springer, 150—180
Villar E, Farrant G K, Follows M, 2015. Environmental characteristics of Agulhas rings affect interocean plankton transport. Science, 348(6237): 1261447
Vinogradov M E, 1997. Some problems of vertical distribution of meso- and macroplankton in the ocean. In: Blaxter J H S, Southward A J, Gebruk A Veds. Advances in Marine Biology. The Biogeography of the Oceans. San Diego: Academic Press, 1—92
Wang C F, Xu Z Q, Liu C G, 2019. Vertical distribution of oceanic tintinnid (Ciliophora: Tintinnida) assemblages from the Bering Sea to Arctic Ocean through Bering Strait. Polar Biology, 42(11): 2105—2117
Warner A J, Hays G C, 1994. Sampling by the continuous plankton recorder survey. Progress in Oceanography, 34(2—3): 237—256
Wassmann P, Kosobokova K N, Slagstad D, 2015. The contiguous domains of Arctic Ocean advection: trails of life and death. Progress in Oceanography, 139: 42—65
White B N, 1994. Vicariance biogeography of the open-ocean Pacific. Progress in Oceanography, 34(2—3): 257—284
Woods J, 1999. Understanding the ecology of plankton. European Review, 7(3): 371—384
Wu P F, Li D X, Kong L F, 2020. The diversity and biogeography of microeukaryotes in the euphotic zone of the northwestern Pacific Ocean. Science of the Total Environment, 698: 134289
Zhang D J, Li S J, Guo D H, 2010. Impacts of global warming on marine zooplankton. Marine Science Bulletin, 12(2): 15—25
BIOGEOGRAPHY OF EPIPELAGIC MARINE PLANKTON
ZHANG Wu-Chang1, 2, 3, ZHAO Yuan1, 2, 3, DONG Yi1, 2, 3, LI Hai-Bo1, 2, 3, ZHAO Li1, 2, 3, XIAO Tian1, 2, 3
(1. CAS Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China; 3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China)
To determine the distribution area of marine plankton is one of the primary tasks of marine planktonic ecology research. The research history of the biogeography studies of marine plankton in the epipelagic layer (0—200 m), the existing cognition and the influence of global changes were reviewed. The study of the biogeographic distribution of plankton can be divided into three episodes: the late 19th century to the 1970s, the 1980s to the year 2000, and the year 2000 onwards. According to the length of time of distribution data, the distribution area of plankton could be divided into instantaneous distribution area and period distribution area. The plankton distribution pattern in the ocean is parallel to nine belts in latitude: an equatorial belt, two central belts, two sub-polar belts, two transition zone belts located between central and sub-polar belts, and two polar belts in the Arctic and Antarctic seas. Ocean currents and water masses are the determinants of biological distribution except in the transition zone belts. The possible regulation mechanism of the transition zone belts is mesoscale eddies. The composition of plankton species in the core area is relatively stable, but the abundance ratio in different locations may be different. A succession climax may occur in the circulation center. In the periphery of the distribution area, ocean currents and mesoscale eddies carry organisms away from the core area. Their reproductive capacity declines and cannot maintain the population, so they are in a state of expatriate. The biological diffusion ability of plankton with same distribution pattern is different. The core species have the worst diffusion ability, and the pioneer species have the strongest. The intersection of the core and pioneer species in adjacent water masses may vary, and the location of the intersection may change periodically. Due to different latitudes and land barriers, there are different species between the northern and southern hemispheres, as well as between the same bands of different oceans. Human activities have caused some nearshore species to invade into other sea areas, while global warming makes the distribution area of ocean plankton to shift pole-ward. With the popularization and development of molecular biology technology, studies of biogeographic distribution of microbial food web organisms has been gradually advanced. As the study of marine ecology in China has expanded to open ocean and deep sea, more and more attention has been paid to the global biogeographic distribution pattern of marine plankton.
plankton; biogeographic distribution; expatriate; transition zone; water mass; mesoscale eddy
* 中国科学院战略性先导科技专项, XDB42030402号, XDA19060201号; 国家自然科学基金, 42076139号。张武昌, 博士生导师, 研究员, E-mail: wuchangzhang@qdio.ac.cn; 并列第一作者: 赵 苑, 副研究员, E-mail: yuanzhao@qdio.ac.cn
2020-08-07,
2020-11-03
Q178
10.11693/hyhz20200100211

