基因表达联合甲基化分析探索肝癌肿瘤标志物
陈慧,郭亚男,余祖江
(1.郑州大学第一附属医院 感染科,河南 郑州 450052;2.郑州市中心医院 感染性疾病科,河南 郑州 450007)
在我国原发性肝癌发病率在恶性肿瘤中排名第4位,占癌症相关死亡原因第3位[1],在全世界恶性肿瘤发病率中位于第6位[2]。原发性肝癌由肝细胞癌(hepatocellular carcinoma,HCC)、肝内胆管细胞癌(intrahepatic cholangiocarcinoma,ICC)和HCC-ICC混合癌组成,其中HCC所占比例最高,为85%~90%。病毒性肝炎、酒精性肝炎、非酒精性脂肪性肝炎、黄曲霉毒素污染食物引起的慢性损伤性肝炎等经过长期慢性炎症刺激,可发展为肝硬化和肝癌。甲胎蛋白作为临床上最常见的肝癌肿瘤标志物,广泛应用于原发性肝癌的辅助诊断、疗效评估和复发监测,由于其敏感性和特异性仍存在一定不足等原因[3-4],大多数肝癌确诊时已为晚期。随着基因学及生物信息学的发展,为进一步改善肝癌早期确诊率和早期治疗率、延长患者生存时间,探索新的肝癌肿瘤标志物十分必要。
肿瘤的发生发展涉及多方面的变化,包括遗传和表观改变的积累[5]。启动子甲基化的表观遗传调控在肿瘤形成中有着重要作用[6]。此外,DNA表观遗传失调在肿瘤的发生发展过程中可用于癌症的辅助诊断或预后标记。本研究从癌症基因组图谱(the Cancer Genome Atlas,TCGA)数据库获取原发性肝癌甲基化数据及基因表达数据,联合分析筛选出可能为肝癌肿瘤标志物的RBM15B(the RNA binding motif protein 15B)。RBM15B分子是SPEN(split end)家族中的一员,为RNA结合蛋白。RBM15B蛋白含有3个RNA识别基序,位于N端半部,分为1个核定位信号,以及1个裂和C-末端结构域,共同介导甲状腺受体转录沉默介质、维甲酸及核受体辅抑制子之间的相互作用[7],该分子在肝癌中作用尚不明确,为研究该分子与肝癌的关系,本研究在mRNA水平上利用数据库数据分析其在HCC中的表达水平及对预后的评估价值,再通过组织芯片技术从蛋白水平检测RBM15B在HCC中的表达情况,探讨RBM15B是否可以作为HCC的肿瘤标志物。
1 资料与方法
1.1 通过TCGA数据库筛选潜在的肝癌肿瘤标志物1.1.1从TCGA数据库中下载、过滤相关数据 从TCGA数据库中下载原发性肝癌基因表达数据(RNA-Seq)和启动子甲基化数据,将RNA-Seq与甲基化谱中都有的癌与癌旁样本进行匹配,共得到41个肝癌患者的癌与癌旁组织样本数据。将RNA-Seq数据从FPKM格式转换成TPM数据,定义基因TSS区上游800 bp到下游200 bp区间为启动子区域,用探针处理相应的启动子甲基化区域,将空载的探针去除,当有多个探针对应到同一基因区域时,取平均值作为该基因的启动子甲基化表达水平,共得到17 937个启动子甲基化的基因供后续研究。
1.1.2筛选低启动子甲基化高表达基因(epigenetically induced,EI)和高启动子甲基化低表达基因(epigenetically suppressed,ES) 在配对的癌与癌旁组织中每个基因的表达中位数之比为差异倍数(fold chang),进行配对t检验,选择P<0.05和∣log2(fold change)∣>1的基因作为表达差异基因,P<0.05的作为启动子甲基化差异基因。进一步整合表达上调基因与启动子甲基化下调基因和表达下调基因与启动子甲基化上调基因,得到互斥模式的EI和ES基因,其中EI基因共1 177个,ES基因共165个。
1.1.3筛选潜在肿瘤标志物 计算每一个EI和ES基因与其启动子甲基化之间的相关系数,共419个EI基因和68个ES基因与其启动子甲基化呈负相关。随后,从HIPPIE数据库中下载人类蛋白互作数据,以此建立蛋白互作网络,将上述EI和ES基因全部映射到蛋白互作网络,最终构建出EI/ES互作子网。有436个基因映射至网络中,彼此互作的基因有315个。计算EI/ES互作网络中每个基因互作的EI和ES基因个数,以此构建统计学模型。计算出每个基因EI和ES富集情况,将富集显著性P值的错误发现率(false discovery rate,FDR)小于0.05的基因作为EI/ES调控子网中表达特异基因。
1.2 多数据库验证RBM15B在肝癌组织中的表达差异及预后分析下载TCGA数据库、LIRIJP数据库和GEO数据库中6个数据集(GSE45436、GSE54236、GSE54238、GSE57957、GSE60502、GSE84005)中癌与癌旁RBM15B mRNA表达数据及其匹配的随访资料,利用R语言工具进行数据过滤及处理,比较癌与癌旁组织中RBM15B mRNA表达差异。将TCGA数据库中的RBM15B mRNA按表达水平分为高表达和低表达两组,绘制生存曲线,比较两组总体生存(overall survival,OS)和无进展生存(progress free survive,PFS)情况,再按肝癌TNM分期分为TNM 1~2和TNM 3~4两组,比较两组RBM15B mRNA表达水平。
1.3 HCC组织芯片中RBM15B蛋白表达分析收集郑州大学第一附属医院HCC组织和配对的癌旁正常组织100对。对组织进行免疫组织化学检测,经过脱苯、脱蜡、抗原修复等步骤,加兔抗人RBM15B一抗(购自武汉三鹰生物技术有限公司,货号为22249-1-AP,按1∶200稀释),室温孵育2 h,用磷酸盐缓冲液(phosphate buffer saline,PBS)洗片后加入羊抗兔二抗(购自武汉三鹰生物技术有限公司,货号为SA00001-2)并室温孵育1 h,最后用二氨基联苯胺(diaminobenzidine,DAB)溶液显示信号。阳性细胞呈棕黄色着色,结果由两位病理科医生以盲法共同判读,依据Remmele评分系统,在每份癌或癌旁标本中选择3个高倍视野,按染色区域百分比的平均数进行评分,<25%、25%~<50%、50%~<75%、≥75%分别为1+、2+、3+、4+级。
1.4 统计学方法所有数据均采用R和GraphPad Prism 6软件进行统计分析。两独立样本采用t检验,当不满足两独立样本t检验前提时采用秩和检验;两配对样本采用配对t检验;采用Kaplan-Meier法绘制生存曲线,进行Log-rank检验。检验水准α=0.05。
2 结果
2.1 TCGA数据库分析结果根据肝癌基因表达与甲基化数据关联分析,同时联合人类蛋白互作数据,筛选得到EI/ES基因互作子网中4个表达特异基因,分别为RBM15B(P=6.09×10-5,FDR=1.21×10-2)、TIPIN(P=3.06×10-5,FDR=6.15×10-3)、DUSP28(P=2.88×10-5,FDR=5.81×10-3)和TRIM31(P=1.66×10-4,FDR=3.29×10-2)。在EI/ES互作子网中,RBM15B的互作基因个数最多,共有31个,提示在细胞多个生命活动中,RBM15B可与多个蛋白相互作用。
2.2 多个数据库中RBM15B在肝癌中的表达及预后分析
2.2.1表达差异分析 TCGA和LIRIJP数据库资料分析结果显示,癌组织中RBM15B mRNA表达水平高于癌旁组织(P<0.001);在大多数GEO数据集中,RBM15B mRNA表达水平高于癌旁组织(P<0.01),少数GEO数据集中两者表达水平差异无统计学意义(P>0.05)。见图1。
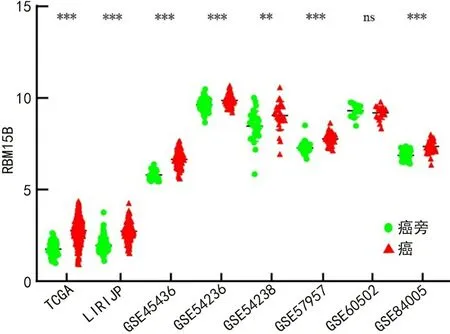
ns表示P>0.05,**表示P<0.01,***表示P<0.001。
2.2.2预后分析 RBM15B mRNA高表达组中位OS(P=0.005)和中位PFS(P<0.001)均短于低表达组,见图2、3。TNM 3~4组RAM15B mRNA表达水平高于TNM 1~2组(P=0.008),见图4。
2.3 HCC组织芯片中RBM15B蛋白表达水平HCC组织中RBM15B蛋白表达水平高于癌旁组织(P<0.001),见表1和图5。

图2 RBM15B mRNA高表达组与低表达组总体 生存期(OS)比较
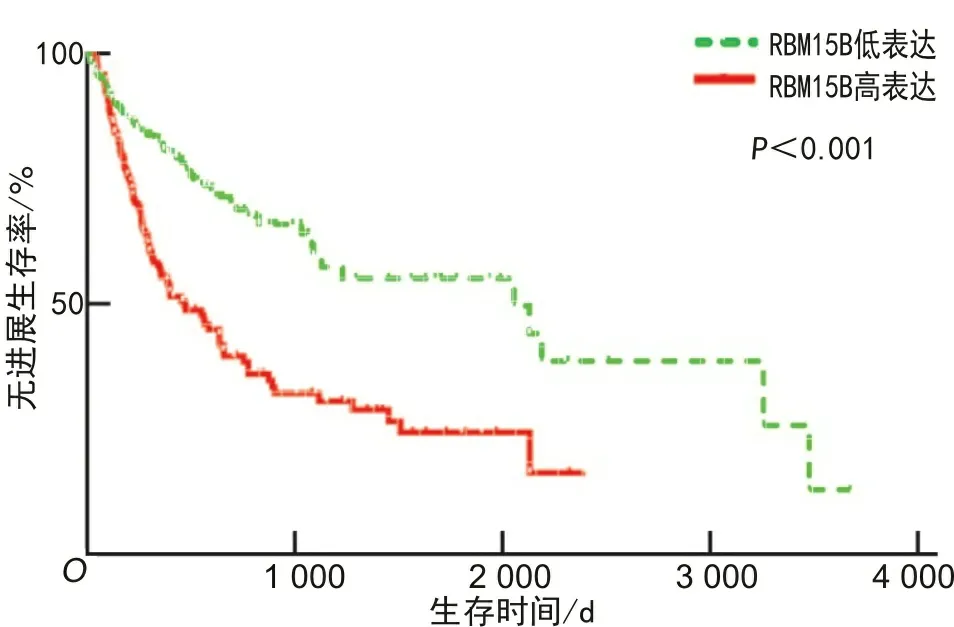
图3 RBM15B mRNA高表达组与低表达组 无进展生存期(PFS)比较

图4 TNM 1~2组与TNM 3~4组RAM15B mRNA 表达水平比较

表1 HCC及癌旁正常组织中RBM15B蛋白表达水平比较

左侧为癌旁正常组织,右侧为HCC组织。
3 讨论
DNA甲基化通过甲基化转移酶将CG核苷酸胞嘧啶催化成5-甲基胞嘧啶,从而实现表观遗传调控。DNA甲基化功能失调会引起癌基因活化及抑癌基因失活,故DNA甲基化异常通常作为恶性肿瘤的特征之一[8-9]。相比于基因突变,表观调控具有可逆性,这使得DNA甲基化在恶性肿瘤中可作为潜在的治疗靶点[10]。以往有研究表明,异常的DNA甲基化与肝癌的发生、诊断、治疗和预后有着密切联系[11-12]。DLC-1(deleted in liver cancer 1)基因编码肿瘤抑制因子,而DNA甲基化常导致肝癌中DLC-1基因缺失。DNA甲基化还会干扰多种重要基因的表达,包括多肿瘤抑制因子1、RAS关联域家族1A、细胞因子信号抑制因子1和人类Runt相关转录因子3,上述基因的异常共同导致了肝癌的发生[13]。此外,BMP4(bone morphogenetic protein 4)作为甲基化的生物标志物,已被用于预测肝癌切除术后的复发和转移[14]。上述研究均表明异常的DNA甲基化在促进肝癌的发生发展过程中发挥了协调作用,同时DNA甲基化生物标志物也可能成为肝癌诊断和治疗的靶点。
为进一步提高肝癌的早期诊断率与治疗率,研究人员一直在探寻理想的肿瘤标志物。基因表达差异分析法被用来寻找肿瘤标志物时间已久,但联合DNA甲基化分析探寻肿瘤标志物相关研究却很少。本研究结合基因表达与DNA甲基化数据,进行联合分析,筛选出可能作为肝癌肿瘤标志物的RBM15B。RBM15B最初被鉴定为爱泼斯坦-巴尔病毒(Epstein-Barr virus)mRNA输出因子的结合伴侣[7,15],曾被报道经常伴随婴儿急性巨核细胞白血病基因分型t(1;22)(p13;q13)的5’易位[16],RNA干扰降低RBM15B表达水平后可抑制慢性髓系白血病细胞的生长和增殖,阻断细胞周期,诱导细胞程序性死亡,RBM15B的表达水平对慢性髓系白血病细胞的存活起着关键作用[17]。RBM15B也曾被报道参与多种实体瘤的演化过程,比如Zhang等[18]通过下一代高通量测序在原发性上皮性卵巢癌组织中发现RBM15B至少存在2个突变了的可能的致癌位点,Shahriyari等[19]发现与RBM15B的表达呈高度正相关的BPA1(BRCA1 associated protein-1)是葡萄膜黑色素瘤和乳腺癌的预后基因,另外,RBM15B还与恶性间皮瘤、肾透明细胞癌的风险增加有关[20-21]。为进一步探究RBM15B与肝癌的关系,本研究从多个数据库收集数据分析了RBM15B在癌与癌旁组织、不同TNM分期患者中的表达情况,并从mRNA层面证实了RBM15B的表达量在HCC中升高,且具有预后评估价值,最后通过组织芯片技术在蛋白层面分析RBM15B的表达,再次验证RBM15B在肝癌组织中高表达。
综上所述,RBM15B很可能参与并促进肝癌的发生发展,且具有一定的预后评估价值,是肝癌潜在的预测指标和精准治疗靶点。

