重组人谬勒管抑制素/抗谬勒管激素国际参考试剂协作研究
于 婷,孙 楠,孙 晶,杨 振,黄 杰
中国食品药品检定研究院体外诊断试剂所,北京 100050
谬勒管抑制素也称抗谬勒管激素(AMH),因其可引起雄性胎儿的苗勒管退化而得名,是一种由男性睾丸支持细胞和女性卵泡颗粒细胞分泌的二聚体糖蛋白,在胚胎的性别分化中参与早期性器官定向分化[1-2]。AMH可抑制女性卵泡细胞的生长,调节男性睾丸间质细胞的功能。血清中AMH水平可用于评估卵巢储备功能,辅助诊治相关疾病如卵巢功能早衰、性别发育异常等[3-5],临床上主要用于辅助生殖技术等[6-8]。
世界卫生组织(WHO)生物标准化专家委员会在2015年已认识到有必要制定AMH的国际标准(IS),用于校准人血清和血浆中AMH免疫分析测定。因此,英国生物制品检定所(NIBSC)采用捐赠的人重组AMH,制备了编号为16/190的AMH国际标准品候选品。并在2018年开展了协作标定,目标是:(1)用各自方法校准的不同免疫分析方法测定16/190中AMH水平;(2)评价16/190用于AMH免疫分析校准的适用性;(3)评价16/190经热加速降解后的稳定性。中国食品药品检定研究院非传染病诊断试剂室代表中国实验室应邀参加了本次国际协作标定研究,全球共有4个国家7个实验室参加,现报道如下。
1 材料与方法
1.1材料来源 AMH国际候选品:编号分别为16/190、A、C、D~H,为编号不同的同一标本,0.5 mL溶液冻干后残余物,内容物包括1.2 mg牛酪蛋白,2.5 mg海藻糖和理论上500 ng重组人AMH。编号为16/190的安瓿标本,为预实验用标本,目的是先确认各试剂对其的反应性,以便在正式实验前可以找到合适的线性范围。编号A和C的安瓿标本,为正常保存状态标本,互为复管,平行测定用。D~H为热加速标本,分别保存于4、45、37、20和-20 ℃条件下21个月13天。
AMH国际候选品的比较标本:编号为B,内容物约为候选品的50%。
17份人血清标本(编号为AMHSerum1~AMHSerum17):每份0.6~0.8 mL,经酶联免疫吸附试验(ELISA)法确定AMH水平在0.9~17.0 ng/mL范围内。5份编号为AMHPlasma18~AMHPlasma22人血浆标本,每份标本为0.6~0.8 mL,经ELISA确定AMH水平在<0.1~12.0 ng/mL范围内。4份标本浓度超过10 ng/mL。这些标本编号分别为:5、9、16和22。因此,线性范围≤10 ng/mL的试剂盒在检测前应采用标本稀释液进行1∶1稀释。血清/血浆样品来自英国First Link公司、英国TCS生物科学公司或法国CERBA标本公司。一些标本为绝经后人血清稀释得到。来自英国First Link公司和美国TCS生物科学公司的血样已检测HIV 1和2、HIV p24、HBsAg、抗-HCV和梅毒螺旋体抗体,结果均为阴性。来自法国CERBA标本公司的标本为临床剩余标本,经NIBSC检测,HBsAg、HIV抗体和HCV RNA均为阴性。
NIBSC根据各实验室的分析能力和可提供的标本数量分配标本。本实验室得到的标本为:16/190(A、B、C)、17份血清标本和5份血浆标本。
1.2仪器与试剂 本次国际协作标定用的试剂盒,包括10种化学发光法(含电化学发光、磁微粒化学发光等)、两种酶联免疫法(含酶联免疫荧光法)和1种免疫荧光层析法试剂盒,共计13种,分别是:抗缪勒氏管激素测定试剂盒(化学发光法)、抗缪勒氏管激素测定试剂盒(免疫荧光层析法)和抗缪勒氏管激素测定试剂盒(酶联免疫法),以上3种均由深圳市亚辉龙生物科技股份有限公司提供;AMH检测试剂盒(磁微粒化学发光法),泰州泽成生物技术有限公司;AMH测定试剂盒(化学发光免疫分析法),深圳迈瑞生物医疗电子股份有限公司;AMH测定试剂盒(酶联免疫荧光法),梅里埃诊断产品(上海)有限公司;AMH检测试剂盒(电化学发光法),罗氏诊断产品(上海)有限公司;AMH测定试剂盒(化学发光法),贝克曼库尔特商贸(中国)有限公司;AMH检测试剂盒(磁微粒化学发光法),郑州安图生物工程股份有限公司;AMH测定试剂盒(化学发光免疫分析法),广州市达瑞生物技术股份有限公司;AMH测定试剂盒(化学发光免疫分析法),深圳市新产业生物医学工程股份有限公司;AMH测定试剂盒(化学发光免疫分析法),上海透景生命科技股份有限公司;AMH测定试剂盒(磁微粒化学发光法),北京利德曼生化股份有限公司。
1.3WHO研究方案 实验设计:(1)收样后,应放置于-20 ℃或以下保存;(2)AMH候选品各编号标本及B标本,使用前均应平衡至室温,以减少水分吸收;血清标本使用前应恢复至室温,等其内容物彻底融化,并应充分轻柔混匀;血浆标本使用前应在37 ℃水浴中放置6 min融化,1 500 r/min(250×g)离心10 min,取上清备用;(3)AMH候选品各编号标本及B标本均采用1.0 mL去离子水充分溶解得到储备液,进一步的配制应选择适当的缓冲液进行。缓冲液应含有一定量的蛋白以防止表面吸附,通常为0.1%(w/v)牛血清清蛋白或0.1%(w/v)人血清清蛋白。如果在后续的分析中不能使用新鲜开封的AMH国际标准品或候选品,建议将储备液分装,并置于-20 ℃及以下保存;(4)为更好地比较不同免疫学分析方法,需要所有参加实验室在各自试剂盒的线性范围内,且配制AMH候选品各编号标本及B标本的浓度应尽量保持一致(16.000、8.000、4.000、2.000、1.000、0.500、0.250和0.125 ng/mL),如线性范围不能满足要求,则应至少包含上述中的5种浓度,每种浓度标本至少3次重复(采用96孔板检测的试剂可仅重复两次);(5)每种方法至少进行两次独立分析,每次分析均应包含分配的所有样品、稀释液及试剂盒校准品。
1.4方法 本次国际协作标定严格按照WHO的要求进行。按照各试剂盒说明书进行检测分析。
预实验:仅分析16/190,先确认各试剂对其的反应性,以便在正式实验前找到合适的线性范围。正式实验中检测A、B、C、17份血清标本和5份血浆标本。
标本复溶与系列溶液配制:16/190、A、B和C均采用1 mL去离子水充分溶解,16/190、A和C均得到500 ng/mL的储备液,B得到约250 ng/mL的储备液。进一步稀释采用各试剂盒专用稀释液,在各试剂盒的线性范围内,按照要求进行配制。血清和血浆按照WHO方案进行处理。
剂量-反应曲线的建立:预实验中,仅包括16/190及试剂盒校准品2条剂量-反应曲线;正式实验中,包括A、B、C及试剂盒校准品各1条剂量-反应曲线。每条曲线含7~8种浓度,每种浓度及稀释液重复测定2~3次。
1.5统计学处理 以参加实验室上报的AMH浓度进行分析。为确定是否具有可接受的稀释线性,每个独立实验中,如果log10(测定浓度)与log10(理论浓度)的拟合回归线性的斜率在0.91~1.10内,且r2>0.975,实验有效。此外,只有当2个重复标本(A、C)测定值的比值在0.91~1.10范围内,独立实验结果有效。对所有有效结果采用稀释因子校正后,得到各实验室的未加权几何均值(GM),合并这些结果计算整体未加权GM。实验室间变异采用GM均数变异系数(GCV)表示[GCV=(10s-1)×100%,s是log10转换值的标准差]。由于可能出现离群值和异常结果,同时采用了R的package“WRS2”计算稳健均值。
2 结 果
2.1候选品结果 按照WHO方案中的数据处理原则,以各试剂盒校准品曲线计算得到的16/190浓度,结果见表1。本实验室提交的13套数据中,按照WHO的数据处理原则,方法1、4、10和11不满足拟合回归线性斜率在0.90~1.11内,方法3不满足A与C的比值在0.91~1.10内,最终有效数据8套。将无效数据剔除后进行汇总分析,A和C结果合并后得到,浓度GM为448 ng·安瓿-1(95%CI:377~531 ng·安瓿-1,n=8,GCV=23%),WHO的结果为511 ng·安瓿-1(95%CI:426~612 ng·安瓿-1,n=16,GCV=42%),本实验室测定值与WHO测定值的相对偏差为-12%。B的结果为浓度几何均值为246 ng·安瓿-1(95%CI:196~310 ng·安瓿-1,n=8,GCV=32%),WHO结果为269 ng·安瓿-1(95%CI:221~328 ng·安瓿-1,n=16,GCV=45%),本实验室测定值与WHO测定值的相对偏差为-7.8%。B的预期浓度约为A或C的一半,本实验室得到的比值为0.55(95%CI:0.50~0.61,n=8,GCV=13%),实际结果与预期结果基本一致,表明在一种方法中,对AMH的识别是一致的。WHO结果为0.53(95%CI:0.50~0.56,n=16,GCV=12%),本实验室测定值与WHO测定值的相对偏差为3.8%。
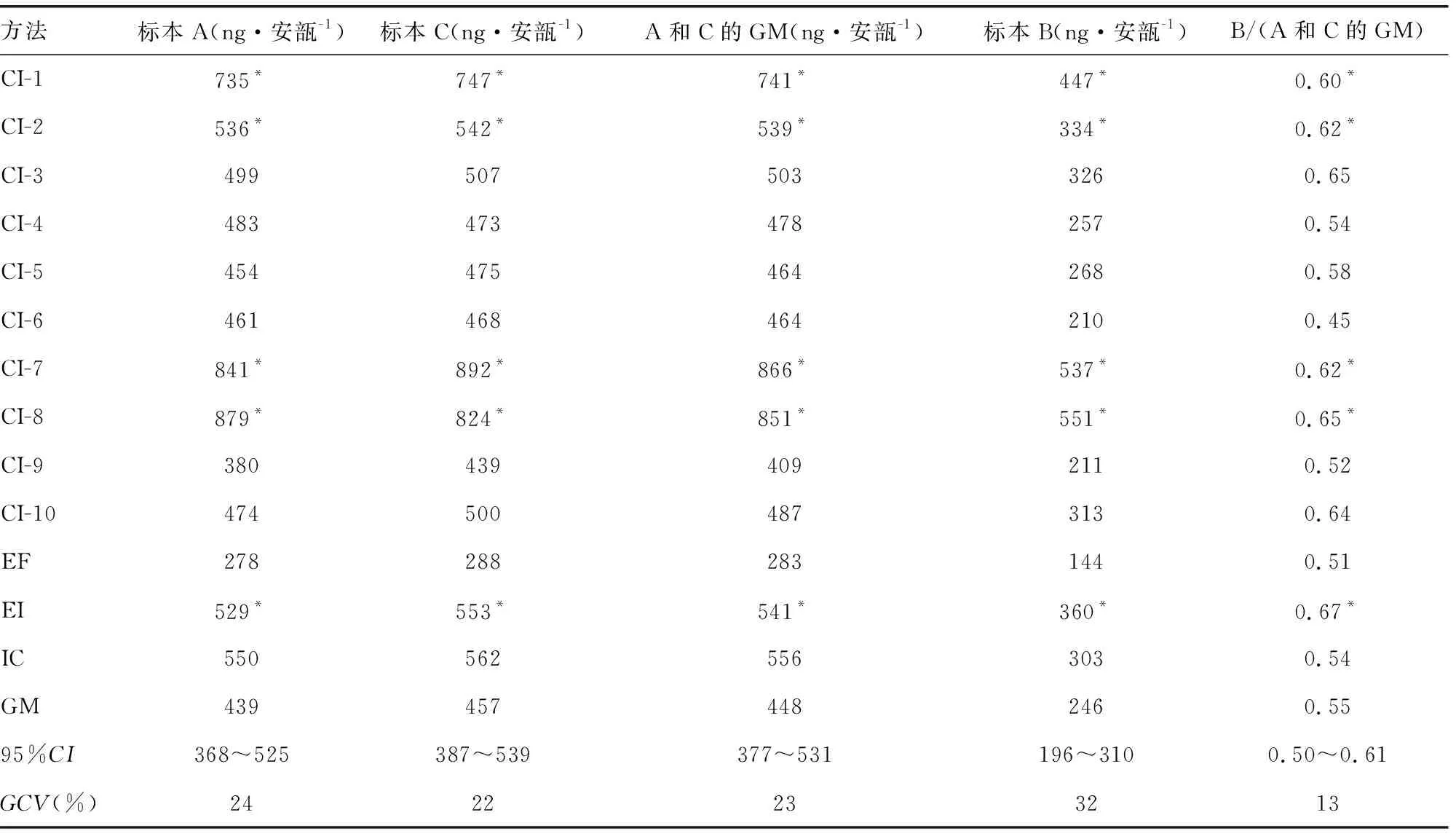
表1 安瓿A、B、C中AMH浓度、A和C的GM及B/(A和C的GM)
2.2血清及血浆标本结果 NIBSC共提供17份血清标本及5份血浆标本,本实验室结果见表2。本实验室共提交13套数据,每套数据中两组平行测定结果。其中1套数据与其他结果差异较大,经统计分析后剔除。
从结果可以看出,除低值标本(AMHPlasma18)外,其他21份血清或血浆标本,各家测值差异整体来说比候选品的差异稍小,但均超过10.0%,CV在12.3%~28.9%内,GCV均值为17.4%(95%CI:15.7%~19.2%)。因18号血浆标本浓度接近零值,22号标本浓度超出多家检测试剂盒线性范围,WHO总结数据中,剔除这两个标本的结果。本实验室测定值与WHO测定值的相对偏差在-7.3%~11.5%内。
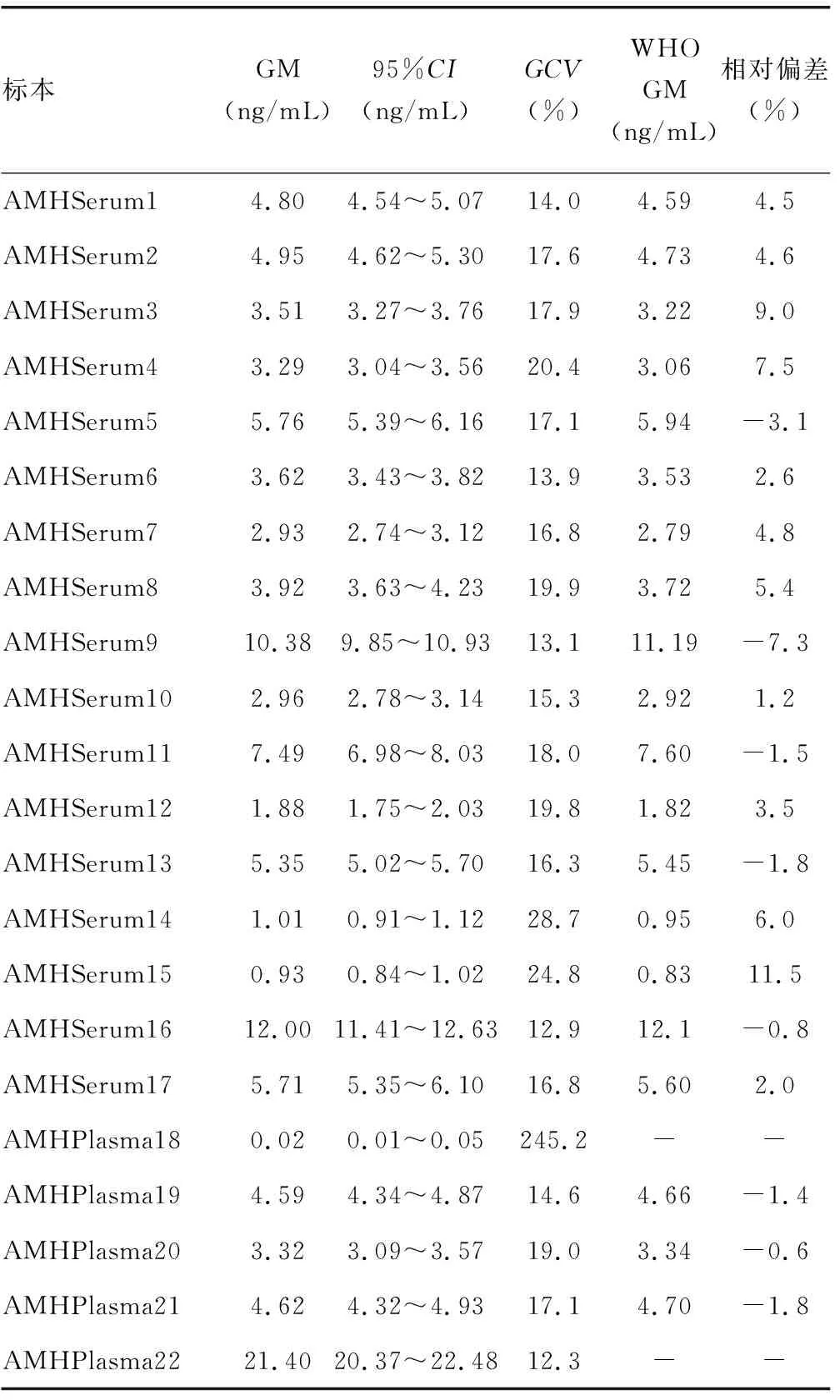
表2 AMH血清及血浆标本的GM及与WHO测定结果的比较
最终,4个国家7个实验室共同完成了本次协作标定。本实验室提供了13套检测数据,占总提交数据(21套)的61.9%,其中8套数据被WHO采纳,占全部有效数据(16套)的50.0%。经WHO统计汇总分析,16/190的浓度GM为511 ng·安瓿-1(95%CI:426~612 ng·安瓿-1,n=16,GCV=42%),稳健均值为489 ng·安瓿-1,且稳定性均满足要求。但因16/190与患者标本在多个方法中不具互换性,经NIBSC提议,WHO生物标准专家委员会审核批准,16/190为AMH第1次国际参考试剂,浓度为489 ng·安瓿-1。
3 讨 论
AMH分子由两个通过二硫键连接的相同糖基化亚基组成,每个亚基都可裂解形成N-端和C-端二硫键合的二聚体,二聚体保持非共价结合。有报道称,可以从血清中分离出裂解和未裂解的AMH[9]。目前临床上使用的免疫分析中,所使用的抗体识别的多是总AMH。
候选品原料来自美国马萨诸塞州总医院儿科外科研究实验室捐赠给NIBSC的重组AMH,从稳定CHO细胞株LR-MIS的培养基中纯化得到。该重组AMH表达来自人血清清蛋白(HSA)具有前导序列的人AMH序列,在氨基酸423-428的内部裂解位点有修饰,从RAQR/S转变成RARR/S[10],HSA前导序列在成熟过程中被裂解。NIBSC在2016年以该原料制备了编号为16/190的AMH国际候选标准品。目前的AMH免疫分析结果以质量单位(ng/mL)或摩尔单位(pmol)为单位,使用转换因子1 ng/mL=7.14 pmol/L,这是基于聚丙烯酰胺凝胶电泳测定的糖基化二聚体的表观分子量[11-12]。但AMH质量单位的可追溯性并不清楚,所以尚未建立AMH参考方法。
本次AMH国际协作标定共有4个国家7个实验室参加,采用了21种方法。本实验室采用了13种方法,10家国产试剂和3家进口试剂,基本涵盖在我国开展AMH检测的所有原理的试剂盒,其中以化学发光法检测试剂盒为主,这是目前的主流方法,也是国际上的主流方法,以上结果表明本研究数据具有非常好的代表性,本实验室的结果为WHO评价16/190作为第1次AMH国际参考试剂提供了丰富、可靠的数据。
由于目前AMH检测无参考方法,亦无上一代国际标准品,所以NIBSC采用了各AMH试剂盒直接测定值进行联合定值,以全部结果的稳健均值作为最终结果。在剔除不满足要求的数据后,本实验室得到的结果为:448 ng·安瓿-1(95%CI:377~531,n=8,GCV=23%),16/190实测值的最低值仅为283 ng·安瓿-1,最高值达到556 ng·安瓿-1,最低值与最高值之间相对偏差达到49%。而在WHO报告中,全部实验室AMH国际候选标准品的免疫效价汇总结果在282~1 157 ng·安瓿-1内,GCV达到42%。这些结果表明了目前各AMH检测试剂盒之间测定结果的一致化程度并不是很好。其原因可能因为重组AMH和天然AMH在分子构成、构型等方面存在差异,而且各家包被的抗体来源不一定相同,识别AMH抗原位点不一致,均可导致抗原抗体间反应性不一致;另一方面,缓冲体系与真实标本血清基质存在差异,即基质效应也可造成测值结果不一致等;此外,还与各测定原理和技术的不同、数据处理的曲线拟合方式差异有关等。
除定值结果不理想外,WHO提供的互换性实验结果显示,仅6种方法中的16/190和标本具有互换性,3种方法具有部分互换性,7种方法无互换性。以上结果表明,如果将16/190定为国际标准品,既无溯源依据支持,亦无实际数据支持,实际应用中必然存在一定争议。鉴于上述因素,NIBSC不建议将16/190作为人重组AMH的国际标准品,但是为了进一步促进AMH校准和免疫学分析,他们向WHO推荐16/190作为参考试剂,并且在说明书中明确说明赋值采用的是当前的免疫分析法,笔者亦认为这种做法是合理的。在未来可尝试以人血清为基质建立AMH参考盘,或者采用提取的人源性AMH制备国际标准品,以协调AMH免疫分析方法之间的差异,促进AMH免疫分析的标准化。

