甘氨酸降低复合菌快速发酵虾酱中的组胺含量
于靖,杨锡洪,2,谢静雯,卢宽,解万翠,2,3,4
(1.青岛科技大学海洋科学与生物工程学院,山东青岛 266042)(2.山东省生物化学工程重点实验室,山东青岛266042)(3.青岛智科检验检测有限公司,山东青岛 266002)(4.青岛信和源生物科技有限公司,山东青岛 266002)
虾酱(shrimp paste)是中国沿海地区以及马来西亚、新加坡、泰国等东南亚国家常见的海鲜调味品[1],以毛虾、蜢子虾等小型虾类及虾产品加工下脚料为原料,经虾体和细菌中蛋白酶对原料蛋白的水解,释放出氨基酸和肽,从而赋于产品特定的鲜美风味[2]。因其营养丰富,含蛋白质、维生素及DHA、EPA 等具有调节血脂、免疫及补脑健脑功能的不饱和脂肪酸[3],深受消费者喜爱。然而虾酱作为一种天然发酵产品,其发酵周期长,微生物区系复杂多变,发酵过程受多种因素影响,品质不稳定,可能存在一定的安全性问题[3]。
生物胺(Biogenic amine,BAs)是一类低分子含氮有机化合物[4],广泛存在于蛋白含量丰富的发酵水产品中,是致癌性亚硝胺的前体物质,主要包括腐胺、酪胺、色胺、尸胺、组胺、苯乙胺、精胺和亚精胺等。其中组胺对人类健康影响最大[5],通过与细胞膜上的受体作用发挥毒性,易造成低血压、头痛、呕吐和腹泻等不适症状,甚至导致人体神经系统和心血管系统损伤[6]。虾酱发酵过程中虾体原料经产蛋白酶菌作用被降解为氨基酸后,在微生物代谢产生的氨基酸脱羧酶作用下发生脱羧反应,因而产生相对大量的生物胺,严重影响虾酱产品的食用安全性[7],给消费者带来健康风险。因此,在保持虾酱传统风味的同时寻求有效的降组胺方法对于提高发酵食品安全性及产品质量具有一定的现实意义。
食品添加剂,如盐、酸化剂和甜味剂等已被报道,用以抑制或刺激生物胺的形成,国内外学者在研究海鲜调味品快速发酵工艺优化时发现[8,9],外源氨基酸对海鲜发酵调味品的安全性及风味具有良好的促进作用,Jae-Hyung Mah[10]等经研究腌制凤尾鱼发现,甘氨酸是体外抑制微生物产胺活性最有效的食品添加剂,添加5%甘氨酸能使发酵凤尾鱼中组胺含量降低86%,并且甘氨酸对生物胺产生的抑制作用可能与其浓度成正比。
本课题组前期经定向分离、筛选发酵菌种,在外加微生物法快速发酵虾酱的基础上,添加不同含量甘氨酸,研究其对快速发酵虾酱中组胺的抑制作用,综合菌落总数判断虾酱产品安全性,同时进行感官评价及电子鼻检测,对挥发性盐基氮(TVB-N)和氨基酸态氮(AA-N)等理化指标进行分析,探讨甘氨酸对快速发酵虾头酱组胺含量和风味品质影响。
1 材料与方法
1.1 材料与试剂
虾头:新鲜凡纳滨对虾虾头(Litopenaeus vannamei),湛江国联水产开发股份有限公司;发酵菌种:季氏毕赤氏酵母(Pichia gilliermondii)、黑曲霉(Aspergillus niger)、植物乳杆菌(Lactobacillus planticola),实验室前期分离自广东传统虾酱;磷酸组胺:生物试剂(≥98.0),南京奥多福尼生物科技有限公司;甘氨酸:生物试剂,天津市福晨化学试剂厂;氢氧化钠:优级纯,天津广成化学试剂有限公司;平板计数琼脂(PCA)培养基:生物试剂,西陇化工股份有限公司;三氯乙酸:分析纯,上海凌峰化学试剂有限公司。
1.2 仪器与设备
可见分光光度计(V-5000),上海元析仪器有限公司;立式蒸汽灭菌器(LDZX-30KBS),上海申安医疗器械厂;pH 计(PHS-3C),上海仪电科学仪器股份有限公司;净化工作台(SW-CJ-270),上海博讯实业有限公司医疗设备厂;恒温培养箱(SPX-250B-Z),上海博讯实业有限公司医疗设备厂;电子鼻分析系统:北京盈盛恒泰科技有限责任公司。
1.3 实验方法
1.3.1 虾酱快速发酵工艺
快速发酵工艺流程如图1 所示,新鲜虾头洗净沥水、减去毛须后称重,巴氏灭菌法(75 ℃,30 min)低温灭菌,虾头打浆后置于发酵罐(500 g),加入虾头重量18%的食盐,接入复合发酵剂(季氏毕赤氏酵母:黑曲霉:植物乳杆菌=1:3:5),同时添加2%、4%和6%的甘氨酸,在37 ℃下恒温发酵20 d,每48 h 搅拌样品并取样保存于-20 ℃冰箱待测。
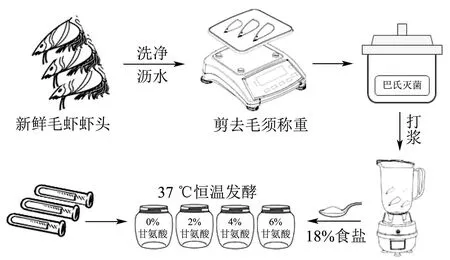
图1 虾头酱快速发酵流程Fig.1 Rapid fermentation process for shrimp head sauce

表1 虾酱感官评分标准Table 1 Standards for sensory evaluation of shrimp paste
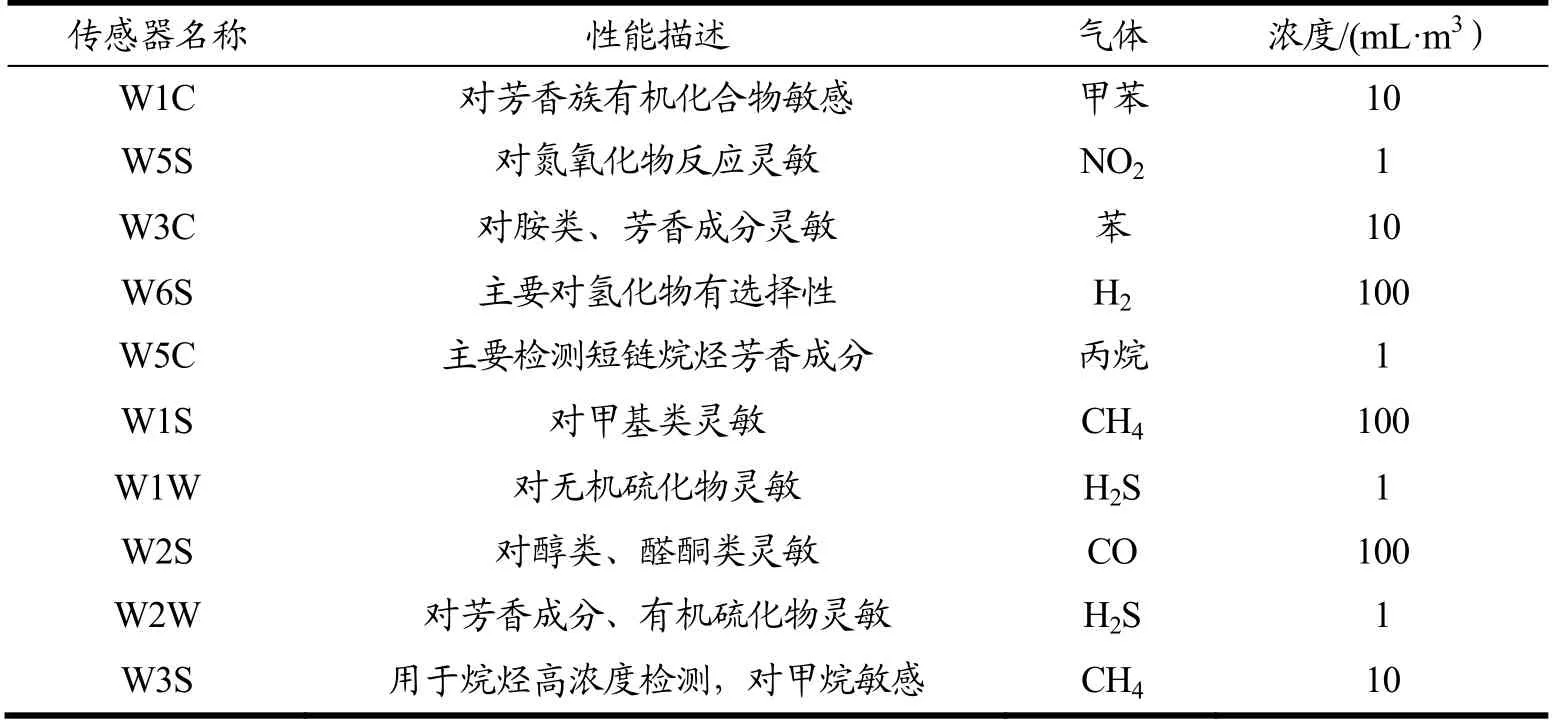
表2 电子鼻传感器性能描述Table 2 Performance of six sensors for electronic nose
1.3.2 理化指标检测及菌落总数测定
pH 测 定: 参 考 GB 5009.237-2016 以 及Techaratanakrai[11]的方法:将10.0 g 样品用新煮沸冷却的超纯水定容至100 mL,静置30 min,6000 r/min 均质2 min,过滤后采用酸度计测定。TVB-N 含量检测:参考《GB 5009.228-2016 食品安全国家标准 食品中挥发性盐基氮的测定》进行检测;氨基态氮含量:参考《GB 5009.235-2016 食品安全国家标准 食品中氨基酸态氮的测定》进行含量分析;菌落总数:根据《GB 4789.2-2016 食品安全国家标准 食品微生物学检验菌落总数测定》进行测定。
1.3.3 组胺含量测定
5.0 g虾酱样品与20 mL 10%的三氯乙酸于具塞三角瓶中摇匀,55 ℃超声20 min,间隔5 min 震荡,过滤后残渣用10 mL 的蒸馏水冲洗3 次,合并滤液,氢氧化钠溶液(250 g/L)调pH 至5.00±0.02,定容至100 mL。根据赵宇明的方法[12]取样测定。(标准曲线:y=0.01719x+0.01729,R2=0.99934)
1.3.4 感官评价
在感官评价过程中,由于品尝结果受主观因素(如年龄、生活经历、文化背景、地理区域、感觉差异等)影响较大[13],结果缺乏足够的科学性。本文采用描述性定量分析法(quantitative descriptiveanalysis,QDA)[14]对发酵成熟的虾酱进行感官评价。感官评定小组由9 名已进行感官培训后的成员组成,评估过程在感评室中进行,尽可能保持环境条件不变,同时为各位成员提供矿泉水,以消除不同样品之间的味觉干扰[15]。每位成员对样品的风味特征(虾味、发酵味、咸味、鲜味、腥味、苦涩味、氨气味以及体态等方面)进行评分,评分标准见表1。评分包括0~9 分,总计10 个分数,“0”表示没感受到该风味,“9”则表示此风味浓郁,综合得分=滋味均分×0.4+香气均分×0.6。
1.3.5 电子鼻分析
使用电子鼻系统(PEN3,Airsense Analytics GmbH,德国)检测不同甘氨酸含量虾酱中挥发性化合物。准确称量2.0 g 样品于10 mL 样品瓶中密封,室温稳定30 min,收集延迟时间为300 s,数据采集时间150 s,进气速度0.3 L/min,平行测定3 次。传感器阵列对应物质如表2 所示,由W1C、W5S、W3C、W6S、W5C、W1S、W1W、W2S、W2W、W3S 10个传感器组成。根据电子鼻的响应强度,考察虾酱样品中挥发性物质变化,仪器控制采用Winmuster 软件。
1.4 数据统计与分析
本文感官评价的QDA 图及其他数据通过origin 9.0 分析,显著性通过SPSS 21.0 进行分析。
2 结果与分析
2.1 甘氨酸对发酵过程TVB-N 含量的影响
TVB-N 是衡量水产调味品原料新鲜度和腐败变质程度的重要指标[16]。在虾酱发酵过程中,TVB-N 含量与腐败微生物的活性呈正相关,是虾肉腐败臭味的主要来源,能够直接反映虾酱品质。图2 为添加不同浓度甘氨酸对虾酱发酵过程中TVB-N 含量影响。
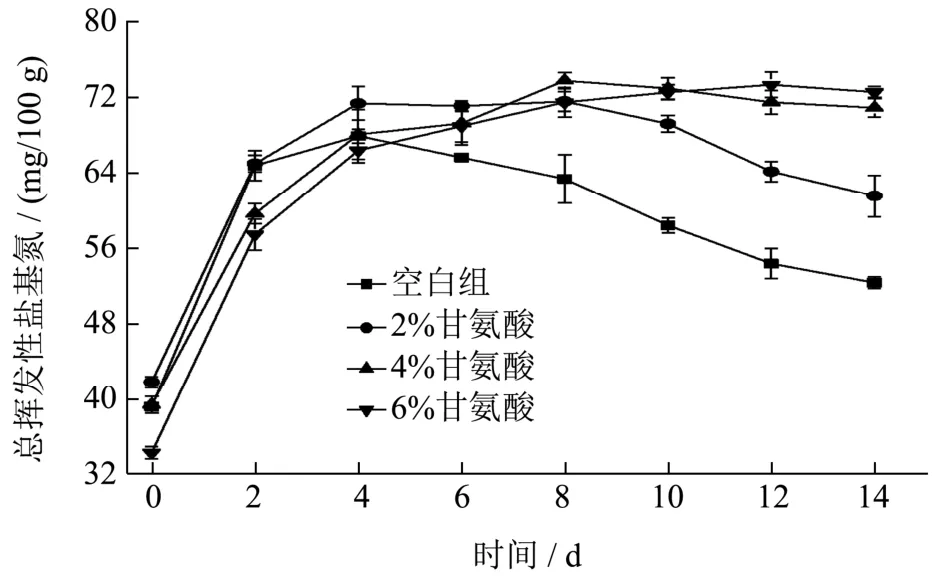
图2 TVB-N 的含量曲线Fig.2 Change curve of TVB-N content
由于微生物在初期大量繁殖并迅速进入对数生长期,腐败微生物未被有效抑制,虾头酱中的蛋白质在内源酶作用下被迅速分解为氨基酸,经脱羧或脱氨反应生成挥发性的胺类及氨气等碱性含氮物质,导致0~2 d 中TVB-N 含量急剧上升。2~4 d 上升速度减慢,到4 d 时,TVB-N 含量基本达到最高。由于微生物和酶受体系中高温高盐环境影响,其活性降低,且一部分TVB-N 在发酵过程中挥发[17],导致4~14 d 发酵中后期的含量呈平稳下降趋势。如图2 所示,甘氨酸的添加未改变TVB-N 的总体变化趋势,但促进了其在发酵中后期的生成,与对照组相比,添加了2%、4%和6%甘氨酸的样品在发酵成熟后TVB-N 分别增加了17.58%、33.34%和36.67%,这种变化可能是由于外源甘氨酸经脱羧及脱氨反应产生了更多的挥发性胺类等碱性含氮物质[18]。虽然外源甘氨酸的添加使TVB-N含量有所增加,但其仍远远低于SB/T 10525-2009 中450 mg/100 g 的限量标准,与吴小禾[19]等检测成品黄骅虾酱所测得TVB-N 最高值401 mg/100 g 相比,本实验产品具有一定的安全保障。
2.2 甘氨酸对虾头酱发酵过程AA-N含量的影响
氨基态氮(AA-N)是以氨基酸形式存在的氮元素的量,是判定鱼露、酱油、虾酱等发酵产品发酵程度的首要特性指标[20],该指标越高,说明虾酱中的氨基酸含量越高,发酵效果越佳,鲜味物质越丰富。图3为加入不同浓度甘氨酸后虾头酱中AA-N含量变化。
甘氨酸作为一种甜味氨基酸,添加后使得虾酱中AA-N 的含量大大增加。比较图3 虾头酱中不同甘氨酸添加量的AA-N 曲线走势可知,在发酵初期各组虾酱AA-N 含量增长迅速,这种增长是由于原料虾头中的蛋白被内源酶和发酵剂产生的蛋白酶降解,使其分解成了氨基酸以及小分子肽等生香成分[21]。宋中辉等[22]在优化香辣虾酱配方时也发现,发酵初期氨基酸态氮增长较快,是由于发酵环境有利于微生物参与发酵过程。随发酵时间的延长,高温高盐环境下抑制了大部分微生物的活性,引起酶分泌量和酶活力的降低,并且虾头酱中可以被水解的肽键含量也随之减少[23],导致AA-N 含量上升趋势减慢,含量逐渐达到平稳。
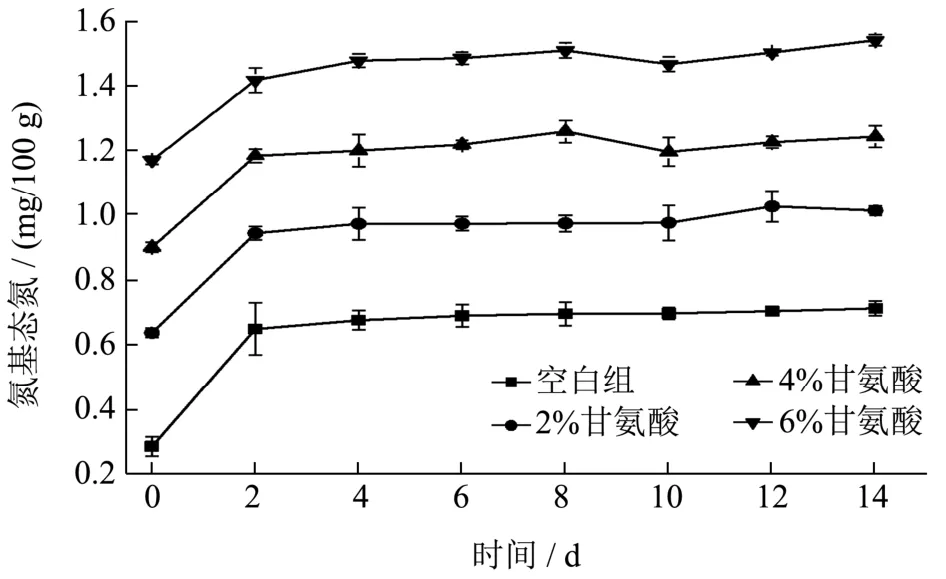
图3 甘氨酸对虾头酱发酵过程AA-N 含量的影响Fig.3 Effect of glycine on AA-N content in fermented shrimp head sauce
2.3 甘氨酸对虾头酱发酵过程pH 变化的影响
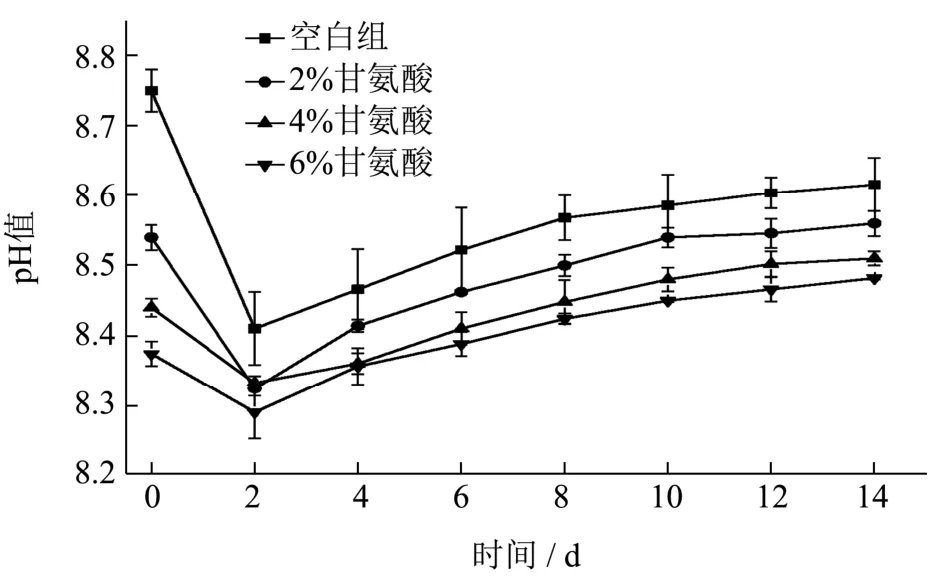
图4 甘氨酸对虾头酱发酵过程pH 的变化影响Fig.4 Effect of glycine on the change of pH of fermented shrimp head sauce
pH 反映虾酱酸碱性以及新鲜度,不仅影响发酵微生物的生长繁殖及发酵程度,也影响其代谢活力和代谢方向,是影响组胺产生的重要环境因素[24],Baranowski 等[25]发现,pH 的升高能大大降低产组胺微生物的活性及产酶能力,分离自金枪鱼体内的菌株在pH=4 时将组氨酸转化为组胺的能力最强,而当pH=6 时它的活力降低了30%。向虾头酱中添加不同含量甘氨酸后,其发酵过程中pH 值变化如图4 所示。
陈丽丽等[26]以草鱼和鳗鱼内脏为原料进行鱼露发酵时发现,发酵前期发酵液中进行的生化反应最为剧烈,因而pH 值变化最为明显。图4 中0~2 d 虾头酱pH 在8.20~8.80 之间急剧下降,在发酵第2 d降至最低点,其后又缓慢上升。发酵初期pH 降低是由于在此阶段产酸微生物比较活跃,发酵剂通过糖酵解将原料中的碳水化合物快速分解为磷酸、乳酸等酸性代谢物质[27]。随着发酵过程的进行,高温高盐环境导致微生物活性减弱,产酸速率下降,并且会有少量原料蛋白水解产生的氨基酸及含羰基端的多肽等物质转化成碱性的挥发性盐基氮,使得虾头酱pH 在发酵过程中呈上升趋势。由于甘氨酸的等电点pH 为5.97,偏酸性,使得甘氨酸添加组虾酱pH 值低于空白组,且随甘氨酸浓度的增加,pH 偏离空白值程度增大。由于在发酵体系中,呈味核苷酸的稳定性随pH 值变化而变化,pH 值偏高会直接影响产品的质量和风味[28],而甘氨酸添加组pH 值整体低于空白组,故在一定程度上保障了产品风味品质。
2.4 添加甘氨酸对虾头酱发酵过程菌落总数的影响
菌落总数是发酵食品安全的重要监测指标,天然发酵虾酱其品质受外界环境条件影响,可能存在菌落总数超标等品质问题,而微生物菌群结构往往也对虾酱的色泽、质构、风味、安全等方面发挥关键作用[29]。
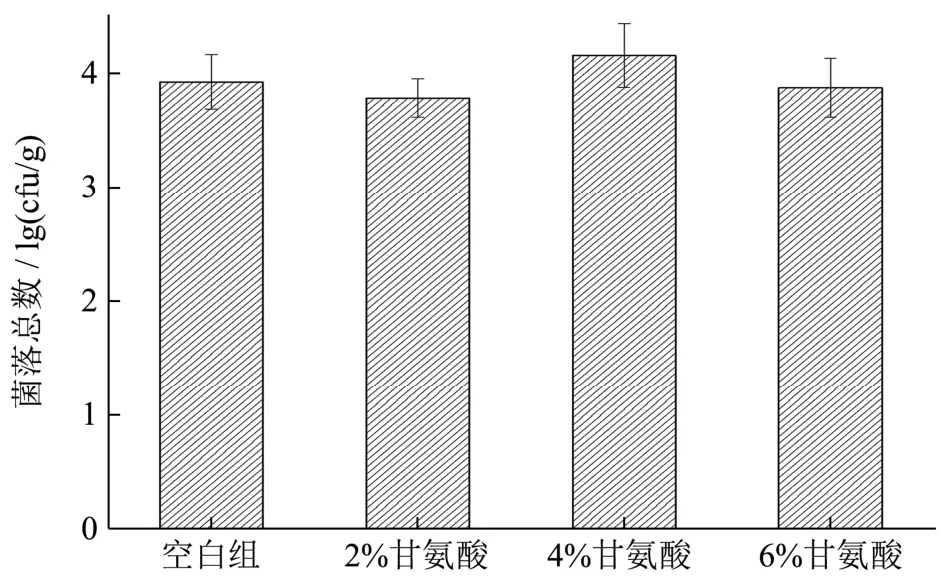
图5 甘氨酸对虾头酱菌落总数的影响Fig.5 Effect of glycine on the total number of colonies in shrimp head sauce
微生物是导致食品腐败变质的首要因素,且水产品中微生物种类繁多、数量庞大,对微生物数量进行有效控制能够减缓产品的腐败变质[30]。发酵过程中,具有氨基酸脱羧酶活性的微生物以及微生物适宜生长的环境能够极大地影响组胺的产生和积累。如图5 所示,4 组样品菌落总数维持在3.77~4.15 lg(cfu/g)之间,甘氨酸添加组与对照组在菌落总数方面没有显著差异(p>0.05)。本批次产品发酵温度为37 ℃,盐含量高达18%,发酵过程中抑制了大部分不利于发酵的微生物的繁殖代谢,各组虾头酱中菌落总数均低于李丽华等[31]由新鲜脊尾白虾制作的虾酱中最低菌落总数4.7 lg(cfu/g),确保了产品的食用安全性。
2.5 甘氨酸对发酵过程组胺含量影响
生物胺作为发酵食品中研究热点,主要包括酪胺、组胺、尸胺、腐胺四种,过量的生物胺会损害人体健康,其中组胺的毒性最大,Latorre-Moratalla 等[32-34]许多学者将组胺作为监测发酵产品安全的重要因素。图6 为添加不同含量甘氨酸的虾酱组胺变化趋势。
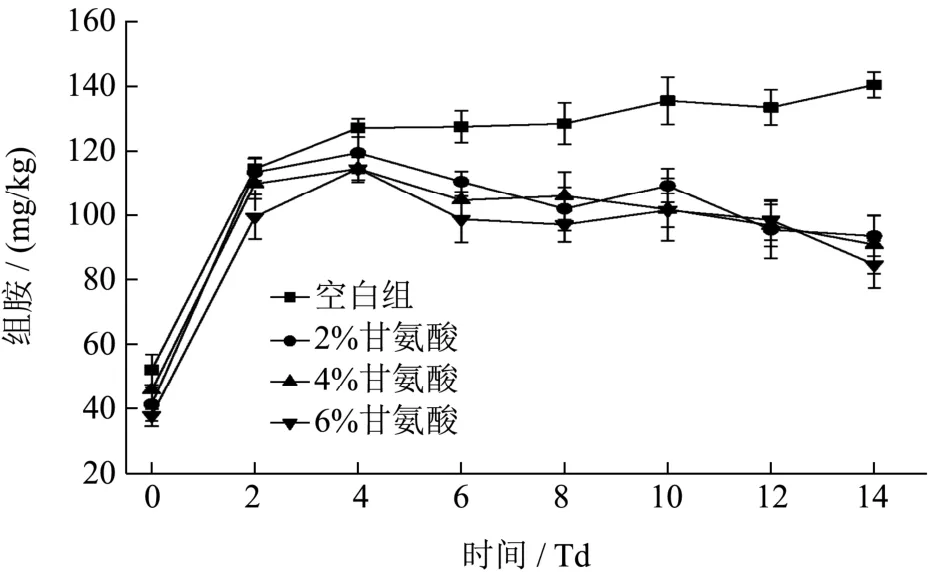
图6 不同浓度甘氨酸对组胺的影响Fig.6 Effect of glycine at different concentrations on histamine
4 组样品在发酵前2 d,组胺含量陡增,这与发酵剂中具有产组胺能力的乳酸菌以及虾头原有的产组胺微生物有关,2~4 d 组胺含量增长趋势放缓,4 d 后对照组组胺含量缓慢增加至发酵结束,组胺含量增加了1.05 倍,而甘氨酸添加组随着发酵时期的延长,组胺含量逐渐呈下降趋势,且在发酵14 d 后,组胺降低水平与甘氨酸添加量成正比,添加2%、4%、6%的甘氨酸分别能降低产品中29.53%、31.16%、34.98%的组胺。Jae-Hyung Mah[10]等采用外加甘氨酸法降低腌制凤尾鱼中生物胺含量时发现,与对照组相比,5%甘氨酸处理能使腐胺、尸胺、组胺、酪胺和亚精胺的含量降低26.7%、47.0%、86.0%、98.8%和94.4%,而10%甘氨酸组的生物胺含量分别降低了32.6%、78.4%、93.2%、100.0%和100.0%。可见,甘氨酸是一种能够明显降低生物胺含量的食品添加剂,并且其对生物胺的抑制作用与浓度成正比增加。
外源生物胺的产生主要通过游离氨基酸的脱羧作用和酮醛类物质的转胺作用两条途径(图7),而在发酵水产品中,生物胺则主要是通过微生物脱羧酶催化氨基酸的脱羧作用产生的。因而在虾酱发酵过程中,游离氨基酸、具有氨基酸脱羧酶活性的微生物以及微生物适宜生长的环境是影响组胺产生和积累的重要因素。
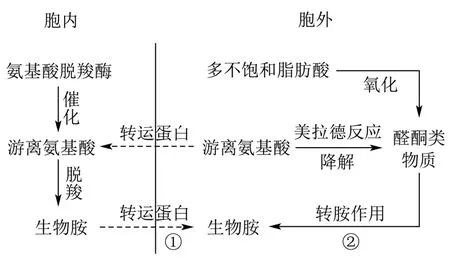
图7 生物胺产生途径Fig.7 Pathway of biogenic amine production
谢超等[35]认为水产品中游离氨基酸的种类和数量都会影响组胺酸脱羧酶的活力,进而影响组胺产生。Sato[36]等人认为食品中组胺含量的高低不仅依赖于组胺形成菌,还与组胺分解菌有关。而Jae-Hyung Mah[37]等研究发现,外源甘氨酸能够在细胞壁合成过程中通过甘氨酸和丙氨酸之间的竞争提供抗菌作用。由此推测,向虾头酱中定量添加甘氨酸,能通过抑制微生物中组氨酸脱羧酶的活性从而抑制组胺生成,并且外源甘氨酸可能与原料中其他游离氨基酸发生竞争从而抑制产组胺菌的生长,进而降低产品中组胺含量。
2.6 甘氨酸发酵虾酱感官分析
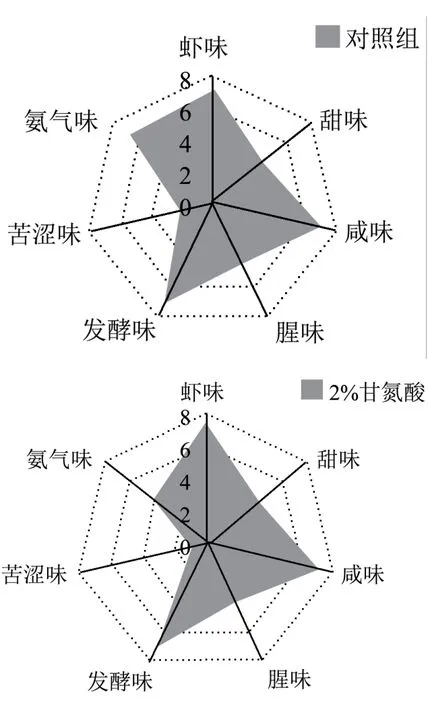
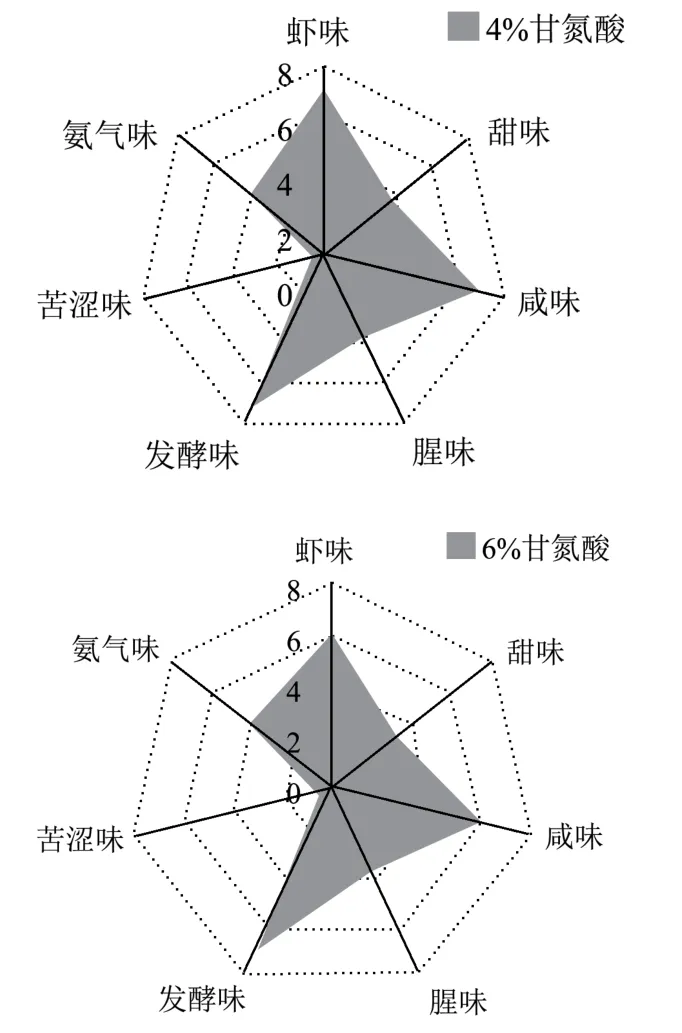
图8 添加甘氨酸对风味影响QAD 图Fig.8 Effect of glycine on flavor of shrimp head sauce
通过图8 四种添加不同浓度甘氨酸的QDA 对比图可知,对比傅润泽等[38]研究的水产品新鲜度综合评价方法发现,对于快速发酵法制得的虾头酱,在甘氨酸添加量<6%时,能够大大减少氨味的产生,但对于其它感官指标,包括色泽、气味、滋味及体态方面并无显著(p>0.05)影响。甘氨酸添加量为6%时,感官评价总分为16.28,与对照组相比降低了20.27%,发酵虾头酱产品色泽变淡,质地由细腻变得较为粗糙,样品出现分层现象,且过量添加的甘氨酸,也会使得整体产品的甜味和虾味有所下降。
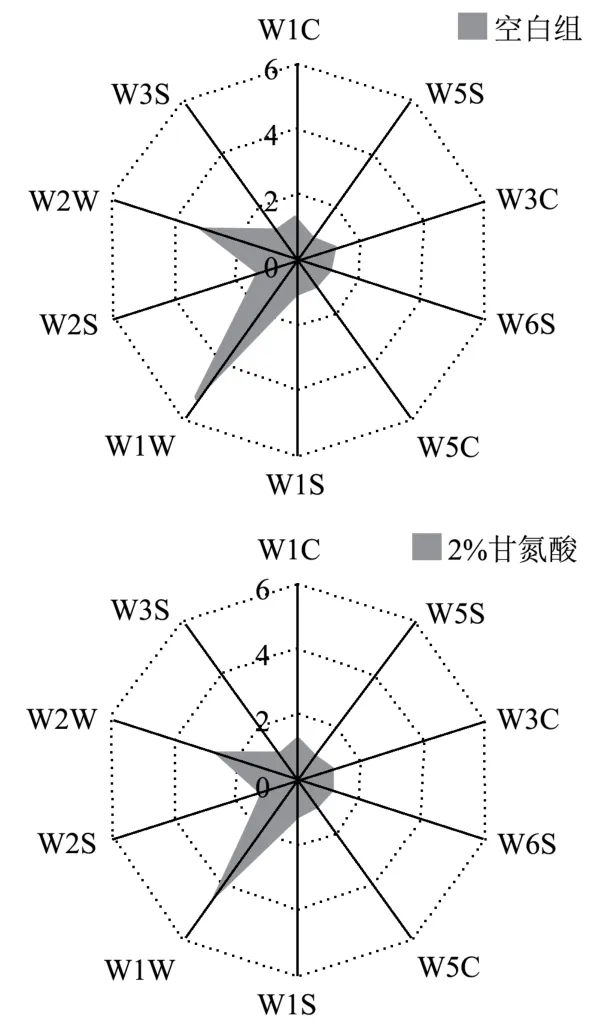
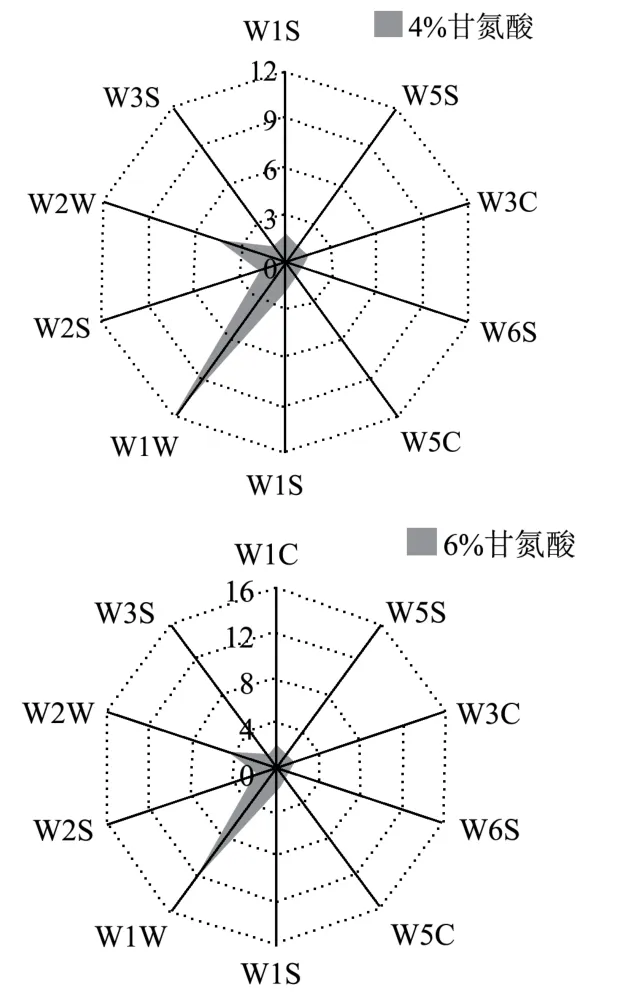
图9 接种不同含量甘氨酸发酵虾酱电子鼻检测结果Fig.9 Test results of electronic nose inoculated with different content of glycine fermented shrimp paste
对接种不同含量甘氨酸发酵虾酱最终成品进行电子鼻检测,发现甘氨酸的添加能够明显影响虾酱产品风味变化。虽然各组虾酱的响应值雷达图轮廓相似,但W1W、W2W 传感器的响应值差异较明显,说明接种甘氨酸能影响虾酱中含硫类化合物和芳香族化合物的产生。由图9 可知,含硫类化合物与芳香族化合物作为虾酱特征风味成分[39],在甘氨酸添加量为4%和6%时明显增加,而2%甘氨酸添加量发酵虾酱产品与对照组相比无明显风味差异。
综合感官评价结果,甘氨酸添加量为4%时对产品风味品质影响最佳,能够在保持产品良好色泽与质地的同时提升含硫类化合物与芳香族化合物等能够赋予虾酱良好风味物质的含量。
3 结论
本文以外加微生物法快速发酵虾酱工艺为基础,讨论了甘氨酸添加量为2%、4%、6%时对组胺生成的抑制作用以及对产品风味品质的影响。结果表明,向发酵虾头酱中添加甘氨酸,能抑制组氨酸脱羧酶活性,从而明显抑制组胺生成,在提高产品安全性的同时优化产品风味。外源甘氨酸的添加虽使TVB-N 含量上升,但整体上未降低虾酱产品品质,并且一定程度保证了产品质量及安全性。其中甘氨酸添加量为4%时效果最优,既能有效抑制组胺的生成又能维持增强产品特征风味。可见,外加甘氨酸法作为一种化学控制手段,在缩短虾酱产品发酵周期的同时能够保证产品风味,并且显著降低组胺含量,为产业化发展的安全可行性提供了保障。

