(His)6-tag 位置和N/C-末端截短改变重组副溶血弧菌磷脂酶D 的酶学特性
王方华,刘思雨,魏瑞霞,杨博,王永华
(1.华南理工大学食品科学与工程学院,广东广州 510640)
(2.华南理工大学生物科学与工程学院,广东广州 510006)
磷脂酶D(PLD,EC 3.1.4.4)是催化磷酸二酯键水解和碱基交换反应的一类酶的总称。广泛存在于高等动植物和细菌等多种生物体中。目前对于PLD 的研究多集中于陆地微生物,其中,放线菌中的链霉菌属Streptomyces是研究者所关注的焦点[1]。PLD 作为一种重要的工具酶,在食品和医药行业中具有极大的应用价值。在生物体内,PLD 催化磷脂(PLs)水解所生成的磷脂酸(PA)是一种具有多种生物学功能的细胞内脂质分子。此外,PA 还是许多生物活性信使脂质分子的前体物质,其中包括二酰基甘油(DAG)和溶血磷脂酸(LPA)[1]。因此,PLD 催化磷脂水解反应不仅在磷脂代谢中发挥重要作用,而且在诸如信号传导、胞内运输、细胞凋亡、细胞膜重构、囊泡运输、细胞迁移、有丝分裂、内吞作用、胞吐作用和细胞骨架重构等许多细胞生命活动中也起着重要作用[2-4]。PLD 作为一种界面酶,其催化水解反应在磷脂-水界面上进行[5]。在前期研究中,我们构建了副溶血弧菌PLD(VpPLD)的失活型重组表达菌株(对催化活性位点进行单点突变H152A),从界面吸附角度对VpPLD 的N-末端(1~34 个氨基酸)和C-末端(434~487 个氨基酸)肽段对VpPLD 的界面吸附特性的影响进行了表征。研究发现,N-和C-末端相应氨基酸的缺失会导致VpPLD 对各种磷脂单分子层的界面吸附特性发生改变[6]。此外,研究也发现重组表达蛋白中(His)6-tag 的位置也会对酶蛋白的界面吸附性质产生影响[6]。然而,关于(His)6-tag 和N/C-末端残基对VpPLD 底物选择性和基本酶学反应特性的影响信息仍然缺乏。基于此,本文成功构建了相应的重组突变体并分别测定重组突变蛋白的水解活性和磷脂底物选择性,为深入了解VpPLD 的结构功能关系奠定重要基础。
1 材料与方法
1.1 材料与仪器
1,2-二肉豆蔻酰基-sn-甘油-3-磷脂酰胆碱(DMPC)、1,2-二肉豆蔻酰基-sn-甘油-3-磷脂酰乙醇胺(DMPE)、1,2-二肉豆蔻酰基-sn-甘油-3-磷脂酰-(l"-rac-甘油)(DMPG)、1,2-二肉豆蔻酰基-sn-甘油-3-磷脂酰-L-丝氨酸(DMPS)、1,2-二月桂酰基-sn-甘油-3-磷脂酰胆碱(DLPC)、1,2-二棕榈酰基-sn-甘油-3-磷脂酰胆碱(DPPC)、1,2-二硬脂酰基-sn-甘油-3-磷脂酰胆碱(DSPC)、1,2-二油酰基-sn-甘油-3-磷脂酰胆碱(DOPC)、1,2-二花生四烯酰基-sn-甘油-3-磷脂酰胆碱(DAPC)均购自Larodon 公司(瑞典,索尔纳),纯度>98%。1,2-二辛基-sn-甘油-3-磷脂酰-对硝基苯酚(PpNP)参照D"Arrigo 等人(1995)[7]的方法合成。水杨酸钠购自美国Sigma 公司;重组表达载体pET21a和pET28a 购自Stratagene(La Jolla,CA,USA);大肠杆菌Shuffle T7 感受态细胞购自New England BioLabs(中国,北京);IPTG(异丙基β-D-1-硫代半乳糖苷)、卡那霉素和氨苄青霉素抗生素均购自生工生物工程股份有限公司(中国,上海);Ni2+-NTA 层析柱和阴离子交换色谱柱(Q-Sepharose XL)购自GE Healthcare 公司(美国,波士顿);50 ku 超滤管、BCA蛋白检测试剂盒购自生工生物工程股份有限公司(中国,上海);其它试剂均为分析纯。
PCR 仪,东胜创新生物技术科技有限公司;恒温振荡培养箱HYG-C,江苏太仓市强乐实验设备有限公司;超声波细胞破碎仪JY92-IIN,宁波新芝生物科技股份有限公司;蛋白层析仪Biologic LP,Bio-Rad 公司;酶标仪ELx800,BioTek 公司;微孔板恒温震荡器ST70-2,杭州米欧仪器有限公司。
1.2 方法
1.2.1 VpPLD-WT 及N-/C-端截短突变体大肠杆菌重组表达菌株构建
本研究中来自副溶血弧菌的PLD 蛋白序列已收录在了NCBI-蛋白质数据库中,编号为EXJ48329.1。PLD 全长由505 个氨基酸组成,利用软件Signalp 4.1预测蛋白序列中前 18 个氨基酸是其信号肽(MLHTLSKFIFAFMFSVLS)。根据大肠杆菌的密码子偏好性对编码成熟蛋白的PLD 基因序列进行优化,由生工生物技术公司进行全基因合成,命名为VpPLD-WT,其蛋白质序列见图1。在进行重组表达载体构建过程中,为考察不同(His)6-tag 位置对于VpPLD 酶蛋白活性和底物选择性的影响,分别将VpPLD-WT 导入重组表达载体pET21a 和pET28a 中,构建pET21a-VpPLD-WT-(His)6(C-末端带有(His)6-tag)或pET28a-(His)6-VpPLD-WT(N-末端带有(His)6-tag)和pET28a-(His)6-VpPLD-WT-(His)6(N/C- 末端均带有(His)6-tag)重组表达质粒。在此基础上,设计用于进行末端截短突变体构建的PCR 扩增引物(表1)。通过重叠延伸法分别以所构建的pET21a-VpPLD-WT-(His)6或pET28a-(His)6-VpPLD-WT质粒为模板进行截短突变,构建相应VpPLD 的N-末端(VpPLD-Δ1-34)和C-末端(VpPLD-Δ469-487 和VpPLD-Δ451-487)截短突变体,用限制性内切酶DpnI 对PCR 扩增模板进行酶切,将酶切消化后PCR 产物转化至大肠杆菌DH5α感受态细胞。提取相应的质粒进行测序以验证序列准确性。最后,将构建成功的质粒转化至大肠杆菌SHuffle T7 感受态细胞,构建相应的大肠杆菌重组表达菌株。

表1 磷脂酶VpPLD 突变体构建所用引物序列Table 1 Primer sequences for theVpPLD mutants construction
1.2.2 VpPLD-WT 及截短突变重组蛋白的表达与纯化
分别取上述构建好的大肠杆菌重组蛋白表达菌株,以5%的接种量接种到5 mL Luria-Bertani(LB)培养基(含有对应的抗生素),37 ℃、200 r/min 条件培养过夜,制备发酵种子液。将制备获得的种子液按10%接种量放大接种于3 L 含有相应抗生素(0.05 mg/mL)的LB 培养基中,37 ℃、200 r/min 条件下继续培养,当OD600nm=0.8 时添加异丙基-β-D-硫代半乳糖苷(IPTG)进行诱导,使其终浓度为0.2 mM。在20 ℃,200 r/min 条件下继续诱导培养20 h 后收集菌体。菌体重悬于600 mL 缓冲液A(50 mM Tris-HCl,100 mM NaCl,5.0 mM 咪唑,pH 8.0)中,进行超声破碎(超声破碎时间15 min),将破碎液进行离心(10,000 r/min,20 min,4 ℃),收集上清液。将收集的滤液上样至Ni2+-NTA 层析柱,用缓冲液A(50 mM Tris-HCl,100 mM NaCl,5.0 mM 咪唑,pH 8.0)冲洗,去除杂蛋白。随后用缓冲液B(50 mM Tris-HCl,100 mM NaCl,200 mM 咪唑,pH 8.0)进行目的蛋白洗脱。将收集获得的目的蛋白溶液继续上样至Q-Sepharose XL 柱,用缓冲液(50 mM Tris-HCl,500 mM NaCl,pH 8.0)洗脱目的蛋白。采用50 ku 超滤管对洗脱目的蛋白进行浓缩和换盐操作。利用12% SDS-PAGE 分析目的蛋白纯度。利用BCA 蛋白检测试剂盒测定蛋白质浓度。
1.2.3 VpPLD-WT 及截短突变重组蛋白的酶学性质表征
以1,2-二辛酰基-sn-甘油-3-磷脂酰-对硝基苯酚(PpNP)作为水解底物,采用分光光度法分别测定野生型VpPLD及其突变体在不同pH值和温度条件下的酶活力。将水解反应底物PpNP 用无水乙醇进行溶解,配制终浓度为10 mM。酶活力测定反应体系为:酶反应在96 孔板中进行,取10 μL(10 mM)底物溶液加入到200 μL 酶蛋白溶液中;对照组以对应pH 的缓冲液代替酶蛋白溶液。将96 微孔板置于微孔板恒温震荡器进行孵育,在30 ℃,200 r/min 条件下进行反应,反应一定时间后,加入100 μL 10% SDS 以终止反应,利用酶标仪测定405 nm 紫外吸收波长下样品的吸光值,参照绘制的产物pNP 标准曲线计算相应条件下的酶活力(U/g)。本实验中所用的缓冲液包括50 mM 柠檬酸-柠檬酸钠缓冲液(pH 4.0 和5.0)、50 mM 磷酸盐缓冲液(pH 6.0 和7.0)、50 mM Tris-HCl 缓冲液(pH 8.0)、50 mM 甘氨酸-氢氧化钠缓冲液(pH 9.0 和10.0)。每组实验设置三个平行组。1 个酶活力单位定义为在测定条件下每分钟释放1 μmol 对硝基苯酚所需的酶量。
参考Dippe 和Ulbrich-Hofmann 所建立的PLD 检测方法[8],对VpPLD-WT 及截短突变体的磷脂底物选择性进行表征。将相应磷脂底物用氯仿进行溶解,配制成一定浓度的磷脂母液(50 mM)。母液经氯仿进一步稀释制备成工作液(1 mM),取出一定体积的磷脂溶液,经氮气吹干除去氯仿,并用10 mM Triton X-100重新进行溶解,经超声处理得到含有1 mM 终浓度磷脂的底物溶液。酶活力的具体测定方法和步骤如下:取配制的磷脂底物溶液10 μL 与70 μL 的酶液(酶蛋白溶于50 mM Tris-HCl,pH 8.0)混匀后加入96 微孔板中,将96 微孔板置于微孔板恒温震荡器进行反应。对照组以50 mM Tris-HCl 缓冲液(pH 8.0)代替酶液,其它条件相同。分别设定不同的反应温度(20~45 ℃)条件,以200 r/min 速度震荡反应,反应30 min 后,加入水杨酸铁(FeSal)溶液(6.0 mM)200 μL 进行显色,显色5 min 后,用酶标仪测定样品在490 nm 紫外吸收波长下的吸光值。参照绘制的PA 标准曲线计算水解生成的PA 的量从而计算得出酶活力。每组实验设计三组平行。1 个酶活力单位定义为在测定条件下每分钟释放1 μmol PA 所需的酶量。
1.2.4 数据处理
所有数据均平行测定三次,采用SPSS 13.0 软件对相关数据进行分析,数据表示为“均值±标准差”,用ANOVA 进行方差分析,采用Duncan 法进行均数间的多重比较(显著性水平p<0.05)。采用Origin 8.0软件进行作图。
2 结果分析
2.1 VpPLD-WT 蛋白序列分析

图1 成熟VpPLD 蛋白序列Fig.1 Sequence information of mature VpPLD protein
VpPLD 序列全长由505 个氨基酸组成。其中,前18 个氨基酸(MLHTLSKFIFAFMFSVLS)被预测为信号肽,表明该蛋白在副溶血弧菌中为胞外分泌蛋白。在Swiss Institute of Bioinformatics 平台上的ExPASy 分子生物服务网页中,利用pI/Mw 计算工具,预测出的成熟VpPLD 蛋白的分子量和等电点分别约为55 ku 和5.35。在VpPLD 的蛋白序列中发现两个高度保守的基序(HxK(x)4D(x)6G),其中152 位组氨酸和386 位组氨酸被预测为活性氨基酸残基(见图1)。VpPLD 蛋白序列所含的高度保守HKD 基序表明此酶是PLD 超家族的成员。
2.2 (His)6-tag 位置对野生型VpPLD 酶学性质的影响研究
2.2.1 (His)6-tag 位置对野生型VpPLD 的最适反应pH 和温度的影响
为研究(His)6-tag 对VpPLD 的酶学性质的影响,本研究分别构建了(His)6-tag 位于野生型VpPLD 的N-末端((His)6-VpPLD-WT)或C-末端(VpPLD-WT-(His)6)以及N/C-两末端((His)6-VpPLD-WT-(His)6)的大肠杆菌表达菌株。通过SDS-PAGE 分析获得了高纯度的蛋白(图2)。以PpNP 作为水解反应底物,分别对所构建的三种野生型VpPLD重组蛋白进行不同pH条件下的酶活力测定,绘制酶活力随缓冲液pH 变化曲线。如图3a 所示,分别得到了三条钟形曲线。其中,(His)6-VpPLD-WT 在pH 值为7.0 时水解活性最高。而VpPLD-WT-(His)6在pH 值为8.0 时水解活性最高。对于(His)6-VpPLD-WT-(His)6,即使在pH 8.0 时活性显示最高,但与pH 值为7.0 时的酶活力相比,无显著性差异(p>0.05)。当反应pH 值低于7.0 或大于8.0 时,这三种酶的活性均显著降低。
以DOPC 为水解底物,采用分光光度度法分别测定了所构建的三种野生型VpPLD 在不同反应温度条件下(20~45 ℃)的酶活力,绘制出酶活力随温度变化的曲线。如图3b 所示,3 种野生型VpPLD 在30 ℃条件下均表现出最高的比活力。结果表明,(His)6-tag的位置不会对野生型VpPLD 重组蛋白的最适反应温度造成影响。

图2 重组表达的野生型VpPLD 及其对应截短突变蛋白的SDS-PAGE 结果Fig.2 Sodium dodecyl sulphate-polyacrylamide gel electrophoresis (SDS-PAGE) analysis of the purified wild-type VpPLD and its corresponding truncated mutants

图3 (His)6-tag 位置对野生型VpPLD 的最适pH(a)和温度(b)的影响结果Fig.3 Location of (His)6-tag on the optimum reaction pH (a)and temperature (b) of wild-type VpPLD
2.2.2 (His)6-tag 位置对野生型VpPLD 的酰基链长选择性的影响
在本研究中,选择具有不同酰基链长度(12~20个碳)的磷脂酰胆碱作为水解底物,进一步分析比较不同野生型VpPLD 的酰基链长选择性。结果表明:N-末端带(His)6-tag 的VpPLD((His)6-VpPLD-WT)和N/C-末端带有(His)6-tag 的VpPLD((His)6-VpPLD-WT-(His)6)对不同酰基链长度磷脂酰胆碱的底物选择性没有显著差异(p>0.05)。而C-末端带(His)6-tag 的VpPLD(VpPLD-WT-(His)6)则对不同酰基链长度的磷脂酰胆碱表现出选择性差异(图4a)。与其他酰基链长度的磷脂酰胆碱相比,发现VpPLD-WT-(His)6对DMPC(14:0),DSPC(18:0)和DOPC(18:1)的选择性显著提高(p<0.05),相对应的酶活力分别为7.55 U/g、6.47 U/g 和6.40 U/g。
通过对比三种野生型VpPLD 对不同磷脂的水解活力,发现N-末端带(His)6-tag 的VpPLD((His)6-VpPLD-WT)对所有磷脂底物均显示出较高的水解活性。相反的,测得C-末端带(His)6-tag 的VpPLD(VpPLD-WT-(His)6)对所有磷脂底物的活力最低。统计分析结果表明:(His)6-VpPLD-WT 的酶活力显著高于(His)6-VpPLD-WT-(His)6和 VpPLD-WT-(His)6(p<0.05)。对比(His)6-VpPLD-WT-(His)6和VpPLDWT-(His)6发现,这两种酶对DMPC,DSPC 和DOPC的水解活性没有显著性差异(p>0.05)。然而,VpPLDWT-(His)6对DLPC,DPPC 和DAPC 的水解活力显著低于(His)6-VpPLD-WT-(His)6(p<0.05)(图4a)。
2.2.3 (His)6-tag 位置对野生型VpPLD 磷脂头部选择性的影响
本研究中,我们选取四种带有不同极性头部基团的磷脂底物(DMPC、DMPS、DMPE 和DMPG)继续研究三种野生型VpPLD-WT 的底物选择性差异。如图4b 所示,(His)6-VpPLD-WT-(His)6和VpPLD-WT-(His)6对DMPS 的水解活力最低(p<0.05)。(His)6-VpPLD-WT-(His)6对DMPC,DMPG 和DMPE 底物选择性上没有显著差异(p>0.05)。而VpPLD-WT-(His)6对 DMPC 的水解活性显著高于其它三种磷脂(p<0.05),酶活力为7.55 U/g。对于(His)6-VpPLD-WT而言,其对四种磷脂底物选择性并无显著性差异(p>0.05)。
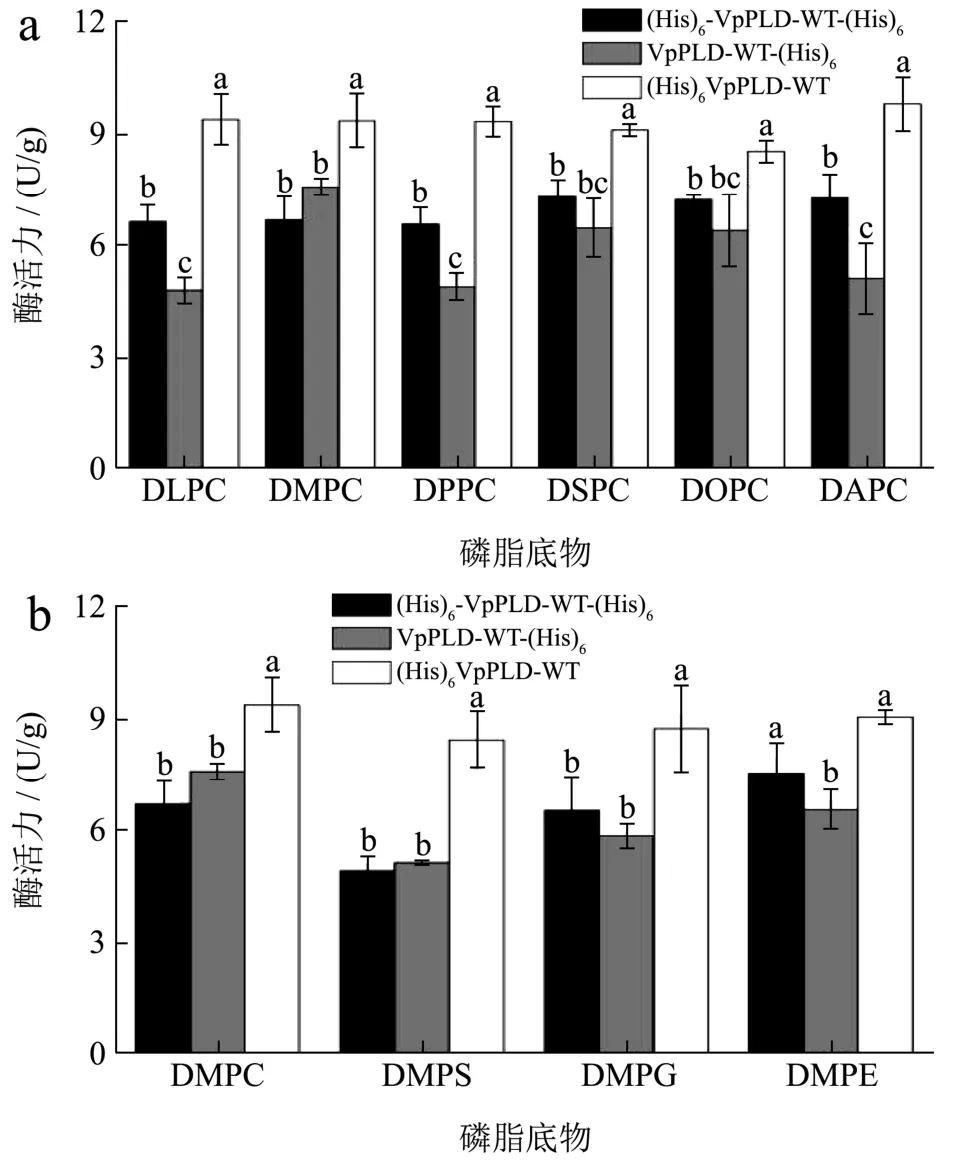
图4 三种野生型VpPLD 对不同酰基链长度(a)和极性头部磷脂的选择性(b)统计分析结果Fig.4 Comparison on the acyl-chain length selectivity (a) and polar head selectivity (b) between three kinds of wild-type VpPLD constructed in the present study
与三种野生型VpPLD 之间的酰基链长度选择性趋势相似,(His)6-VpPLD-WT 对不同头部基团的磷脂均表现出较高的水解活性(p<0.05)。(His)6-VpPLDWT-(His)6和VpPLD-WT-(His)6对DMPC,DMPS 和DMPG 的水解活性均没有显著差异(p>0.05)。然而对于底物DMPE 来说,(His)6-VpPLD-WT-(His)6的酶活力为7.51 U/g,要明显高于VpPLD-WT-(His)6(6.53 U/g)(p<0.05)(图4b)。
2.3 N-末端截短对VpPLD 酶学性质的影响
2.3.1 对最适反应pH 和温度的影响
与VpPLD-WT-(His)6相比,VpPLD-Δ1-34-(His)6的最适反应pH 从8.0 变为7.0(图5a)。同时,VpPLD-Δ1-34-(His)6最 适 温 度 比 野 生 型 VpPLD(VpPLD-WT-(His)6)最适反应温度提高5 ℃(图5b)。

图5 VpPLD-WT-(His)6及其相应的N-末端截短突变体VpPLD-Δ1-34-(His)6的最适反应pH(a)和温度(b)曲线Fig.5 Optimum reaction pH (a) and temperature (b) profiles of VpPLD-WT-(His)6 and its corresponding N-terminal truncated mutant VpPLD-Δ1-34-(His)6
2.3.2 对酰基链长度选择性的影响
与VpPLD-WT-(His)6相比,VpPLD-Δ1-34-(His)6对DLPC 的水解活性明显降低(p<0.05)。相反,VpPLD-Δ1-34-(His)6对于其它磷脂的水解活性均未发生显著改变(p>0.05)(图6a)。
2.3.3 对磷脂极性头部基团选择性的影响
与VpPLD-WT-(His)6相比,VpPLD-Δ1-34-(His)6对DMPS 的水解活性显著提高(p<0.05),酶活力为7.17 U/g。然而,对于DMPC,DMPE,DMPG 来说,VpPLD-WT-(His)6和VpPLD-Δ1-34-(His)6之间无显著性差异(p>0.05)(图6b)。

图6 N-末端截短对VpPLD 酰基链长度选择性(a)和极性头部选择性(b)的影响Fig.6 Effect of N-terminal truncation on the acyl-chain length selectivity (a) and polar head selectivity (b) of VpPLD
2.4 C-末端截短对VpPLD 酶学性质的影响
2.4.1 对最适反应pH 和温度的影响
(His)6-VpPLD-WT 和(His)6-VpPLD-Δ469-487 的最适反应pH 均为7.0。而(His)6-VpPLD-Δ451-487 的最适反应pH 变为8.0(图7a)。如图7b 所示,与(His)6-VpPLD-WT 相似,(His)6-VpPLD-Δ469-487 显示出较宽的温度适应性(从25 ℃至35 ℃)。然而,(His)6-VpPLD-Δ451-487 在30 ℃下表现出较高的酶活力,随着温度升高或降低,酶活力急剧下降。


图7 (His)6-VpPLD-WT 及其两个C-末端截短突变体(His)6-VpPLD-Δ469-487 和(His)6-VpPLD-Δ451-487 的最适反应pH(a)和温度(b)曲线Fig.7 Optimum reaction pH (a) and temperature (b) profiles of(His)6-VpPLD-WT and its two C-terminal truncated mutants(His)6-VpPLD-Δ469-487 and (His)6-VpPLD-Δ451-487
2.4.2 对酰基链长度选择性的影响

图8 C-末端截短对VpPLD 酰基链长度选择性(a)和极性头部选择性(b)的影响Fig.8 Effect of C-terminal truncation on the acyl-chain length selectivity (a) and polar head selectivity (b) of VpPLD
从图8a 可以看出,与(His)6-VpPLD-WT 相比,(His)6-VpPLD-Δ469-487 对于除DOPC 外所有的磷脂均表现出较低的水解活性。与(His)6-VpPLD-WT 相比,(His)6-VpPLD-Δ451-487 对DPPC 和DAPC 的水解活性均显著降低(p<0.05);相反,其对DOPC 的活性明显升高(p<0.05),酶活力达到10.39 U/g;而对于底物DLPC,DMPC 和DSPC,两者之间均未发现显著性改变(p>0.05)。对比(His)6-VpPLD-Δ469-487 和(His)6-VpPLD-Δ451-487,发现(His)6-VpPLD-Δ469-487对DLPC,DMPC,DSPC,DOPC 和DAPC 的水解活力显著低于(His)6-VpPLD-Δ451-487(p<0.05)。
2.4.3 对磷脂极性头部基团选择性的影响
从图8b 可以看出,与(His)6-VpPLD-WT 相比,(His)6-VpPLD-Δ469-487 对DMPC,DMPG 和DMPE的水解活性均显著降低(p<0.05),而对DMPS 的水解活性无显著改变(p>0.05)。与(His)6-VpPLD-WT 相比,(His)6-VpPLD-Δ451-487 对DMPG 和DMPE 的水解活性显著降低(p<0.05),而对DMPS 的水解活性显著提高(p<0.05)。对比(His)6-VpPLD-Δ469-487 和(His)6- VpPLD-Δ451-487,发现两者对DMPG和DMPE的水解活性均无显著变化。然而,(His)6-VpPLD-Δ451-487 对于DMPC 和DMPS 的水解活性则显著提高(p<0.05),酶活力分别为9.40 U/g 和15.65 U/g。
3 讨论
3.1 His-tag 位置会对VpPLD 的水解活性和磷脂底物选择性造成影响
重组蛋白的表达纯化是研究蛋白质结构与功能的重要环节之一。近年来,将多肽或蛋白质作为标签,与目标蛋白共表达的方法常用来表达纯化重组蛋白。传统的蛋白(多肽)标签有His-tag,Arg-tag,Flag-tag等[9],近年来又新开发了一些新型的标签,如Si-tag,Halo-tag,Intein-CBD-tag,ELPs-tag 等[10]。在这些标签中,(His)6-tag 因其体积小、纯化成本相对较低、能适应较为宽泛的pH(pH 4~10)和特殊环境(高盐、强变性剂、非离子型变性剂等)而最受欢迎[11,12]。His-tag 已经成功地应用于大肠杆菌,酵母,哺乳动物细胞等重组蛋白的表达纯化。然而,许多研究发现,即使His-tag 体积小,但它的存在对酶蛋白的酶学性质仍会造成一定影响[13-16]。在本研究中,我们也发现在构建的三种VpPLD-WT 中,无论对哪种磷脂底物,(His)6-VpPLD-WT 都表现出较高的水解活性,其次是(His)6-VpPLD-WT-(His)6,而VpPLD-WT-(His)6的活性最低。这些结果表明,(His)6-tag 的位置对VpPLD-WT的水解活性具有较大的影响。此外,我们还发现(His)6-tag 对VpPLD-WT 底物选择性产生影响,特别是当将(His)6-tag 连接到蛋白质 C-末端时,对VpPLD-WT 的底物选择性影响最大。当(His)6-tag 仅位于蛋白C-末端时,推测其可与蛋白自身某些氨基酸产生相互作用力改变活性口袋的空间构象,从而导致VpPLD 对不同酰基链长底物水解的选择性改变,使其更偏向于水解DMPC、DSPC 和DOPC。此外,(His)6-tag的存在,还对VpPLD 的不同极性头部磷脂底物水解选择性造成影响。(His)6-tag 位于C-末端时,VpPLD对不同极性头部磷脂底物不存在选择性差异。相反的,当(His)6-tag 仅位于N-端或N/C-两端时,则改变了VpPLD 对不同极性头部磷脂底物的选择性,使其更偏向于水解DMPC,DMPE 和DMPG。在本研究中,没有构建不带(His)6-tag 的 VpPLD 来详细比较VpPLD-WT 与目前三种VpPLD 的影响。但是,当前研究结果已经表明不同的(His)6-tag 位置对VpPLD 活性和选择性所造成的影响。此外,本研究还表明(His)6-tag 位于C-末端能将VpPLD 的最适反应pH 从7.0 变到8.0。推测当(His)6-tag 连接到VpPLD 的C-末端时,在空间位置上将更靠近酶的催化中心,组氨酸作为一种碱性氨基酸,可能会影响催化口袋的微环境从而改变酶的最适反应pH 值。本研究首次提供了(His)6-tag 对VpPLD 比活力、底物选择性以及最适反应pH 影响的详细信息。然而,其具体的作用机制仍需作进一步研究。
3.2 N/C-末端截断对VpPLD 水解活性和选择性造成较大影响
众所周知,PLD 作为一种界面反应酶。在反应过程中PLD 首先需要结合到磷脂界面上,才能够接触反应底物并形成共价连接的磷脂酰-酶中间体[17]。在我们之前的研究中,通过构建 N-末端截短突变体(VpPLD-Δ1-25-(His)6和VpPLD-Δ1-34-(His)6)和C-末 端 截 短 突 变 体((His)6-VpPLD-Δ469-487 ,(His)6-VpPLD-Δ451-487 和(His)6-VpPLD-Δ434-487)的非活性形式(在催化活性位点单点突变H152A)来尝试比较不同突变体之间的界面结合特性[6]。在本研究中,为进一步了解N/C-末端片段缺失对VpPLD 的比活力和底物选择性的影响,我们设计并构建了相应的截短突变体。遗憾的是,在构建突变体时,其中两个 突 变 体(VpPLD-Δ1-25-(His)6和(His)6–VpPLD-Δ434-487)无法获得阳性克隆,均未构建成功。确切原因尚不清楚。因此,本研究只将构建成功的突变体与VpPLD-WT 进行比较。从图6a 可以看出,除VpPLD-Δ1-34-(His)6对DLPC 显示较低的水解活性外(p<0.05),VpPLD-WT-(His)6和VpPLD-Δ1-34-(His)6对不同酰基链长度磷脂的水解活性均无显著变化(p>0.05)。该结果表明,删除前34 个氨基酸并不会改变VpPLD 对长链磷脂(C14-20)的选择性。与VpPLD-WT-(His)6相比,VpPLD N-末端前34 个氨基酸的缺失会明显增强VpPLD 对DMPS 的水解活性,使其酶活力从5.11 U/g 增加为7.17 U/g,而对于其它磷脂的水解活性,未发生显著改变(图6B)。然而,我们之前的结果表明, VpPLD-WT-(His)6和VpPLD-(His)6-Δ1-34 对磷脂单分子层的最大插入压力(MIP)或协同因子α 差异不显著(p>0.05)[6]。MIP和协同因子α 是两个用于评估蛋白质与单分子膜的界面结合特性的主要参数。以上结果表明,VpPLDΔ1-34-(His)6对DMPS 水解活性的改变并非是由于界面吸附特性改变所造成。同时,我们也发现对于底物DMPE 来说,界面吸附和水解活性之间呈现出相反的结果:与VpPLD-(His)6-WT(29.8±2.8 mN/m)相比,VpPLD-(His)6-Δ1-34 的MIP 值更高,为47.8±8.7 mN/m[6]。然而,在本研究中未发现截短后对DMPE的水解活性造成显著变化。对于DMPC 和DMPG 而言,VpPLD-WT-(His)6和VpPLD-Δ1-34-(His)6的水解活性没有显著改变(图6b)。该结果与我们之前关于界面吸附的趋势保持一致[6]。综合以上所有结果可以看出,PLD 催化磷脂水解反应是一个非常复杂的过程。虽然可将其细分为界面吸附和界面催化两个过程来分析,但实际反应过程可能不像我们认为的那么简单。
与(His)6-VpPLD-WT 相比,(His)6-VpPLD-Δ469-487 对所有磷脂底物均表现出相对较低的水解活性(图8)。此外,本研究发现除DAPC,DMPS,DMPG和DMPE 外,(His)6-VpPLD-Δ451-487 对于大多数磷脂的水解活性没有显著变化。值得一提的是,与(His)6-VpPLD-WT 和(His)6-VpPLD-Δ469-487 相比,(His)6-VpPLD-Δ451-487 的水解活性显著增强。以上结果表明,VpPLD 中451~487 肽段的氨基酸对VpPLD的水解活性发挥重要影响作用。此外,从底物选择性角度分析发现:(His)6-VpPLD-WT 和(His)6-VpPLDΔ469-487 对不同酰基链长度和极性头部磷脂的选择性并没有显著改变。但是,(His)6-VpPLD-Δ451-487 对DPPC,DMPG 和DMPE 的选择性明显降低。该结果表明,451~469 肽段对VpPLD 的底物选择性具有重要影响。后续可针对这些肽段的氨基酸进行单点突变,以进一步鉴定与VpPLD 底物选择性密切相关的氨基酸残基位点信息并揭示其具体调控机制。
4 结论
(His)6-tag 的位置不仅影响到重组VpPLD 蛋白的界面吸附特性,而且会不同程度改变VpPLD 重组蛋白的催化活性和选择性等酶学性质。尤其是当(His)6-tag 位于蛋白的C-末端时,影响效果最为显著,导致酶蛋白活性显著降低,最适反应pH 从7.0 变到8.0,同时,底物选择性也发生相应改变;N-末端前34 个氨基酸的缺失将导致VpPLD 对DMPS 的选择性显著增强;C-末端截短突变的分析结果表明:C-末端451~469 肽段对VpPLD 的底物选择性具有重要影响。本研究结果将为下一步针对该酶的分子改造以进一步提高酶蛋白活力以及针对特定磷脂底物的选择性改造提供重要靶点信息。

