香雪兰精油体外抗白色念珠菌的机制初探
郑海洋,张译同,曹东慧,王 丽
(1.东北师范大学遗传与细胞学研究所,教育部分子表观遗传学重点实验室,吉林 长春 130024;2.吉林大学第一医院临床研究部,吉林 长春 130021)
白色念珠菌(Candidaalbicans)是一种常见的条件致病真菌.在正常情况下,白色念珠菌以酵母态存在于人体表面和黏膜上,不会引起感染症状.但是,当人体的免疫力低下时,白色念珠菌会迅速繁殖并转换为菌丝态,侵袭人体的口腔、皮肤和阴道,引起感染[1-2].由白色念珠菌引起的血液感染,即使进行了治疗,死亡率仍然高达70%[3-4].临床上常用的抗真菌药如氟康唑和两性霉素B等具有广谱抗真菌作用,但长期使用会导致病原菌耐药性的增加.因此,开发新的抗真菌药成为公共卫生安全的迫切愿望[5-6].
中国地大物博,有许多药用植物与芳香植物,加之我国拥有悠久的中草药应用历史,因此药用植物成为开发新的抗真菌药物的宝库.自然界中大部分植物都具有独特的气味,这些气味由植物中多种小分子挥发性物质(萜类、苯环/苯丙素类和脂肪族衍生物)混合而成[7-8].这些挥发性物质不仅在植物的生长和繁殖中发挥重要作用[9],还被发现具有抗真菌活性[10-11].
香雪兰(Freesiahybrida)是鸢尾科的多年生球茎花,它具有浓郁的香气,包含多种挥发性物质,尤其是大量的萜类化合物.本课题组前期从香雪兰RedRiver®花朵中提取了精油,随后通过气相色谱-质谱联用(GC-MS)测量了精油中的成分和各成分含量.课题组之前的研究表明,香雪兰精油对多种微生物都有抑制作用[12],但是对白色念珠菌的抗真菌作用及其可能的作用机制尚不清楚.为此,本文检测了精油的最小抑菌浓度和最小杀菌浓度,研究了精油对白色念珠菌增殖的影响,并通过膜完整性、氧化还原平衡和线粒体功能进一步探讨了其作用机理,以为抗真菌感染药物的开发提供一定的理论依据.
1 材料与方法
1.1 实验材料
香雪兰RedRiver®购自辽宁省朝阳市凌源市.取花朵提取精油.
白色念珠菌ATCC10231取自东北师范大学生命科学学院微生物学实验室,用酵母浸出粉胨葡萄糖培养基(YPD)培养.芳樟醇购自Sigma公司(美国),其余试剂购自上海生工生物工程股份有限公司.
1.2 滤纸片琼脂扩散法测量精油及其成分的抗真菌能力
挑取白色念珠菌单克隆,接种于5 mL YPD液体培养基中,置于30℃摇床140 r/min培养16 h左右.将菌悬液与含琼脂的培养基混合均匀后平铺在制备好的固体培养基表面,取直径6 mm的无菌滤纸片分别在二甲基亚砜(DMSO)、两性霉素B、精油及精油组分中完全浸润,放置在含菌平板上,培养24 h后观察并测量抑菌圈大小.其中,DMSO为阴性对照,两性霉素B为阳性对照.
1.3 最低抑菌浓度(MIC)和最低杀菌浓度(MBC)的测定
调整菌浓度至1×106个/mL左右,分装至15 mL离心管中.使用DMSO做中间溶剂,稀释精油并加入菌悬液中,使精油终浓度(质量分数)为0.4%,0.25%,0.125%,0.1%,0.05%,0.025%,0.005%,0.30℃培养24 h后观察溶液,肉眼观察无浑浊的为最低抑菌浓度.在超净台中从每管吸取100 μL溶液涂布至YPD平板上,继续过夜培养,无菌落生长的为最低杀菌浓度.
1.4 白色念珠菌生长曲线绘制
调整菌浓度为(0.1~1)×106个/mL,将菌液分为4组,分别使用不同浓度精油(0.125%,0.1%,0.05%)和DMSO进行处理,每组3个平行.每隔1 h测量菌液D值,绘制白色念珠菌生长曲线.
1.5 观察香雪兰精油对细胞膜和细胞形态的影响
取活性良好的菌悬液,经PBS洗涤后用不同浓度的香雪兰精油分别处理2 h和4 h.处理完成后10 000 r/min离心10 min,取上清测量其在260和280 nm处的吸光值,确定白色念珠菌大分子物质泄漏情况,判断细胞膜通透性变化.
收集不同浓度的精油处理过的白色念珠菌,PBS洗涤后重悬,移入装有玻璃片的24孔培养板中,静置1 h使菌液沉淀至玻璃片上.小心除去上清液,2.5%戊二醛固定并用系列叔丁醇脱水干燥.取干燥的样品进行金属溅射涂层,用S-570扫描电子显微镜下观察细胞形态.
1.6 检测白色念珠菌氧化还原状态
离心收集精油处理后的白色念珠菌,用DCFH-DA探针测定活性氧(ROS)含量.设置激发波长488 nm、发射波长525 nm,用全波长酶标仪检测.根据(Fsample-Fblank)/(FDMSO-Fblank)×100%将实验结果转换为百分比.式中,FDMSO,Fsample,Fblank分别是DMSO处理组、精油处理组和PBS处理组的荧光值.用JC-1染色工作液测定白色念珠菌线粒体膜电位变化.设置激发光波长490 nm、发射光波长530 nm检测JC-1单体;设置激发光波长525 nm、发射光波长590 nm检测JC-1聚合物.线粒体膜电位表示为聚合物与单体的比.
离心收集精油处理后的白色念珠菌,液氨研磨破碎细胞,用PBS溶解并离心,取上清作为待测样品.按碧云天总SOD活性检测试剂盒(WST-8法)说明书、过氧化氢酶检测试剂盒说明书和脂质氧化检测试剂盒说明书测定白色念珠菌超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)酶活性和丙二醛(MDA)含量.
1.7 抗氧化基因表达分析
通过Trizol法提取白色念珠菌RNA,转化为cDNA,并使用SYBR Green PCR Master mix专用试剂通过Real time-qPCR检测相关基因的表达.引物序列如下:
ACT正向引物序列,5′-CGATGGAAGTTTGAGGCAATA-3′,反向引物序列,5′-CTCTCGGCC AAGGCTTATACT-3′;SOD2正向引物序列,5′-CGCAACTACCCGTGCTACTTT-3′,反向引物序列,5′-TGGTTCAGTAGCGGAGAATTCA-3′;SOD6正向引物序列,5′-GACCCCGACCCACCTCAACAA-3′,反向引物序列,5′-GGGTAGCAAGGAGTGCCGGT-3′;CAT正向引物序列,5′-CCACCCCAGCTGATTTCAAA-3′,反向引物序列,5′-ACACTCTGTCTTGGATAGCAGCAT-3′.
2 结果与分析
2.1 精油及其成分对白色念珠菌生长的抑制能力
表1显示了香雪兰精油及其主要成分对白色念珠菌的抗真菌作用.DMSO作为阴性对照对白色念珠菌没有明显的抑制作用.两性霉素B作为抑制白色念珠菌的阳性对照,抑菌圈的直径为(1.283±0.029)cm,这意味着白色念珠菌对其具有中度敏感性.精油对白色念珠菌的抑制作用强于两性霉素B,抑菌圈直径为(2.267±0.208)cm,说明白色念珠菌对精油极度敏感.在精油的主要成分中,芳樟醇与精油具有相似的作用,松油醇、香叶醇和橙花醇具有中度或高度的抑制作用,而罗勒烯、环柠檬醛、紫罗兰酮和二氢-β-紫罗兰酮几乎没有抑菌作用,因此,选择精油和芳樟醇来检查对白色念珠菌生长的影响.检测结果表明,它们的抗真菌作用都是剂量依赖性的.此外,0.1%的精油显著抑制了白色念珠菌的生长(P<0.05),而0.1%的芳樟醇没有明显的抑制作用(见图1(A)),表明精油具有显著的抑制作用,抗真菌作用比其组分要强.
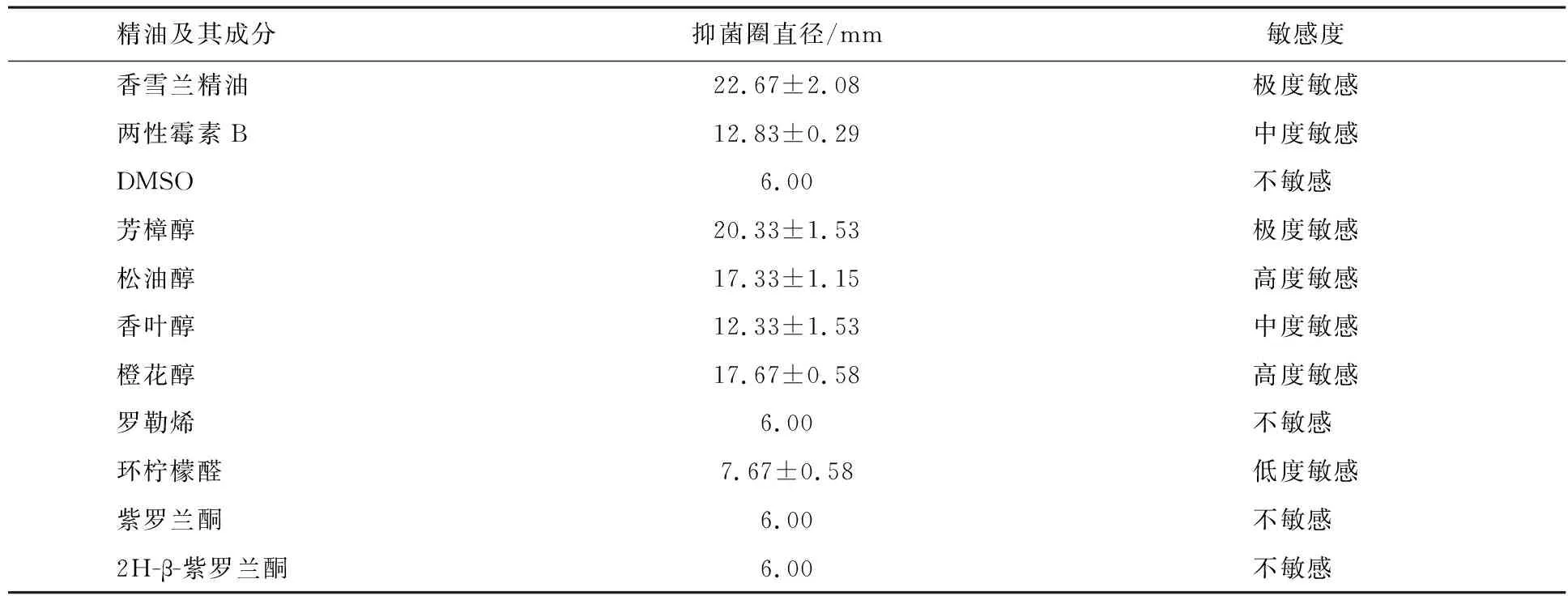
表1 香雪兰配制精油及其主要成分对白色念珠菌的抑制作用
当白色念珠菌悬液没有肉眼可见的浑浊时,精油达到最小抑菌浓度(MIC).当精油浓度为0.1%时,液体没有浑浊,D(600)值接近空白对照,因此,判断精油的MIC为0.1%.继续培养后,当精油质量分数达到0.25%时,平板上没有菌落生长,精油的MFC为0.25%(见图1(B)).综合考虑MIC和MFC,在以下实验中选择质量分数为0.05%,0.1%和0.125%的精油探究抑菌杀菌机制.
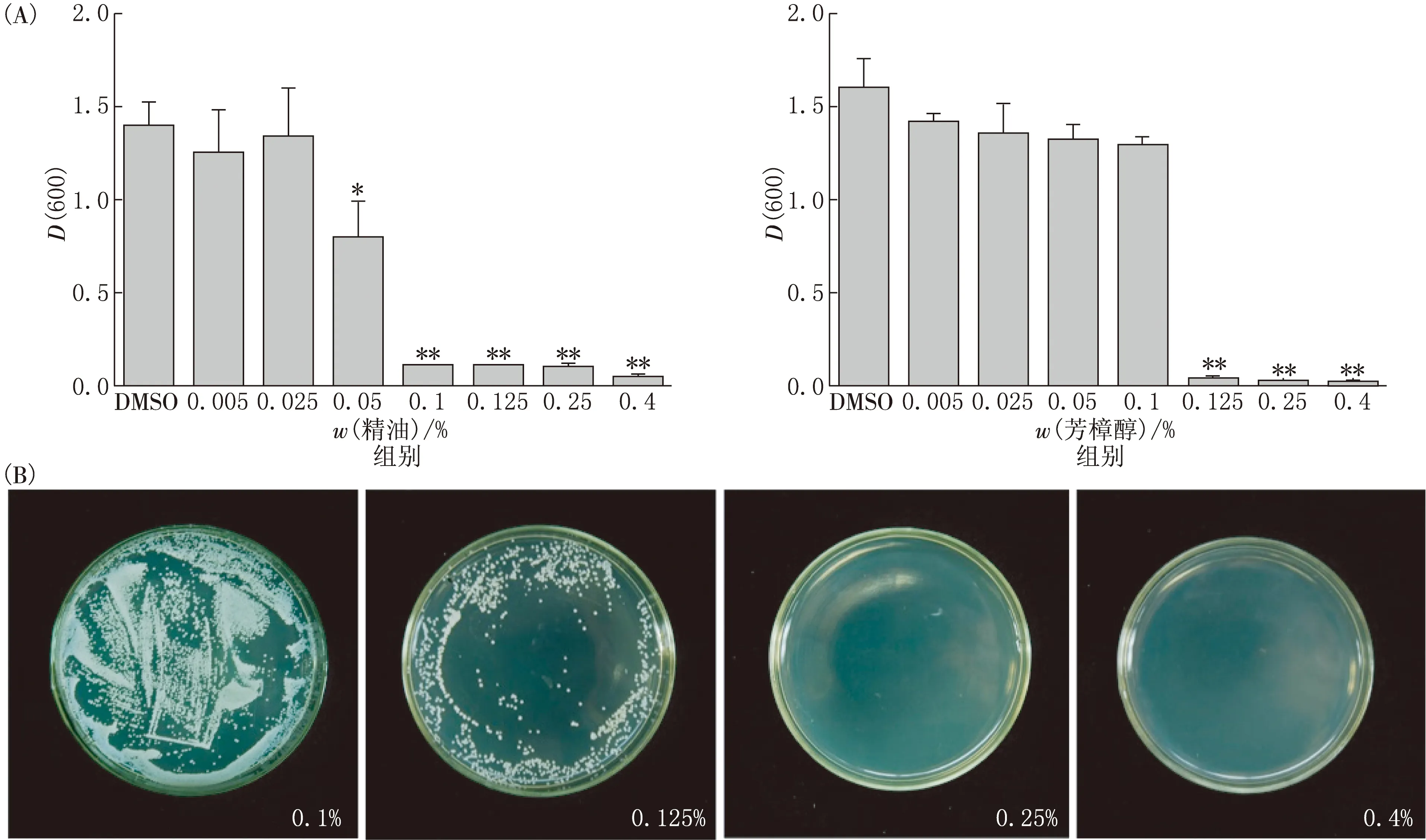
图1 精油对白色念珠菌的抑制作用
用不同浓度的精油和芳樟醇处理白色念珠菌细胞24 h(A).在去除精油的培养基上继续培养,测得MFC(B).数据代表3次平行实验的平均值.
2.2 精油对白色念珠菌增殖和形态的作用
检查精油对白色念珠菌20 h内增殖的剂量影响,结果见图2.由图2(A)可见,0.05%的精油在最初的8 h内对白色念珠菌的生长具有抑制作用,而其抗真菌作用在随后的12 h内逐渐降低.但是,在整个20 h内,0.1%和0.125%精油处理的白色念珠菌都没有生长趋势,表明0.1%和0.125%的精油抗真菌作用是持续的.对白色念珠菌的进一步形态学观察表明:DMSO组白色念珠菌的形状规则,背景干净;0.05%处理组细胞黏附无明显改变;0.1%处理组细胞融合在一起,轮廓模糊,背景中存在一些细胞碎片;在0.125%的处理组中,可以发现大量细胞碎片(见图2(B)).
为了检测精油是否会导致细胞膜受损,在不同处理组中检测大分子物质的泄漏情况,结果(见图2(C))表明,精油处理2 h后,大量核酸和蛋白质从细胞中流出,随着精油处理时间的延长,大分子物质的泄漏程度也在增加.
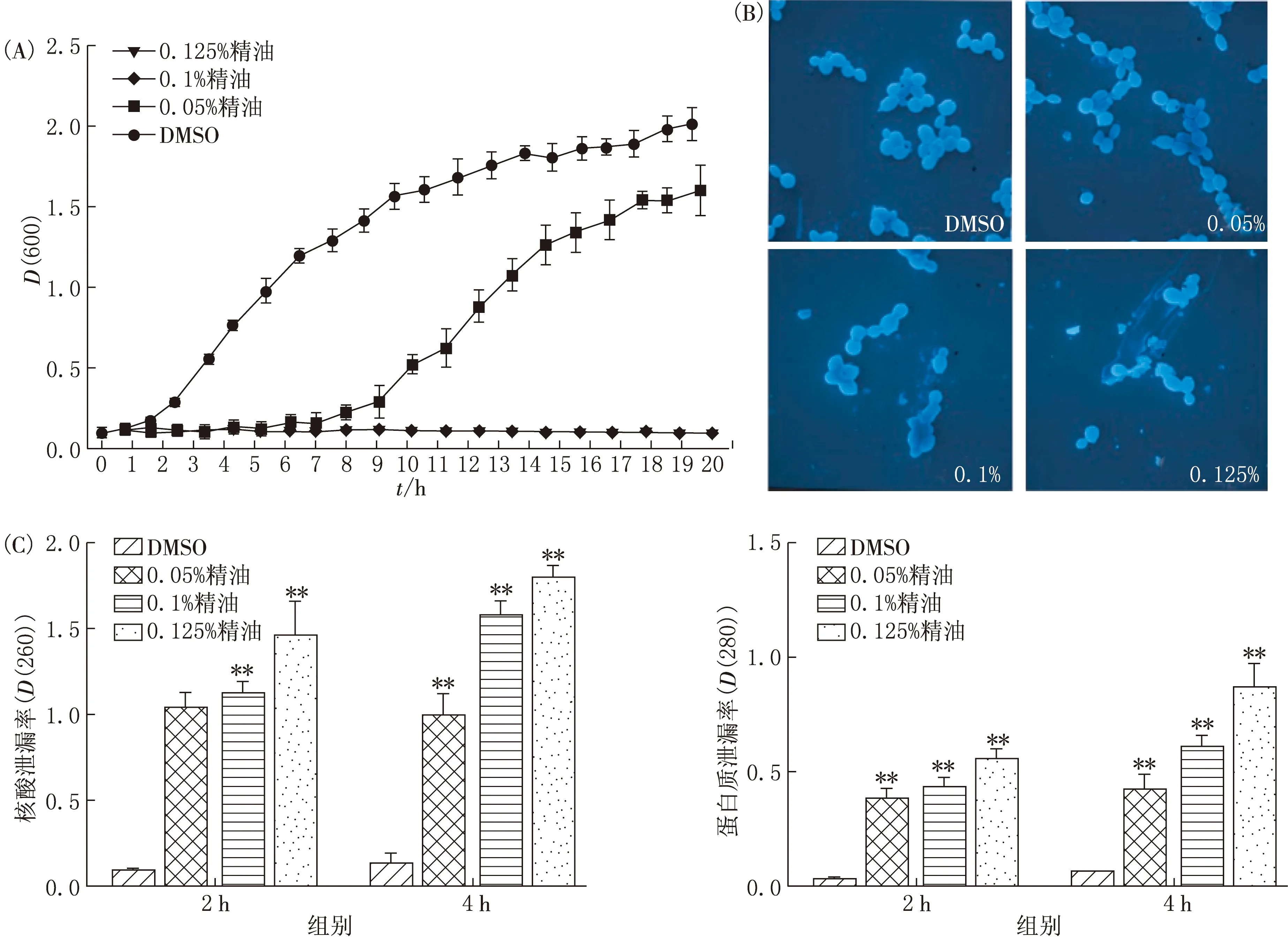
(A)生长曲线;(B)细胞形态变化;(C)核酸泄漏和蛋白质泄漏情况
2.3 精油诱导白色念珠菌的氧化还原失衡
正常细胞代谢产生的活性氧会被抗氧化酶(如超氧化物歧化酶和过氧化氢酶)迅速分解为无害物质[13].为了了解白色念珠菌中活性氧(ROS)的产生和积累情况,检测了细胞内ROS水平以及SOD、CAT的活性,结果见图3.由图3(A)可见,ROS水平在0.05%精油处理组略有增加,而在0.1%和0.125%处理组极显著增加.为了检查ROS的积累是否能引起脂质过氧化水平的提高,检测了丙二醛的含量.与ROS的结果类似,0.1%和0.125%处理组中丙二醛的含量有所增加(见图3(B)).对线粒体膜电位的测量结果如图3(C)所示,当用0.1%和0.125%的精油处理白色念珠菌时,线粒体膜电位极显著降低.这表明ROS积累与粒体功能障碍有关.此外,在蛋白质和mRNA水平观察精油处理后白色念珠菌超氧化物歧化酶和过氧化氢酶的变化情况,SOD和CAT酶活性和基因表达水平均呈下降趋势(见图3(D),(E),(F)).
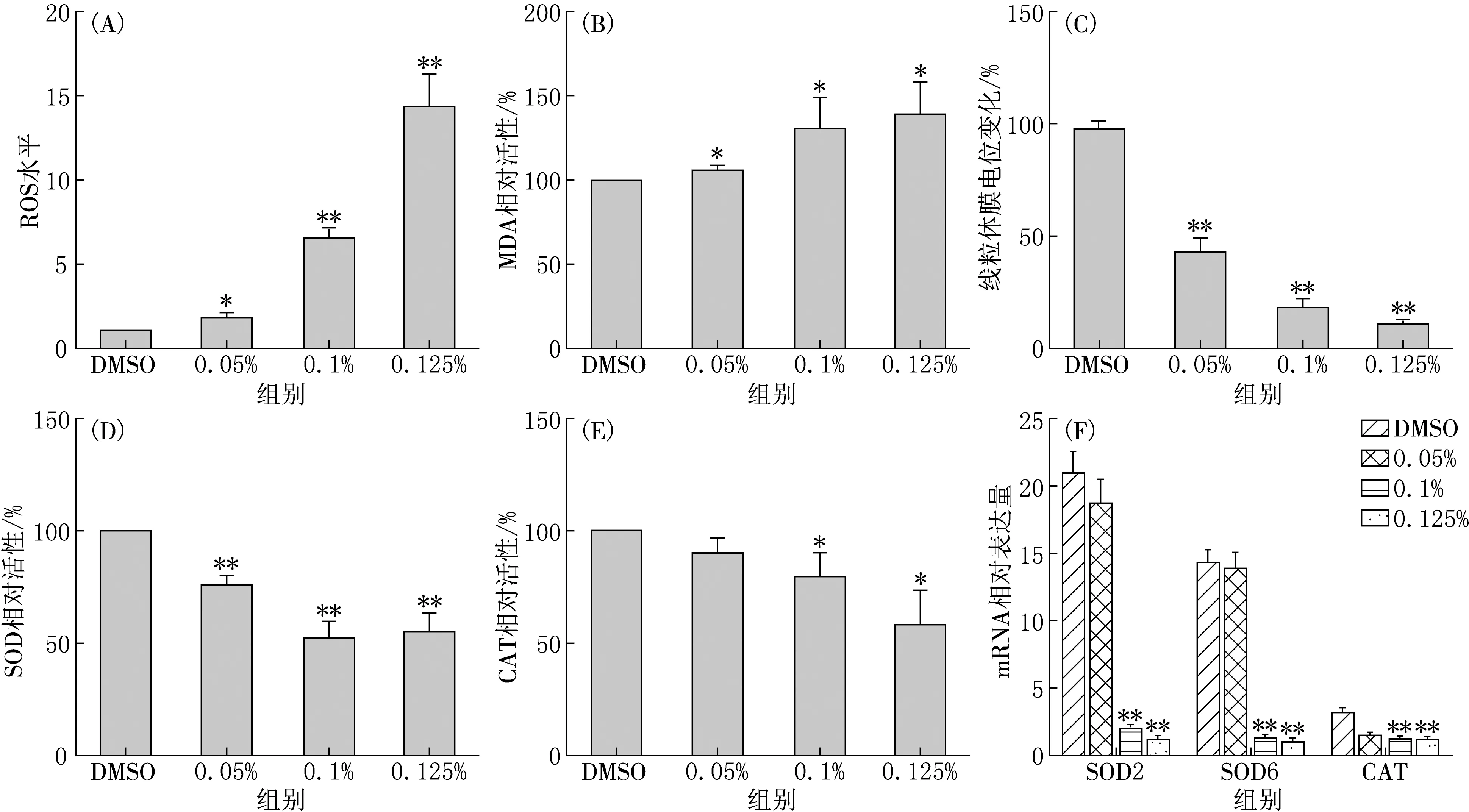
(A)ROS的积累情况;(B)MDA含量变化;(C)线粒体膜电位变化;(D)超氧化物歧化酶活性;
3 讨论与结论
白色念珠菌严重威胁着艾滋病、癌症和器官移植等免疫薄弱的患者的安全[14-15].传统抗真菌药物的使用具有局限性,为此人们迫切寻找新的药物替代或协助治疗白色念珠菌感染.由于毒性低且易于获取,多种植物代谢产物引起了科学家的关注[16-18].1969—2015年,多达142种具备抗真菌作用的天然产物被记录发表[19].本实验采用香雪兰RedRiver®花朵提取精油,通过滤纸片琼脂扩散法得到香雪兰精油对白色念珠菌的抑菌圈直径为22.67 mm,药物敏感程度为极度敏感.芳樟醇、松油醇和香叶醇等主要成分单独实验时也表现出抑菌作用,这与Pinto E.,Carson C.和Riley T.等人的研究结果[20-21]一致.但本实验中单一成分的抑菌圈直径小于香雪兰精油本身,证明香雪兰精油的抑菌效果优于单一成分.常量稀释法测定的香雪兰精油对白色念珠菌的MIC和MFC分别为0.1%和0.25%.生长曲线的结果与之相符,MIC及更高浓度的香雪兰精油能在较长时间内持续阻碍白色念珠菌的生长,而更低浓度的精油只能起到延缓生长、降低真菌活性的作用.与国内一些其他精油相比,如朱梅芳等[22]提取的五味子-薄荷-连翘混合精油,香雪兰精油的MIC更小,对白色念珠菌抑菌作用更强.
精油抗真菌的机制包括破坏细胞壁和细胞膜、影响细胞分裂、破坏DNA/RNA和蛋白质合成以及阻碍线粒体功能等[10-11,23-25].在本实验中,利用分光光度计探测菌液上清中核酸及蛋白质的含量可以发现,精油处理后上清液吸光值上升,白色念珠菌细胞膜通透性增加导致细胞内大分子物质泄漏.扫描电镜下也观察到精油导致白色念珠菌形态改变,相互粘连.对细胞内相关指标的检测显示,精油处理后白色念珠菌的线粒体膜电位丧失、ROS大量积累、脂质过氧化水平加强,表明精油导致的生长抑制可能与线粒体功能障碍有关.线粒体是细胞的重要细胞器,它们的损伤会导致大量活性氧的产生[26],进一步诱导脂质过氧化作用加强,产生以MDA为代表的终产物.MDA能引起大分子(如蛋白质和核酸)的交联聚合,并且具有细胞毒性[27-28].此外,香雪兰精油抑制了具有清除ROS作用的抗氧化酶SOD和CAT的活性.抗氧化酶的缺乏导致活性氧和脂质过氧化产物的大量积累,进一步破坏了生物膜结构.根据以上结果,香雪兰精油影响白色念珠菌的机制包括破坏细胞膜导致内溶物泄露以及诱导线粒体功能障碍导致氧化还原失衡,这也表明不同的作用机制在精油抑制白色念珠菌的过程中并非单独发生,而是共同起作用.
香雪兰精油对白色念珠菌有良好的抑制作用,该作用具有时间效应和剂量效应.这种抑制机制造成细胞膜损伤与线粒体功能障碍,使细胞内氧化还原失衡,细胞不能正常生长生存.香雪兰精油富含多种萜烯类化合物,成分复杂,可能比传统单一成分的抗真菌药更难产生耐药性现象.另外,香雪兰精油气味清新,容易为患者所接受.有关香雪兰精油的产品值得进一步研究,为开发天然抗真菌药物奠定基础.

