牦牛AQP2基因克隆及其在雄性生殖道中的表达研究
黄向月,熊显荣,2,海 卓,穆松银,李 键,2
(1.西南民族大学 生命科学与技术学院,四川 成都 610041;2.青藏高原动物遗传资源保护与利用教育部重点实验室,四川 成都 610041;3.动物科学国家民委重点实验室,四川 成都 610041)
牦牛(Bosgrunniens)是在低氧环境中具有较强适应能力的牛属动物之一,有“高原之舟”的美誉[1]。但其繁殖性能较低,阻碍了高原地区牧业经济的发展。为此,开展牦牛繁殖性能的相关研究可丰富中国畜种资源[2-3]。影响哺乳动物繁殖性能的因素多种多样,而精子发生则是众多因素之一。其过程包括了在睾丸曲细精管中各种精细而复杂调控的细胞分化,生殖细胞经历一系列分化以及形态变化后形成单倍体雄性配子[4],由生精上皮连续产生液体有助于将精子释放到腔内,在这之后,精子离开睾丸并进入附睾头部。在附睾中,精子通过获得进行性运动并获能,最后形成特殊形态的成熟精子。这一过程在诸多因素的协同调控下进行,其中水转运在精子运输、成熟等进程中起着特殊的作用[5-7]。例如,由雄性生殖道上皮细胞分泌和重吸收的水分含量是影响其管腔微环境稳定性及腔内液体组分浓度的原因之一,并通过酶活性的调节来调控精子的成熟[8]。因此,雄性生殖系统中水转运的平衡可能是管腔内精子获得运动和生育能力所必需的条件。
多个存在于哺乳动物中的水通道蛋白家族成员(Aquaporin),具有不同的通透性特征和不同的亚细胞定位[9]。其具有6个跨膜结构域,是质膜的组成部分,可促进跨膜的水转运。水通道蛋白家族的成员之一,AQP2在多种组织和细胞中广泛表达。最初发现于肾脏的集合管[10],其细胞表面 AQP2的表达不足会导致肾性尿崩症[11-12]。目前研究发现,AQP2在绵羊、兔[13]、小鼠、牛[14]和人类肾脏[15]中表达量极其丰富,主要富集在集合管主细胞和内髓集合管中。有研究表明,AQP2在上皮形态发生方面有着关键作用,并与整联蛋白相互作用促进细胞迁移,有助于肾的结构和功能完整性[16]。此外,AQP2还存在于生殖系统中[17-19],人子宫内膜中的雌激素可介导AQP2的表达水平,AQP2低表达可能导致子宫受体受损,影响胚胎着床[20-21]。AQP2在这些组织中的表达显示出高水渗透性,并且主要负责肾水浓度以及精子运输的水转运机制。由此可知,AQP2在生殖发育相关生物学活动的调节中起着一定作用。
目前,关于AQP2在牦牛雄性生殖道中的研究仍未见相关报道。本试验利用RT-PCR技术得到牦牛AQP2基因的CDS序列,同时分析该序列并预测其蛋白结构。运用免疫组化方法检测牦牛睾丸组织中AQP2的细胞定位,同时通过qRT-PCR方法检测牦牛各组织及不同发育阶段雄性生殖器官中AQP2mRNA的表达情况,为进一步从分子水平开展牦牛雄性生殖繁育相关研究提供理论依据。
1 材料和方法
1.1 主要试剂与仪器
pMDTM19-T载体、 Premix TaqTMDNA聚合酶、SYBR®Premix Ex TaqTMⅡ试剂盒、PrimeScriptTMRT Reagent Kit反转录试剂盒购自TaKaRa;荧光定量PCR仪购自Bio-Rad;感受态细胞DH5α、DEPC、DNA Marker购自天根生化科技有限公司;DNA胶回收试剂盒购自康宁生命科学有限公司。
1.2 样本采集
牦牛样本均采自四川广汉市盛大食品厂,收集肾、睾丸、附睾、脾、脑、肺、心和肝组织;随后收集胎儿时期(5~6月)、幼年时期(1~2岁)、性成熟时期(4~5岁)牦牛睾丸、附睾、输精管、前列腺和精囊组织。均采集3头,置于液氮中。
1.3 总RNA的提取及检测
根据TRIzol法从牦牛各个组织中提取样本RNA,使用核酸分析仪测定其浓度和纯度,选取符合OD260/280nm值在1.8~2.0作为模板RNA,依照使用说明合成cDNA,-20 ℃保存。
1.4 AQP2的扩增与克隆
利用NCBI已报道的黄牛(Bostaurus)AQP2mRNA序列(登录号:NM_001101199.1),使用Primer 5.0设计引物(表1)。由金斯瑞生物科技公司合成。反应体系为25 μL,其中ddH2O 9.5 μL,Premix TaqTMDNA聚合酶12.5 μL,上、下游引物各1.0 μL,cDNA 1.0 μL。扩增条件:95 ℃预变性30 s;95 ℃变性30 s,59 ℃退火30 s,72 ℃延伸40 s,30个循环;72 ℃ 5 min。1.5%凝胶电泳检测产物,紫外光照切下目的条带,并回收目的DNA。将pMDTM19-T载体与胶回收产物在16 ℃的金属浴中连接15 h后,转换于感受态细胞,二者混合培养1 h后离心。将沉淀均匀涂于LB固体培养基(AMP+)上,37 ℃培养12 h,选取单菌落,摇床振荡培养8 h,进行PCR筛选阳性菌液送由Sangon Biotech公司测序。
1.5 牦牛AQP2基因生物信息学分析
使用NCBI中的Blast在线工具获得AQP2基因的核苷酸序列,通过ORF Finder(ORF)预测其氨基酸序列。使用在线软件分别预测牦牛AQP2蛋白的基本理化性质(ProtParam)、亲疏水性(ProtScale)和二级结构(PredictProtein)。使用Megalign软件比对物种同源性。
1.6 牦牛AQP2基因组织表达谱分析
根据已获得的牦牛AQP2和NCBI中黄牛GAPDHmRNA序列(登录号:AC_000162.1)分别设计引物(表1),采用qRT-PCR方法检测该基因在牦牛各组织的表达量。反应体系为15 μL:ddH2O 5.5 μL,SYBR®Premix Ex TaqTMⅡ 7.5 μL,cDNA 1.0 μL,上、下游引物(10 μmol/L)各0.5 μL。扩增条件:94 ℃预变性3 min;94 ℃变性10 s,60 ℃退火10 s,72 ℃延伸15 s,40个循环。2-ΔΔCt法均一化处理结果。
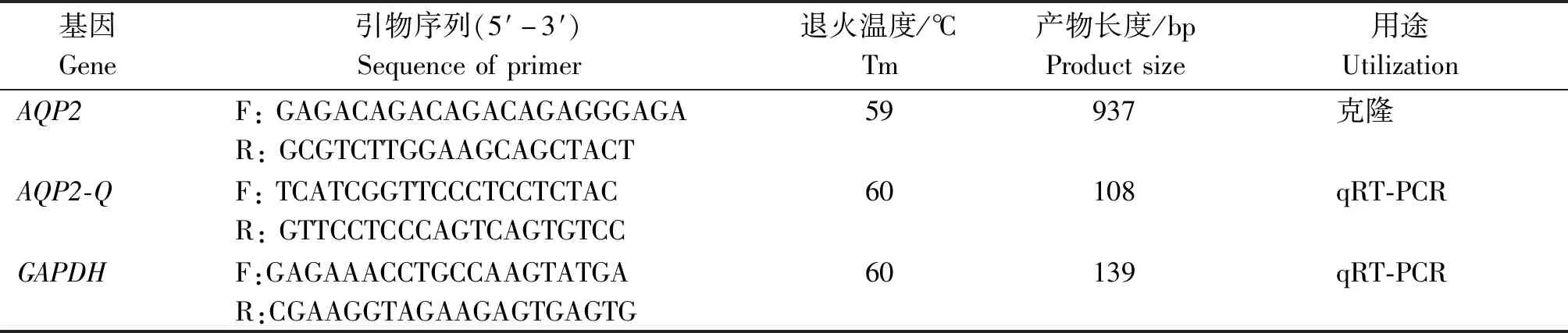
表1 引物序列及PCR反应条件Tab.1 Primer sequences and reaction conditions
1.7 AQP2在牦牛睾丸中的定位
通过免疫组化法检测AQP2蛋白的定位。从4%多聚甲醛固定液中取出性成熟时期的牦牛睾丸组织,并制成石蜡切片。脱蜡复水后封闭在H2O2(0.88 mol/L)中,PBS(0.01 mol/L,pH值7.4)冲洗3次;5%胎牛血清封闭,滴加一抗(单克隆兔抗AQP2,BSA 500倍稀释,Abcam公司产品)孵育过夜(4 ℃);PBS(0.01 mol/L,pH值7.4)冲洗3次后滴加二抗(多聚化山羊抗兔IgG,Abcam公司产品)孵育2 h(37 ℃);PBS(0.01 mol/L,pH值7.4)冲洗,DAB显色,复染,脱水、透明、封片,镜下观察。
1.8 牦牛雄性生殖道中AQP2的表达模式
同样以GADPH为内参基因,利用qRT-PCR检测AQP2在牦牛雄性生殖道的3个阶段(胎儿时期、幼年时期、性成熟时期)的表达水平,反应体系同1.6。
1.9 数据分析
每组试验至少检测3次,数据使用“平均值±标准误(Mean±s)”表示。SPSS软件分析显著性,P<0.05差异显著,P>0.05差异不显著。
2 结果与分析
2.1 牦牛AQP2基因的克隆
以牦牛肾组织总cDNA为模板,进行扩增AQP2基因的CDS区,经凝胶电泳检测,获得937 bp大小的条带,对其进行测序并拼接所得序列,结果显示,其CDS区为816 bp,共编码271个氨基酸。
将牦牛AQP2基因与其他物种通过Megalign软件进行同源性比对发现,牦牛AQP2mRNA序列与其他哺乳动物的相似度极高,均在90%以上(图1)。牦牛AQP2基因序列与黄牛、水牛、山羊、藏羚羊、绵羊的相似性分别为99.9%,98.9%,97.3%,97.3%,97.2%。同时对14个物种AQP2基因CDS区进行系统进化树构建,结果显示,该基因CDS区序列具有很高的保守性,与牦牛亲缘关系最近是黄牛,其次是水牛、山羊等(图2)。由此可见,AQP2基因在物种进化过程中表现高度保守,且多为同义突变。
2.2 牦牛AQP2蛋白结构和功能预测
通过ExPASy工具进行预测AQP2蛋白的理化性质。得到该蛋白分子式为C1322H2080N352O360S7,半衰期为30 h,分子量为28.889 62 ku,等电点为6.70,脂肪族系数为115.94,不稳定系数为43.04,推测为酸性不稳定蛋白。该蛋白包含20种氨基酸,出现频率较高的有Leu(14.8%)、Ala(13.3%)、Val(9.6%)、Gly(8.1%)和Ser(7.0%)。带正电荷氨基酸(Arg+Lys)有17个,带负电荷氨基酸(Asp+Glu)有18个,由此表明,该蛋白整体带负电。疏水性预测发现,牦牛AQP2蛋白的平均亲水指数为0.547,最大疏水指数存在于20,21位点(2.789),最小亲水指数存在于251位点(-3.089),为疏水性蛋白。
SignalP和TMHMM预测发现AQP2蛋白具有6个跨膜结构域,在第31-32位氨基酸存在信号肽。磷酸化位点预测显示,AQP2蛋白共有17个磷酸化位点,包含Ser(11个)、Thr(5个)、Tyr(1个)。二级结构预测显示,该蛋白的α-螺旋占41.33%,β-转角占2.95%,无规卷曲占37.27%,延伸链占18.45%。
2.3 牦牛AQP2基因的组织表达谱
利用qRT-PCR,参照GAPDH,对AQP2基因在牦牛心、肝、脾、肺、肾、脑、睾丸、附睾组织中的表达模式进行检测(图3)。结果显示,牦牛各组织中AQP2差异表达,以附睾AQP2的表达量为参考,其在睾丸和肾中的表达水平显著高于其他组织(P<0.05),附睾、脾、心、肝、肺、脑中该基因表达水平无显著差异(P>0.05)。
2.4 牦牛睾丸中AQP2蛋白的表达与定位
免疫组化检测牦牛睾丸中AQP2的定位结果见图4。棕黄色或黄色着色判定为阳性细胞,主要定位于圆形精子细胞,而其他生精细胞、间质细胞、上皮细胞以及支持细胞均未见阳性反应。
2.5 不同发育时期牦牛雄性生殖道中AQP2基因的表达
利用qRT-PCR,参照GAPDH,对AQP2基因在不同时期牦牛雄性生殖道中的表达情况进行检测(图5)。结果显示,AQP2基因在牦牛雄性生殖道发育过程中表达呈动态变化。其中,在睾丸和输精管中该基因从胎儿到性成熟时期,即随着年龄增长,其表达水平呈明显的上升趋势。以该基因在胎儿时期睾丸中的表达量作为参考,幼年和性成熟时期显著高于该时期(P<0.05)。AQP2基因在附睾及精囊中基本不表达,而在输精管中高表达,性成熟时期其表达量达到最高,约为胎儿时期的12.3倍(P<0.05)。该基因在胎儿期前列腺中的表达量较高,随生长发育的进行,其表达水平稍有降低,但差异不显著(P>0.05)。
3 讨论与结论
AQP2,血管加压素依赖性组成型水通道蛋白,主要受抗利尿激素血管加压素(ADH)的调节,通过cAMP/PKA信号转导的级联反应使水通道AQP2磷酸化,从而调节主要细胞对水的跨上皮重吸收[22-23]。除此之外,AQP2还受泛素化、糖基化等其他多种修饰[24-25]。研究表明,许多水通道亚型在哺乳动物雄性生殖系统发育和精子浓度方面发挥关键作用。例如,AQP1参与调节小鼠雄性生殖生理过程中的水稳态[26]。AQP3基因敲除小鼠的精子细胞显示出正常的运动性,但其在输卵管中的迁移能力受损,导致雄性生育能力降低[27]。此外,AQP1、2和7在成年犬雄性生殖道中差异表达,对犬的雄性生育能力同样至关重要[28]。最近研究发现,AQPs的功能还与细胞体积的控制有关,可通过在附睾液中发生渗透性变化或在精子成熟过程中参与细胞质去除阶段,从而调控细胞体积[6]。因此,探索AQP2在牦牛雄性生殖道发育过程中的表达规律将对解析其在牦牛雄性生殖中的作用机制奠定基础。
本试验获得了牦牛AQP2基因的核苷酸序列。比较分析结果显示,AQP2序列在哺乳动物中的同源性相对较高。同时发现,黄牛、水牛与牦牛AQP2的氨基酸序列高度吻合,由此可见,AQP2在蛋白质结构水平上及物种进化过程中具有较高保守性。进而推测AQP2氨基酸序列及其蛋白功能的稳定性对协调生物体适应其生存环境是必要的。
本试验采用qRT-PCR的方法检测到AQP2基因在牦牛组织中的表达水平存在差异。结果表明,AQP2mRNA在睾丸和肾中的表达水平显著高于其他组织,附睾和脾中的表达相对较低。Nelson等[29]研究发现,AQP2在小鼠肾集合管、输精管上皮细胞和睾丸内的生精小管中高表达,这与本试验结果吻合。为进一步确认AQP2蛋白在牦牛睾丸中的细胞定位,本试验采用免疫组织化学技术对牦牛睾丸AQP2的表达进行了检测,发现睾丸中仅圆形精子表达AQP2蛋白。Klein等[30]发现AQP2在马曲细精管的圆形精子细胞中表达,推测该基因可能参与精子发生过程中精子的变态成形阶段。该基因在肾和睾丸中表达量高的原因可能与其各自的生物学功能有关,肾中水的重吸收以及睾丸中的生精过程对水浓度的要求比较高,因此,负责水转运的AQP2在两者中显著表达,以上结果提示AQP2基因可能通过调节水重吸收和/或精子转运过程中液体形成和精子发生等过程,从而对牦牛睾丸发育起重要作用。
本研究检测了不同发育阶段雄性牦牛生殖器官中AQP2的表达。qRT-PCR结果显示,在雄性牦牛生殖道发育过程中AQP2基因的表达呈现动态变化。该基因mRNA在睾丸和输精管中从胎儿到性成熟期的表达水平随年龄依赖性逐渐增加,直至性成熟时期其表达量达到最高。其表达趋势与精母细胞减数分裂的开始和圆形精子的发生等过程相一致,表明该基因可能与精子形成以及后续的精子运输有关。已有研究发现,在输精管和曲细精管的主要细胞中AQP2高表达,但在附睾中不存在[28]。Da silva等[31]发现,AQP2蛋白在出生后的幼年期大鼠附睾尾部短暂表达,尽管存在mRNA,但在成年大鼠附睾中不表达,这与本试验结果基本吻合,而另一研究发现AQP2蛋白在兔的附睾中表达较高[32],这可能与物种间的差异相关。Ramli等[33]发现睾酮可通过上调AQP2的表达水平来促进输精管液分泌速率的增加,从而对输精管液体内稳态有重要作用,以确保正常的雄性生育能力。AQP2是输精管中不受血管加压素调节的组成型顶膜蛋白,在输精管中高表达,可能是由于其参与改变腔内液体含量的过程,通过提取腔内液体进入输精管来改变精子浓度。因此,AQP2在睾丸和输精管中的表达水平可能随着生殖道的发育和睾酮的增多而逐渐升高,促使精子成熟。而该基因在胎儿时期的前列腺中高表达,后随生长发育的进行逐渐降低。这一结果与文献报道一致[34]。以上结果表明,雄性生殖系统中AQP2的功能可能与维持适当的腔内环境有关,精子可以在该环境中进一步成熟。
本研究克隆获得了牦牛AQP2基因序列,其具有显著的组织特异性表达,且在生物进化过程中高度保守。在睾丸中AQP2蛋白主要定位于圆形精子细胞,且该基因在牦牛雄性生殖道中表达模式存在显著差异,提示AQP2可能与牦牛精子发生、运输及睾丸生殖功能完善相关,具体作用机制有待进一步研究。

