云南大理地区吉兰-巴雷综合征临床及神经电生理特点的单中心研究
杨玲艳 戴国林 李丹丹 曹丽丽 张晓燕
1大理大学第一附属医院神经电生理室 云南省 671000
2大理大学第一附属医院神经内科 云南省 671000
吉兰-巴雷综合征(Guillain-Barré syndrome,GBS)是一种免疫介导的急性多发性周围神经病,是造成急性驰缓性麻痹的最常见的病因,临床表现为急性进展性对称性四肢无力,并常累及颅神经及自主神经,出现相应神经功能障碍。多数患者有呼吸道或消化道的前驱感染症状。根据2019年中国吉兰-巴雷综合征诊治指南[1],GBS可分为急性炎症性脱髓鞘性多发性神经病(acute inflammatory demyelinating polyneuropathy,AIDP)、急性运动轴索性神经病(acute motor axonal neuropathy,AMAN)、急性运动感觉轴索性神经病(acute motor sensory axonal neuropathy,AMSAN)、Miller-Fisher 综合征(Miller-Fisher syndrome,MFS)、急性泛自主神经病(acute panautonomic neuropathy,APAN)和急性感觉神经病 (acute sensory neuropathy,ASN)等亚型。也有学者认为GBS谱系疾病还包含颅神经型(cranial nerve variants,CNV)、颈-咽-臂型、Bickerstaff 脑干脑炎(Bickerstaff brainstem encephalitis,BBE)等一系列相关疾病[2]。据报道,GBS在不同地域具有不同的临床表型和神经电生理特征,不同地区 GBS 各亚型所占比例及预后差异较大。AIDP是欧美国家最常见的亚型,AMAN相对少见,而在亚洲AMAN 较为常见[3]。以往的研究报道我国以儿童和青年病例为主,多发于夏秋季,我国北方发病的主要类型为AMAN[3-4],而我国地域广阔,南、北方GBS患者的临床特点是否存在差异,已有对淮河以南地区的多中心研究显示,中国南方GBS患者以脱髓鞘亚型为主,而轴突型的比例明显低于中国北方(65%~78%)[5]。也有报道称中国南方地区的GBS以经典型即AIDP为主,其出现率比中国北方地区要高,比例类似于欧美等国[6]。为探讨云南大理地区吉兰-巴雷综合征及其谱系疾病的临床及电生理特点,本研究收集整理了63例GBS患者的临床资料,进行回顾性分析总结。
资料与方法
一、研究对象
对2012年1月至2019年12月就诊于大理大学第一附属医院的63例GBS患者的临床资料及神经电生理结果进行回顾性分析。纳入标准:均符合Asbury和Cornblath[7]诊断标准及2019年中国吉兰-巴雷综合征诊治指南的GBS诊断标准[1]:①诊断所必需的表现:进行性双侧上下肢无力(可能仅从双下肢无力开始);腱反射消失或减弱(若患者临床表现及辅助检查高度支持GBS的诊断,即使患者腱反射正常也予纳入)。②高度支持的表现:症状在数天至4周内进行性发展;肢体无力症状较对称;感觉症状或体征轻微;双侧面肌无力等颅神经受累症状;自主神经功能障碍症状;肢体疼痛、麻木;脑脊液蛋白含量升高而白细胞数正常,呈蛋白-细胞分离现象;典型的电生理表现。排除标准:入院后不愿进行相关检查及治疗的患者;存在其他原因可能导致的急、慢性周围神经病患者;病情复发的患者。依据Hughes等[8]提出的GBS分级标准将所有入组患者分为轻型和重型。病情严重程度的分型则根据病情达到高峰时的评分来界定[9]。评分采用的标准为休斯功能分级量表(Hughes functional grading scale,HFGS):6分为死亡;5分为需要呼吸机辅助呼吸;4分为卧床;3分为步行5 m需要帮助;2分为可自行行走;1分为轻微症状或体征;0分为正常。轻型HFGS评分≤2分,重型>2分。
二、研究方法
本研究为回顾性研究,研究参数主要针对患者的病程、起病方式、首发症状、临床表现及病情演变、脑脊液结果和神经传导检测结果及相关分型等方面进行分析总结。
三、神经电生理检测
采用Dantec Keypoint 4型肌电图/诱发电位仪,所有患者均进行神经传导速度(nerve conduction velocity,NCV)和针电极肌电图(EMG)检测。EMG使用一次性同心圆针电极,上肢选择拇短展肌、小指展肌、第Ⅰ背侧骨间肌、三角肌等,下肢选择胫前肌、股四头肌等进行检测。EMG检测的内容包括:①插入电位;②肌肉完全放松时观察有无自发电位;③轻收缩时一般测定20个以上运动单位电位(motor unit potential,MUP)的时限、波幅、多相波、面积和SI;④大力收缩时主要观察募集相及其幅度。神经传导测定:运动神经主要包括正中神经、尺神经、胫神经、腓总神经,感觉神经主要检测正中神经、尺神经、腓肠神经、腓浅神经,同时包括F波、H反射等。如果考虑MFS或BBE应加做瞬目反射,以了解面神经和三叉神经的情况;如果怀疑多灶性运动神经病,还应做节段性运动神经传导检查排除。所有患者的EMG和NCV测定的正常值以汤晓芙所测正常值为标准[10]。异常标准采用中华医学会神经病学分会2019年制定的电生理制定标准[1]:⑴ 运动神经传导 至少有2根运动神经存在下述参数中的至少1项异常,a. 远端潜伏时较正常值上限延长25%以上;b. 运动神经传导速度较正常值下限减慢20%以上;c. F波潜伏时较正常值上限延长20%以上和/或出现率下降;d. 运动神经部分传导阻滞,即周围神经近端与远端比较,复合肌肉动作电位负相波波幅下降20%以上,时限增宽<15%;e. 波形离散,即周围神经近端与远端比较,复合肌肉动作电位负相波时限增宽15%以上。⑵ 感觉神经传导 经典GBS、AMAN及颅神经型一般正常,异常时要考虑AMSAN、ASN等类型。⑶ 针电极肌电图 起病10 d至2周后肌电图可检测到异常自发电位,随着神经再生则可出现MUP时限增宽、波幅增高以及多相波增多。
四、统计学方法
结 果
一、临床资料
年龄分布 共纳入63例GBS患者,男35例,女28例;年龄10~75岁,其中10~20岁5例,20~30岁8例,30~40岁15例,40~50岁22例,50~60岁6例,60~75岁 7例。
病程 急性起病46例,亚急性起病17例。入院时病程 1~7 d 26例,8~14 d 15例,15~21 d 9例,22~28 d 3例,29~35 d 4例,36~42 d 4例,43~49 d 2例。
前驱事件 发病前1~4周“感冒”史22例,腹泻10例,发热5例,恙虫病后起病1例,头部外伤行硬膜外血肿清除术后起病1例,断指再植术后起病1例,发热伴皮疹1例,I型糖尿病酮症酸中毒昏迷后起病1例。既往有其他基础疾病者:尿毒症血液透析治疗中2例,慢性乙肝失代偿2例,甲亢2例,系统性红斑狼疮-狼疮性肾炎、血液系统损害1例,隐性梅毒1例。
首发症状 首发症状以四肢对称性无力起病32例,双下肢无力起病15例,双上肢无力起病4例;颅神经损害症状起病12例,其中双侧面神经损害5例、单侧面神经损害2例,舌咽迷走神经损害2例,外展神经损害1例,动眼神经损害1例;伴有主观肢体麻木28例,肌肉疼痛14例,自主神经症状3例(阵发性出汗、心悸1例,皮肤划痕征阳性1例,头晕1例),呼吸功能不全3例。
腱反射 腱反射消失36例,减弱20例,正常7例(均为颅神经损害起病者)。肢体麻木主观有肢体麻木或疼痛、浅感觉检查减退20例、感觉过敏4例,主观感觉麻木或疼痛但感觉检查正常12例,无感觉障碍27例。
病情轻重分型 本组轻型26例(41.3%),重 型 37例(58.7,%)。 其 中 AIDP、AMAN、AMSAN各亚型重型患者分别为6例(16.2%)、11例(29.7%)和18例(48.6%),差异具有统计学意义(P<0.05)。
其他 合并低钾血症者11例,血清钾2.9~3.3 mmol/L,合并低钠血症2例;合并肌酶增高1例(CK 5048 U/L,CK-MB 248 U/L,LDH 395 U/L,HBDH 291 U/L);合并类风湿因子、C反应蛋白增高1例(RF 553 IU/ml,CRP 100.44 mg/L);合并皮疹、皮肤瘙痒1例;病程急性期出现肌肉萎缩7例,均为不同程度双手第一骨间肌、大小鱼际肌、前臂肌和胫骨前肌萎缩。
二、脑脊液结果
入组的63例患者中有48例行腰椎穿刺脑脊液检查,从发病到进行脑脊液检查的时间为4~52 d,所有患者脑脊液细胞数在正常范围或轻度增高(5~10)×106/L,蛋白水平正常12例,升高36例(0.545~1.906)g/L,符合蛋白-细胞分离表现。常规涂片未发现病原菌感染。
三、神经电生理结果
63例患者均进行神经传导检测和F波检测,可发现神经传导速度减慢,动作电位波幅正常或下降,F波或H反射延迟或消失。41例患者行针电极肌电图检测,其中26例未发现明显异常,15例患者存在不同程度的神经源性损害,结果见表1。
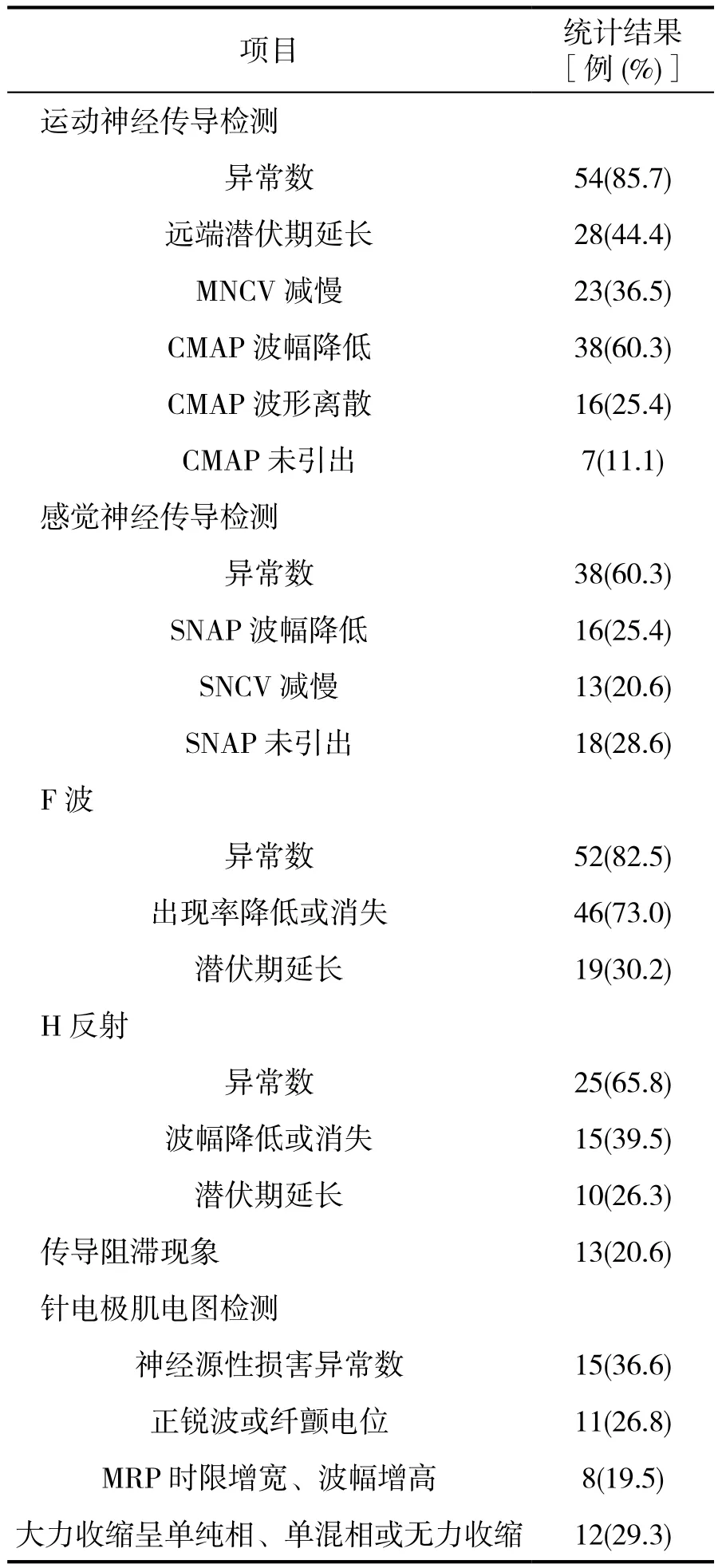
表1 63例患者的神经电生理检测结果
四、GBS分型结果
经典型GBS(AIDP)16例(25.4%),AMAN 15例(23.8%),AMSAN 22例(34.9%),MFS 5例(7.9%),ASN 2例(3.2%),BBE合并GBS 2例(3.2%),颈-咽-臂型1例(1.59%)。AMSAN、AMAN组的病情明显重于AIDP组和其他组。
讨 论
GBS是1916年由Guillain Barre等提出的一组具有高度异质性的急性自身免疫性神经疾病,主要特点为急性四肢迟缓性肌无力、反射降低或消失、病情进展期多在2周,脑脊液蛋白细胞分离。AIDP一直被认为是GBS的代名词,近年来,随着研究的不断深入,特别是神经电生理学和神经病理学的发展,人们开始逐渐认识到GBS有很多变异型,并陆续发现一系列类似GBS局部症状的疾病,由于该类疾病临床症状时有重叠,因此将以往提出的AIDP称为GBS经典型,并与其他变异型构成一个病因和病理生理相关联的疾病谱系即GBS谱系疾病。
在电生理检测中,一般认为神经传导速度的减慢可提示脱髓鞘改变,而远端复合肌肉动作电位(compound muscle action potentials,CMAP)的波幅降低是轴索损害的指标。严重脱髓鞘病变伴有传导阻滞时可继发轴索损害,或者由于传导速度的明显减慢,也可以导致波幅降低。
AIDP主要前驱事件为呼吸道感染,常急性起病, 一般在数天内达到高峰, 也可表现为爆发性起病, 可于24~48 h累及呼吸肌。临床上以进行性、对称性肌肉无力为特征, 通常腱反射减弱或消失。患者常有主观的四肢末端手套、袜套样感觉障碍,但较少客观检查证据,也无感觉障碍平面。神经电生理检测提示运动和感觉神经呈脱髓鞘表现,即神经传导速度减慢、远端潜伏期延长和CMAP时限增宽,波幅减低不明显[11]。
AMAN即急性运动轴索性神经病,为典型的轴索型GBS,又称单纯运动型GBS。AIDP与AMAN在临床表现上无明显差异,病理特点是二者的根本区别。AIDP的主要特点是病理表现为周围神经干、神经根急性水肿,多灶性、节段性髓鞘脱失。AMAN的病理改变是运动神经的轴索沃勒变性、坏死,故神经电生理检测呈现运动神经CMAP波幅明显降低或电位消失。一般情况下,临床上AMAN常较AIDP严重,常伴有呼吸肌受累,肌肉萎缩出现较早,恢复较差[11]。
AMSAN即急性运动感觉轴索型神经病,临床上较少见,是一种同时累及运动和感觉神经的严重的轴索性传导障碍。此型患者大多病情重、预后差,颅神经及呼吸肌受累较多见,重者可危及生命。神经电生理改变为早期出现的运动神经和感觉神经轴索损害,即CMAP和SNAP波幅明显降低或完全引不出电位,但不伴有明显的脱髓鞘改变。
Miller-Fisher 综合征的主要表现为眼肌麻痹、腱反射低下和共济失调三联征,有时伴肢体瘫痪及感觉障碍,急性或亚急性起病,也可进展为典型GBS,四肢周围神经和颅神经的电生理检测呈现脱髓鞘改变。
ASN比较少见,呈急性起病,数天或者数周达高峰,表现为广泛的对称性四肢麻木,可伴有疼痛以及感觉性共济失调,腱反射减低或消失。神经电生理检测感觉神经传导速度可轻度减慢,主要为SNAP 波幅明显下降或电位消失。运动神经传导有时可见脱髓鞘改变。针电极肌电图一般正常[12]。
本组患者均为云南大理地区居民,研究显示AMSAN占34.9%,为本组GBS主要亚型,其次为AIDP(25.4%)和AMAN(23.8%),其他各型较少见。此与既往报道的各型比例差异明显,值得进一步探讨。
本组GBS急性起病46例(73.2%),亚急性起病17例(27.0%),前驱事件主要为上呼吸道感染(34.9%)和腹泻(15.9%),与既往报道相似[4,13]。本组GBS中尚有由一些少见诱因引起,如头部外伤手术、断指再植手术、I型糖尿病酮症酸中毒、系统性红斑狼疮、慢性乙肝、尿毒症等,既往已有报道[14]。本组1例由恙虫病感染引起,高热1周后发现腹股沟焦痂,当地诊断“恙虫病”,治疗1周后体温正常,但出现全身麻木无力、言语不利、吞咽困难、进食呛咳等症状,转入我院后立即行神经电生理检测提示AIDP,脑脊液存在蛋白-细胞分离现象也支持诊断。后期因病情进行性加剧,出现呼吸功能障碍而入ICU治疗。2个月后复查神经电生理,仍呈脱髓鞘改变。本例的发生,考虑感染后引起的相关免疫应答,从而诱发了GBS。其具体的发病机制值得进一步研究。
神经电生理检测对于诊断GBS及分型具有重要价值,GBS常见的电生理主要表现为CMAP潜伏期延长及NCV减慢 、F波潜伏期延长、传导阻滞[7]。本研究显示,运动神经传导、感觉神经传导的异常率分别为85.7%和60.3%,F波异常率达82.5%,这三个参数,特别是F波的早期异常率是早期诊断GBS及分型的敏感指标。本组感觉神经传导的异常率达到60.3%,与我国东北地区所报道的29%异常率[15]存在显著差异,提示本地区GBS亚型分布具有其特殊性。
不同类型的GBS病情轻重程度不同,本研究AMSAN、AMAN组的病情明显重于AIDP组,与文献报道一致[3,12]。3组患者的临床表现无明显差异,早期确诊分型必须依靠神经电生理检测。本文通过电生理诊断报告2例ASN,均以急性进行性四肢麻木疼痛-无力起病,其电生理检测运动神经传导速度均无异常,但感觉神经动作电位均未引出,1例患者伴上肢F波潜伏期延长。
神经电生理检测对预后判断也有至关重要的作用,轴索型或混合型的电生理特征常常提示预后不佳。

