基于候选基因开发gSSR标记加密黄花菜和萱草种间遗传图谱
高阳 侯非凡 熊雄 公菲菲 王金耀 邢国明 李森


摘要: 为了更加精准地开展黄花菜基因组组装和性状定位,在课题组前期构建的大同黄花×摇篮曲种间遗传图谱的基础上,基于大同黄花全基因组和转录组数据库,针对秋水仙碱及昼夜节律2个关键性状所涉及的候选Unigene开发基因组SSR标记,进一步通过55个F1后代加密图谱。结果表明,新开发的95个gSSR标记中有46个标记在亲本及子代间具有多态性,多态性比例为48.42%,有22个gSSR标记到图谱上,同时有12个前期未上图的EST-SSR标记加密到新图谱。加密后的遗传图谱包含255个标记,由9个连锁群组成,总图距为3 142.64 cM,平均图距为11.88 cM,各连锁群标记数量为5~58个。研究结果为进一步研究黄花菜秋水仙碱含量及昼夜节律的功能基因定位奠定了重要基础。
关键词: 黄花菜;gSSR;标记开发;图谱加密
中图分类号: Q755 文献标识码: A 文章编号: 1000-4440(2021)01-0139-11
Enhancement of the interspecific genetic map density for Hemerocallis citrina and H. fulva by developing gSSR markers based on candidate genes
GAO Yang1,2, HOU Fei-fan1,2,3, XIONG Xiong1,2, GONG Fei-fei1,2, WANG Jin-yao1,2,3, XING Guo-ming1,2,3, LI Sen1,2,3
(1.College of Horticulture,Shanxi Agricultural University,Taigu 030801,China;2.Datong Huanghua Industry Development Research Institute,Datong 037004,China;3.Collaborative Innovation Center of Quality and Profit Improvement for the Facility Vegetables of Shanxi Province,Taigu 030801,China)
Abstract: To carry out genome assembly and character mapping of Hemerocallis citrina more accurately, genomic simple sequence repeats (SSR) markers were developed for the candidate Unigenes involved in two key characters (colchicine and circadian rhythm), on the basis of the interspecific genetic map of DatongHuanghua×Lullaby Baby constructed by our research group previously and the whole genome and transcriptome database of DatongHuanghua. The map density was further enhanced through 55 F1 progenies. The results showed that 46 of the 95 newly developed gSSR markers were polymorphic between parents and offsprings, with a polymorphic ratio of 48.42%. 22 gSSR markers were added to the map, while 12 EST-SSR markers not mapped earlier were added to the new map. The updated genetic map contained 255 markers which was composed of nine linkage groups. The total map distance was 3 142.64 cM, and the average map distance was 11.88 cM. The number of markers in each linkage group ranged from 5 to 58. The results can make important foundation for further study on colchicine content and functional gene mapping of circadian rhythm in H.citrina.
Key words: Hemerocallis citrina;gSSR;marker development;density enhancement of the genetic linkage map
萱草屬(Hemerocallis spp.)植物是世界著名的宿根花卉之一,Li等[1]将155个萱草属植物品种分为黄花菜(Hemerocallis citrina)等夜间开花类群和萱草(Hemerocallis fulva)等白天开花类群。黄花菜花蕾营养价值丰富,又名“金针菜”,是一种重要的药食兼用型功能蔬菜[2-4],产量、品质和营养成分含量是其重要的育种目标,黄花菜中富含多种次生代谢物,这些物质在现代医学及生物学研究中发挥着重要作用[5]。黄花菜新鲜花蕾中含有次生代谢物秋水仙碱[6-7],有报道显示鲜食黄花菜可能产生中毒现象,导致腹泻等不良反应[8]。萱草花色、花型丰富,耐干旱瘠薄,是重要的园林绿化材料,其育种主要围绕改良观赏性状、提升观赏价值来进行[9],萱草的观赏性主要体现在花器官,而萱草属植物花器官存在明显的昼夜节律现象,该现象成为影响其观赏性的重要因素。综上,在黄花菜与萱草育种过程中,次生代谢物含量和花器官昼夜节律现象是2个值得重点关注和研究的性状。由于萱草属植物为宿根植物,新品种多通过自然发现新优性状种质后无性扩繁获得,育种存在盲目性和随机性。分子标记辅助选择育种是开展多年生植物新品种选育的有效手段,性状选择有针对性,育种年限可大幅缩短。其中,高密度遗传图谱是开展重要农艺性状分子标记辅助育种的重要基础。
萱草属植物遗传背景较为复杂[10],童期较长,制作高代自交系难度较大,截至目前仅发表了2张本属植物的遗传图谱。侯非凡[11]于2017年基于大同黄花(Hemerocallis citrina cv. DatongHuanghua)轉录组数据,利用“拟测交”策略构建了1张包含199个EST-SSR(表达序列标签微卫星)分子标记、11个连锁群的黄花菜种内遗传图谱,总图距为2 522.34 cM,标记间平均图距为12.68 cM;同时构建了1张黄花菜与萱草种间遗传图谱,包含222个EST-SSR分子标记、11个连锁群,总图距为2 485.59 cM,标记间平均图距为11.20 cM。2张图谱标记数量有限,标记开发缺乏一定的针对性。
本研究基于课题组前期已获得的大同黄花全基因组数据及转录组数据,使用秋水仙碱及昼夜节律所涉及的代谢通路上的候选Unigene与基因组数据进行比对,开发与这2个性状相关的基因组gSSR(基因组SSR)标记,对侯非凡[11]构建的黄花菜与萱草种间遗传图谱进行加密,旨在获得1张密度更高的黄花菜与萱草种间遗传图谱,为黄花菜和萱草的关键性状基因定位和QTL(数量性状座位)分析奠定基础。
1 材料与方法
1.1 gSSR标记开发
1.1.1 基于转录组数据的候选Unigene筛选 结合课题组已有的转录组数据库[1](NCBI项目编号为PRJNA628147;登录号为SRR11610941、SRR11610942和SRR11610943),根据测序数据所得Unigene在KEGG数据库中的功能注释结果,筛选功能注释于秋水仙碱(编号:ko00950)和昼夜节律(编号:ko04712)2条代谢通路中的Unigene作为候选基因。
1.1.2 基于基因组的候选Scaffold序列获取 结合课题组大同黄花全基因组De Novo测序结果(基因组序列未发布),使用Blastn 2.2.31软件将候选Unigene与基因组序列进行比对,设软件中E-value等参数为默认值,筛选其中最佳的Scaffold序列。根据筛选结果,使用faSomeRecords脚本(http://hgdownload.cse.ucsc.edu/admin/exe/linux.x86_64/)提取基因组中目标Scaffold序列,统计各候选Unigene比对到基因组Scaffold上的区间位置信息,将每个比对位点上游、下游各扩展3 kb序列,使用BioEdit软件将此区间序列导出。
1.1.3 SSR识别及引物设计 本研究采用SSRHunter1.3软件识别候选Scaffold序列中的SSR位点[12]。设置构成重复元件的核苷酸数最多为6个,重复次数最少为5次,进行SSR位点识别。SSR基序分析参考Zhang等[13]的方法。使用Primer Premier 5进行引物设计,主要参数:引物长度为20~26 bp,退火温度(Tm)为58~62 ℃,(G+C)含量为45%~55%,PCR扩增产物大小为150~300 bp,引物均由南京钟鼎生物技术有限公司合成。
1.2 萱草属植物种间遗传图谱的加密
1.2.1 作图亲本及作图群体 作图群体引自课题组前期以黄花菜地方品种大同黄花作为杂交母本,萱草园艺品种摇篮曲(Hemerocallis fulva Lullaby Baby)作为杂交父本(图1)构建的55株F1代群体[11],亲本材料在开花时间、花色与花型上具有较大差别,且在所有的种间杂交组合中,大同黄花×摇篮曲组合的坐果率与萌发率较高,收获了最多的F1杂交子代,因此使用大同黄花、摇篮曲作为构建黄花菜和萱草种间遗传图谱的亲本,亲本及杂交F1代群体现保存于山西农业大学萱草种质资源圃内。
1.2.2 DNA提取 采取改良CTAB(十六烷基三甲基溴化铵)法[11]提取亲本及55个F1子代DNA,通过1%琼脂糖凝胶电泳检测DNA完整度,使用NanoDrop Spectrometer检测DNA浓度与纯度,合格样品于-20 ℃冰箱存放备用。
1.2.3 SSR引物筛选及扩增 本试验中所有gSSR引物均来自1.1.3中Primer Premier 5的设计结果,标记名称延续冀芳芳[14]的命名方式,以sau开头,顺次编号为sau01169、sau01170等。利用母本大同黄花和父本摇篮曲及从F1代中随机选取的4个子代共6个样品来筛选多态性SSR引物。PCR扩增、PCR扩增产物凝胶电泳检测、SSR标记分离检测、读带数据处理等参照侯非凡[11]的方法。
1.2.4 图谱加密 利用Joinmap 4.1软件对新开发的gSSR标记及原始图谱构建时所使用的标记进行分析和作图,从而加密原始种间遗传图谱。
2 结果与分析
2.1 候选Unigene的筛选
秋水仙碱属于异喹啉类生物碱,共有20个Unigene注释到秋水仙碱生物合成所在的异喹啉类生物碱代谢通路中,其在KEGG数据库中的通路编号为ko00950。结合转录组数据中基因功能注释结果,20个Unigene所注释到的酶均为秋水仙碱合成通路中所涉及的关键酶(表1)。
基于植物昼夜节律代谢通路图(KEGG数据库编号为ko04712),其中心振荡环上共有6个基因,分别为CCA1、LHY、TOC1、APRR1、ZTL、GI。结合转录组数据中基因功能注释结果,共18个Unigene注释为这6个基因。由于本试验基于拟南芥LHY基因的CDS(编码序列)对Unigene库进行BLAST分析,未直接注释到LHY基因的c56440.graph_c0与拟南芥中的LHY基因序列相似度较高,所以将此Unigene也加入到候选Unigene范围(表1)。
综上,共有39个Unigene成为本试验候选Unigene。
2.2 候选Scaffold序列比对结果
39条候选Unigene的BLAST报告筛选结果表明,与秋水仙碱合成通路相关的20条Unigene中共有9条比对到了基因组序列上,涉及16条Scaffold序列;与植物昼夜節律代谢通路的中心振荡环相关的19条Unigene中共有11条Unigene比对到了基因组序列上,涉及35条Scaffold序列(表2)。综上,共得到51条候选Scaffold序列。其中与昼夜节律相关的c58223.graph_c0比对到的Scaffold序列最多,为8条。c56932.graph_c0和mergeScaf2663序列相似性最高,比对分数为3 781分,c56403.graph_c0的比对分数最低。
根据各候选Unigene比对到基因组Scaffold上的区间位置信息,将每个位点上下游各扩展3 kb序列,即区间共扩展6 kb序列,候选序列在各Scaffold自5′端到3′端的位置信息如表2所示。
2.3 候选Scaffold序列中SSR基序的鉴定
SSRHunter 1.3检测结果表明,有36条Scaffold检测到了SSR位点,其中与秋水仙碱相关的Scaffold为11条,与昼夜节律相关的Scaffold为25条。在上述36条Scaffold序列中共有95个gSSR位点,其中mergeScaf17449包含最多的gSSR(12个),其次是mergeScaf1943(8个),有9条Scaffold只能检测到1个gSSR位点(图2)。
此外,在检测到的95个gSSR位点中,基序类型为二核苷酸重复(Di)的有67个,占gSSR位点总数的70.53%;基序类型为三核苷酸重复(Tri)的共有25个,占比26.32%(图3A);基序类型为四核苷酸重复(Tetra)、五核苷酸重复(Penta)、六核苷酸重复(Hexa)的gSSR位点数很少。在36条Scaffold中统计了每种SSR基序重复元件数量的分布,在二核苷酸重复类型中,含有AT & TA、AG & GA单元的二核苷酸SSR数量要明显多于其他类型的二核苷酸重复;在其余核苷酸重复类型中,并未出现以TG、CG或GC作为重复单元的基序(图3B)。
2.4 gSSR引物筛选及多态性分析
对检测到的95个gSSR位点设计相应的引物并进行多态性筛选,部分结果如图4所示。结果表明,共有69对gSSR引物能够扩增出清晰稳定的条带,占引物总数的72.63%;共有46对gSSR引物在亲本及子代间具有多态性,多态性gSSR引物占引物总数的48.42%。
使用多态性引物在群体中进行扩增,共有29对gSSR引物扩增产物条带可以判读,经过卡方(χ2)测验检测这29对多态性SSR引物扩增产物在子代中的分离情况,其中22对引物所得产物在子代中分离情况符合孟德尔分离比例(1∶1,1∶2∶1,1∶1∶1∶1),7对引物所得产物存在不同程度偏分离现象(P<0.05),偏分离标记占多态性引物的比例为24.13%。29对引物具体分离情况见表3。
2.5 种间遗传图谱加密
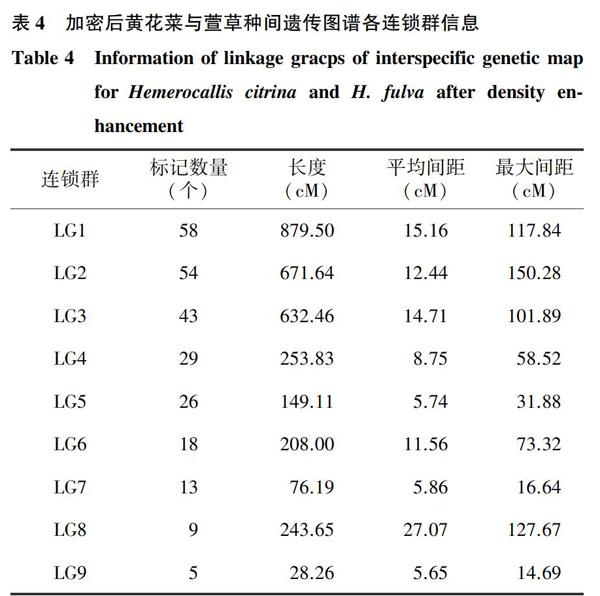
利用Joinmap 4.1软件加密黄花菜种间遗传图谱,共有291个SSR标记参与运算,其中包括课题组前期开发的262个EST-SSR标记以及29个新开发的gSSR标记。在LOD值为3.0时划分为9个连锁群。制图过程中有13个标记(12个EST-SSR标记和1个gSSR标记)由于对连锁群结构和标记分布均匀性产生较大影响而舍去,有23个标记(17个EST-SSR标记和6个gSSR标记)由于形成单标记或者双标记连锁群而未能进入最终的图谱。连锁图谱总图距为3 142.64 cM,图谱长度较原始种间图谱增加了657.05 cM,连锁群(LG)长度为28.26~879.50 cM(表4)。
图谱共有255个标记,包括233个EST-SSR标记以及22个gSSR标记。相邻标记中最大间距大于80 cM的间距共有4个,分别位于LG1、LG2、LG3和LG8,最大的间距为150.28 cM,这个间距位于LG2的sau555、sau481和sau825之间(图5)。图谱平均图距为11.88 cM。加密后的黄花菜与萱草种间遗传图谱中SSR标记在9个连锁群上的分布是不均匀的,各连锁群标记数量为5~58个,标记数量最多的连锁群为LG1,共有58个标记;LG9的标记数量最少,为5个(表4)。共有22个gSSR标记被加密到种间遗传图谱上,其中7个gSSR标记来源于秋水仙碱代谢通路相关候选Scaffold,15个标记来源于昼夜节律代谢通路候选Scaffold,这些标记位于LG1、LG2、LG3、LG4和LG7上(图5)。其中,位于LG1的sau01228和sau01182在遗传图谱上位于同一遗传距离,2个标记是由不同性状的候选基因开发而来的,其对应的Scaffold序列是不同的,2个标记在群体中的基因分型也是不同的,sau01228为nn×np分型,sau01182为ef×eg分型,是不一样的2个标记。类似的情况也出现在LG3上的sau01263、sau01260和sau01254这3个标记,它们位于不同的Scaffold,其在群体中的基因分型也是不同的,sau01263为nn×np分型,sau01260为ef×eg分型,sau01254为nn×np分型。
2.6 加密后图谱的优化整合
将加密后的图谱与课题组前期构建的框架种间遗传图谱[11]进行比较,结果表明,加密前黄花菜与萱草种间遗传图谱具有11个连锁群(HFLG1~HFLG11),新标记具有明显的连锁群整合效果,加密后为9个连锁群(LG1~LG9),其中,LG1上由于标记sau01229与sau01183的加入使得之前的HFLG2与HFLG10这2个连锁群整合到了一起,HFLG10整体插入到了HFLG2的sau722与sau920之间,sau01179、sau01228、sau01182、sau01203和sau01214这5个标记也均匀地插入到了LG1上,并且由于这些标记的加入使得之前没有上图的单标记sau275与3标记sau677、sau215、sau979也加入到了LG1顶端,遗传距离由HFLG2的401.8 cM和HFLG10的44.4 cM合并增加到了879.5 cM(图6)。LG2中共增加了6个标记,分别为sau01174、sau01221、sau01173、sau01172、sau01201、sau01202,这些标记都加入到了LG2的偏底端位置,原HFLG1上的sau272因加密后致使LG2长度发生较大变化而舍弃。LG3上新加入了sau01263、sau01260、sau01254、sau01218、sau01226、sau01225这6个标记,连锁群长度增加了59.8 cM,另外由于新标记的加入使得LG3上部sau779~sau1017片段发生了倒位,原本处于HFLG3底端的sau937移动到了LG3顶端。LG4由于单标记sau01233的加入使之前HFLG5和HFLG8合并为1个连锁群,长度由HFLG5的141.1 cM和HFLG8的95.4 cM增加为253.8 cM。对LG5对应的HFLG4上的原标记进行优化调整后,之前未上图的sau311、sau310、sau48、sau863、sau987、sau433、sau562、sau338这8个标记也加入到了LG5上。LG7加入了2个新标记sau01186以及sau01196。其余连锁群均与之前保持一致,并未发生改变(图6)。
3 讨论
简单重复序列(SSR)由于重复性高、特异性强等特点已经成为基因定位和遗传多样性研究的首选标记[15],SSR标记广泛应用于品种鉴定[1]、图位克隆[16]、系统发育关系研究[13]、遗传多样性研究[17]、遗传图谱构建[18]等。目前,SSR标记的类型可以大致分为2种,一种是通过RNA-seq开发的EST-SSR标记,EST是基因表达序列,通过这种方式开发的标记主要对编码区进行扩增,所以在物种间具有很好的通用性,并且使用这些标记构建遗传图谱相当于定位功能已知的基因[19]。结合关联分析,如果某性状与图谱上的EST-SSR关联,那么这个标记有极大的可能与控制该性状的基因有关[20]。另外一种是通过基因组开发的gSSR标记,该标记是较为理想的构建图谱的标记,大多数存在于基因组的非编码区[21]。
基于此思路,本研究从秋水仙碱和昼夜节律相关代谢通路(ko00950、ko04712)上的候选Unigene入手,以期在候选EST-SSR附近开发gSSR标记来加密该区段。值得一提的是,在筛选昼夜节律相关Unigene时,c56440.graph_c0表现出與拟南芥中LHY基因极高的序列相似性,基于序列决定生物学功能的考虑,认为该Unigene极可能在本物种中存在LHY相关基因功能,故亦纳入候选Unigene筛选范畴。
有学者的研究结果表明,使用单一类型标记构图会导致标记分布不均匀,标记类型的不同会影响标记在连锁群上的分布[21-22]。因此,本研究综合使用新开发的gSSR和前期的EST-SSR 2种标记来进行图谱构建。从结果来看,标记仍然是分布不均匀的,可能原因与标记数量不足以及标记自身的非随机分布有关,此次图谱加密过程仅使用了部分基因组序列来开发gSSR标记,在之后的研究中,基于全基因组SSR标记开发进行图谱加密应该是一个有效的解决方案。此外,由于EST-SSR来自比较保守的编码区,很多研究结果表明gSSR的多态性要高于EST-SSR[15,23],本研究中新开发的gSSR标记多态性比例为48.42%,高于侯非凡[11]使用的EST-SSR标记(22.49%)。
理论上,分子连锁群的数目应该与染色体数目相等[24],加密后其连锁群数目由11个整合为9个,这可能是由于萱草属植物具有较为庞大的基因组(3.61 Gb),而图5中标记只有255个,难以覆盖整个基因组,在此基础上开发新标记、扩大作图群体,是填补图谱Gap的有效方法,这也是本研究接下来的努力方向,以期为黄花菜和萱草分子标记辅助育种、关键性状基因定位及数量性状座位(QTL)分析奠定理论基础。
参考文献:
[1] LI S, JI F, HOU F, et al. Characterization of hemerocallis citrina transcriptome and development of EST-SSR markers for evaluation of genetic diversity and population structure of Hemerocallis collection[J]. Frontiers in Plant Science, 2020, 11: 686.
[2] XU P, WANG K Z, LU C, et al. Antidepressant-like effects and cognitive enhancement of the total phenols extract of Hemerocallis citrina Baroni in chronic unpredictable mild stress rats and its related mechanism[J]. Journal of Ethnopharmacology,2016, 194: 819-826.
[3] 杨 利. 萱草属植物营养成分分析及品质评价[D]. 长春:吉林农业大学, 2014.
[4] 詹利生,李贵荣,李少旦,等. 黄花菜中总黄酮的提取及其药理作用初步观察[J]. 南华大学学报(医学版),2005, 33(1): 112-114.
[5] HOU F, LI S, WANG J, et al. Identification and validation of reference genes for quantitative real-time PCR studies in long yellow daylily, Hemerocallis citrina Borani[J]. PLoS One,2017, 12(3): e0174933.
[6] 张 宁,李 森,王金耀,等. 萱草属植物花蕾中秋水仙碱含量HPLC检测体系的优化[J]. 河北农业大学学报,2017, 40(5): 48-54.
[7] 王金耀,党换梅. 萱草属植物花蕾中的秋水仙碱HPLC测定[J]. 现代园艺,2018(11): 33-35.
[8] 关 颖. 中毒患者血清中秋水仙碱的快速检验[J]. 中国卫生检验杂志,2001(5): 625-626.
[9] CUI H, ZHANG Y, SHI X, et al. The numerical classification and grading standards of daylily (Hemerocallis) flower color[J]. PLoS One,2019, 14(6): e216460.
[10]熊 雄,侯非凡,崔虎亮,等. 萱草属植物种间与种内分离群体花器官主要性状的遗传分析[J]. 山西农业科学,2019, 47(12): 2062-2067.
[11]侯非凡. 黄花菜秋水仙碱合成相关基因筛选及遗传图谱构建[D]. 太谷:山西农业大学, 2017.
[12]冀芳芳,李 森,史青青,等. 萱草属种质遗传多样性分析及初级核心种质库的构建[J]. 河北农业大学学报,2018, 41(2): 55-61.
[13]ZHANG S, TANG C, ZHAO Q, et al. Development of highly polymorphic simple sequence repeat markers using genome-wide microsatellite variant analysis in Foxtail millet[Setaria italica (L.) P. Beauv][J]. BMC Genomics,2014, 15(1): 78.
[14]冀芳芳. 萱草属植物主要观赏性状的候选基因关联分析[D]. 太谷:山西农业大学, 2018.
[15]唐 露,金梦雅,黄琳凯,等. 基于SSR标记的四倍体鸭茅遗传图谱加密[J]. 中国农业科学,2018, 51(5): 991-998.
[16]LI S, PAN Y, WEN C, et al. Integrated analysis in bi-parental and natural populations reveals CsCLAVATA3 (CsCLV3) underlying carpel number variations in cucumber[J]. Theoretical and Applied Genetics,2016, 129(5): 1007-1022.
[17]ESER E, TOPCU H, KEFAYATI S, et al. Highly polymorphic novel simple sequence repeat markers from Class I repeats in walnut (Juglans regia L.)[J]. Turkish Journal of Agriculture and Forestry, 2019, 43(2): 174-183.
[18]SCHLAUTMAN B, COVARRUBIAS-PAZARAN G, DIAZ-GARCIA L A, et al. Development of a high-density cranberry SSR linkage map for comparative genetic analysis and trait detection[J]. Molecular Breeding,2015, 35(8): 177.
[19]姜春芽,廖 娇,徐小彪,等. 植物EST-SSR技术及其应用[J]. 分子植物育种,2009, 7(1): 125-129.
[20]SCHUBERT R, MUELLERSTARCK G, RIEGEL R. Development of EST-PCR markers and monitoring their intrapopulational genetic variation in Picea abies (L.) Karst.[J]. Theoretical and Applied Genetics,2001, 103(8): 1223-1231.
[21]姜俊烨. 蚕豆微核心种质构建及SSR遗传连锁图谱加密[D]. 北京:中国农业科学院, 2014.
[22]CASTIGLIONI P, AJMONE-MARSAN P, VAN WIJK R, et al. AFLP markers in a molecular linkage map of maize: codominant scoring and linkage group ditsribution[J]. Theoretical and Applied Genetics,1999, 99(3): 425-431.
[23]张亚东,彭 婵,李振芳,等. 基因组SSR与EST-SSR标记在杨树不同种间的遗传差异[J]. 东北林业大学学报,2011, 39(12): 8-11.
[24]张 俊,王荣梅,王金耀,等. 萱草屬植物染色体制片技术优化及倍性鉴定[J]. 河北农业大学学报,2018, 41(3): 42-48.
(责任编辑:陈海霞)
收稿日期:2020-06-26
基金项目:山西农业大学青年拔尖创新人才支持计划项目(BJRC20-1601);山西省农业重点研发计划重点项目(20170-3D211001-04-05、201903D211011-01);山西省高等学校科技创新项目(2019L0375)
作者简介:高 阳(1995-),男,山西朔州人,硕士研究生,主要从事园艺植物生物技术与遗传改良方面的研究。(E-mail)sau_gaoyang@163.com
通讯作者:李 森,(E-mail)saulisen@163.com

