侵染江苏猕猴桃的北方根结线虫(Meloidogyne hapla)形态学描述和分子特征分析
范亚磊 赵敏 邓晟 刘瑞显 姚焕钊 魏利辉 冯辉


摘要: 根結线虫病长期以来对猕猴桃安全生产造成了严重威胁。调查发现江苏省连云港市部分猕猴桃种植园根结线虫病发生普遍,组织切片可见根部出现根结线虫诱导的特异的巨细胞。形态学观察和分子检测结果显示,尽管与其他群体存在一定差异,但仍确定本次分离自猕猴桃的根结线虫(种群编号:CN43)为北方根结线虫(Meloidogyne hapla)。基于内转录间隔区(ITS)和COⅡ-16S序列构建的遗传进化树显示,CN43分离群体与已知的北方根结线虫位于同一进化分支,而与其他种类的根结线虫明显区分开来。以ITS序列构建的中接网络将34个北方根结线虫分离群体划分为10个单倍型,其中CN43属于最大的单倍型群组;然而,单倍型分析不能确定各分离群体在地理分布上的关联性。综上,本研究首次报道了北方根结线虫在中国猕猴桃上的侵染和发生,其分离群体的形态学描述和分子特征分析可为揭示猕猴桃根结线虫的种群多样性和种间变异提供参考。
关键词: 猕猴桃;根结线虫;北方根结线虫;内转录间隔区(ITS);COⅡ;进化分析
中图分类号: S436.634 文献标识码: A 文章编号: 1000-4440(2021)01-0075-08
Morphological description and molecular characteristic analysis on Meloidogyne hapla which infect kiwifruit in Jiangsu province
FAN Ya-lei1,2, ZHAO Min1, DENG Sheng1, LIU Rui-xian3,YAO Huan-zhao4, WEI Li-hui1, FENG Hui1
(1.Institute of Plant Protection, Jiangsu Academy of Agricultural Sciences, Nanjing 210014,China;2.School of Horticulture and Plant Protection, Yangzhou University, Yangzhou 225009,China;3.Institute of Industrial Crops, Jiangsu Academy of Agricultural Sciences, Nanjing 210014,China;4.Plant Protection Station of Tongshan District of Xuzhou City, Xuzhou 221116,China)
Abstract: Root-knot diseases caused by Meloidogyne spp. have posed great threat to global kiwifruit industry for a long time. It was found through investigation that, the disease caused by root-knot nematode was common in part of the kiwifruit plantations in Lianyungang City, Jiangsu province. The specific giant cells were found in tissue slices of roots, which may be induced by root-knot nematodes. Results of morphological observation and molecular detection indicated that, the root-knot nematode (population code: CN43) separated from kiwifruits was confirmed to be Meloidogyne hapla, although there was difference compared with other polulations. Phylogenetic trees inferred from internal transcribed spacer (ITS) and partial COⅡ-16S sequences revealed that, isolate population of CN43 and M. hapla were within the same clade and could be separated from other root-knot nematode species obviously. Isolates of 34 M. hapla in NCBI database were divided into ten haplotypes using median-joining network constructed by ITS sequence, in which CN43 belonged to the largest haplotype group. However, haplotype analysis could hardly show the correlation of geographic distribution between the isolates. In conclusion, infection and occurrence of M. hapla in kiwifruit trees of China was reported for the first time. Analysis on the morphology and molecular characteristics of the isolated M. hapla populations can provide reference for revealing population diversity and intraspecific variability of root-knot nematodes in kiwifruit.
Key words: kiwifruit;root-knot nematode;Meloidogyne hapla;internal transcribed spacer(ITS);COⅡ;phylogenetic analysis
猕猴桃(Actinidia deliciosa)是起源于中国的适合在温热带地区栽培的重要果树,目前已在20多个国家得到种植,截至2011年,中国以外地区猕猴桃收获面积达到9.4×104 hm2[1]。然而,随着猕猴桃产业和规模的不断发展,猕猴桃根结线虫病害问题日益凸显。根结线虫(Meloidogyne spp.)在全世界各猕猴桃种植区广泛存在,其中南方根结线虫(M. incognita)和北方根结线虫(M. hapla)是主要病原线虫种类。南方根结线虫在巴西、智利、印度、美国、土耳其等国均有分布,北方根结线虫则分布在巴西、智利、印度、意大利、西班牙、新西兰、韩国等国家,在猕猴桃上存在和为害[2]。此外,其他根结线虫种类如爪哇根结线虫(M. javanica)、花生根结线虫(M. arenaria)、埃塞俄比亚根结线虫(M. ethiopica)[3]等也能侵染猕猴桃。
根结线虫在中国主要猕猴桃产区长期为害,并造成严重的经济损失。过去30年来,南方根结线虫是中国猕猴桃上的优势种群,在陕西[4]、河南[5-6]、湖北[7]、湖南[8]、贵州[9]、浙江[10]、福建[11-12]等猕猴桃产地普遍存在。部分猕猴桃产地还发现了爪哇根结线虫[11]、花生根结线虫[7]、M. actinidiae[13]和M. aberrans[2]等种类。然而,北方根结线虫在中国猕猴桃上发生和为害的情况却鲜有报道。
近年来,随着中国农业产业结构调整和供给侧结构性改革的推进,猕猴桃作为农民增收脱贫的重要产业在江苏省得到快速发展。本研究于2019年7月对江苏省多个猕猴桃种植基地根结线虫病进行了调查,发现连云港部分果园的猕猴桃地上植株纤弱,叶片褪绿枯黄,坐果少,地下根系畸形,新根布满大量珍珠状根结,表现出典型的根結线虫病的症状。通过病理解剖,从发病根部分离出根结线虫。利用形态学观察和分子检测标记对其进行鉴定,确定侵染猕猴桃的线虫种类为北方根结线虫。同时,基于内转录间隔区(ITS)和COⅡ-16S序列分析了该群体的分子特征以及与其他分离群体间的进化关系。
1 材料与方法
1.1 线虫分离
线虫样本采集自江苏省连云港市赣榆区黑林镇猕猴桃种植园。选择长势较弱、叶片发黄的猕猴桃植株,小心挖取根组织,并选取具有典型根结症状的根组织带回实验室进行后续分析。
1.2 形态学鉴定
用清水漂洗根组织以去除泥沙,在体式显微镜下,用挑针从根部根结处挑取根结线虫雌虫和雄虫,二龄幼虫直接由卵块孵化获得。线虫杀死、固定、会阴花纹等标本制作参照文献[13]。通过光学显微镜(DM2500,徕卡显微系统有限公司产品)和体式显微镜(M205FA,徕卡显微系统有限公司产品)观察并拍摄雌虫、雄虫和幼虫形态,测量de-Man值。
1.3 线虫DNA提取和PCR扩增
DNA提取参考文献[14]中的方法进行,略有修改。在解剖镜下,挑取单条雌虫至盛有20 μl裂解液(含1×PCR 缓冲液、1 μg蛋白酶K)的PCR管中,用镊子将虫体挤破使虫液释放,混合均匀后置于液氮中迅速冷冻20 min。随后将样品置于PCR仪上于65 ℃孵育30 min, 95 ℃ 5 min,最后于12 000 r/min离心1 min,吸取上清液用于PCR扩增。
核糖体ITS序列用引物TW81(5′-GTTTCCGTAGGTGAACCTGC-3′)和AB28(5′-ATATGCTTAA-GTTCAGCGGGT-3′)扩增,覆盖3′-18S rRNA、ITS1、5.8S rRNA、ITS2和5′-28S rRNA序列[15]。25.0 μl反应体系含有2×Taq Master mix(北京康为世纪生物科技有限公司产品)12.5 μl,正反向引物各10 pmol,线虫DNA粗提液5.0 μl。PCR反应条件为:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 60 s,共38个循环;72 ℃ 5 min。线粒体细胞色素c氧化酶Ⅱ亚基基因COⅡ序列应用C2F3(5′-GGTCAATGTTCAGAAATTTGTGG-3′)和MRH106-(5′-AATTTCTAAAGACTTTTCTTAGT-3′)扩增,覆盖部分COⅡ编码序列、tRNA-His序列以及部分16S rRNA序列[16]。反应体系同上,PCR反应条件为:94 ℃ 4 min;94 ℃ 1 min,50 ℃ 1 min,70 ℃ 2 min,共35个循环;72 ℃ 10 min。另外,利用南方根结线虫SCAR(序列特异性扩增区域)标记Mi-F(5′-GTGAGGATTCAGCTCCCCAG-3′)和Mi-R(5′-ACGAGGAACATACTTCTCCGTCC-3′)[17],北方根结线虫SCAR标记Mh-F(5′-TGACGGCGGTGAGTGCGA-3′)和Mh-R(5′-TGACGGCGGTACCTCATAG-3′)[18]进一步验证分离群体的种类。PCR产物经1.2%琼脂糖凝胶电泳检测后直接进行测序。
1.4 序列比对和进化分析
分别以江苏分离群体ITS和COⅡ序列在美国国家生物技术信息中心(NCBI)数据库进行BLAST(http://www.ncbi.nlm.nih.gov/blast)比对,根据E值筛选相似度相近的序列以及合适外群序列构建贝叶斯进化树。将新获得的序列和下载序列通过MAFFT软件(https://www.ebi.ac.uk/Tools/msa/mafft)进行多序列比对,再通过Gblocks 0.91b(http://www.phylogeny.fr/one_task.cgi?task_type=gblocks)进行策展分析并获取保守序列。经DAMBE软件运算发现,所有序列的核苷酸替换未达到饱和,适宜建树。基于最小赤池信息准则(AIC)值,经Modeltest 3.7计算获得ITS序列最优碱基替换模型为GTR+G,COⅡ最优碱基替换模型为K81uf+G。采用马尔科夫链蒙特卡洛方法 (Markov chain Monte Carlo,MCMC)构建贝叶斯树,每条马尔科夫链运行8×105代。抛弃25%老化样本进行聚合评估,剩余样本用于后续分析构建一致性为50%的发育树,并经FigTree 1.4进行优化。另对NCBI上北方根结线虫各分离群体ITS序列进行重新分析,去除插入和缺失序列,最终确定34个群体样本有11个核苷酸发生置换,基于该置换位点,利用Network v10构建单倍型中接网络(Median-joining network)[19]。
2 结果与分析
2.1 受害猕猴桃根部症状和线虫形态特征
受害猕猴桃植株长势较弱,部分叶片褪绿枯黄,坐果量减少(图1A);地下根系不发达、畸形,新根布满大量珍珠状根结,表现出典型的根结线虫病的症状(图B)。利用酸性品红进行组织染色可见根结处明显出现近球形根结线虫(图1C)。通过病理石蜡切片,可见受害植株根内不同龄期的线虫虫态及根结线虫特异诱导的巨细胞(图1D、图1E)。
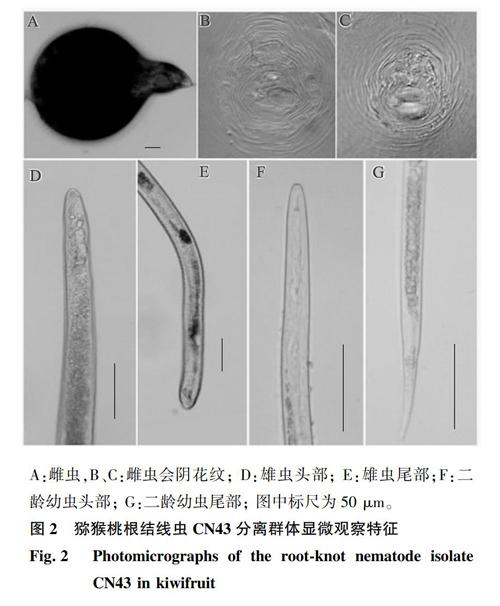
在显微镜下对所分离的线虫(标记为CN43分离群体)进行观察,主要形态特征如下:雌虫体型近球形,颈部短,口针纤细、基球小,锥部向背部稍弯曲,末端宽,口针基球圆形,与杆部有明显界限;头区大、无环纹(图2A);会阴花纹近圆形六边形,背弓扁平,侧线不明显,线纹平滑形到波浪形,尾端有刻点(图2B、图2C)。雄虫体型较短,头冠圆、高,头区无环纹,整个轮廓外突,与体区分界较明显,口针椎体前端细尖,向后渐粗;口针基球球状,与基杆界限明显;尾端光滑钝圆,侧尾线口位于泄殖腔附近,交合刺略弯曲(图2D、图2E)。二龄幼虫头冠圆、窄,口针基球圆形,与基杆分界不明显;尾细长,末端透明区薄,界限不明显(图2F、图2G)。雌虫、雄虫和二龄幼虫de-Man形态学参数与已报道的北方根结线虫(M. hapla)特征值(表1)基本一致。
2.2 分子生物学特征和进化分析
由于在中国猕猴桃种植区南方根结线虫普遍存在,因此首先用南方根结线虫特异引物进行扩增,电泳未显示出条带,而以南方根结线虫DNA为模板的阳性对照则获得单一的995 bp左右的条带。以ITS和COⅡ-16S通用引物PCR扩增分别获得553 bp(NCBI登录号为MT490918)和663 bp条带(NCBI登录号为MT536934)。利用北方根结线虫特异引物PCR扩增获得单一的610 bp条带,与预期大小一致(图3)。通过與NCBI数据库登录的序列进行比对分析,发现CN43分离群体ITS序列与其他北方根结线虫分离群体相似度为85.19%~99.64%,其中与中国云南分离群体(NCBI登录号:JX024147)相似度最高,为99.64%(E值=0),而与日本分离群体(NCBI登录号:LC030358)相似度最低,为85.19%(E值=3e-155)。CN43分离群体COⅡ-16S序列与澳大利亚分离群体(NCBI登录号:L76262)相似度最高,为96.69%(E值=0),而与埃塞俄比亚分离群体(NCBI登录号:KP681262)相似度最低,为92.78%(E值=0)。
基于ITS和COⅡ-16S序列构建的贝叶斯进化树显示,尽管北方根结线虫各分离群体位于不同较短的次级分支,但总体上CN43与北方根结线虫划归为一个大的进化分支,与其他种类的线虫位于不同分支(图4、图5)。基于NCBI数据库中所有北方根结线虫ITS序列进行重新分析,发现其中5个18S基因序列存在高度变异,推测这些递交至NCBI上的序列可能不完整或不正确,因此将其排除,最终用于分析的序列共34个,包括中国分离群体20个,韩国和美国各3个,日本和澳大利亚各2个、新西兰、塞尔维亚、西班牙、北爱尔兰各1个。构建的中接网络共获得10个单倍型,每个单倍型代表1~21个分离群体。其中单倍型1出现频率最高(21个群体),与其他9个单倍型相连,表明这些种群可能是其他单倍型的进化祖先。而中国[台湾(NCBI登录号:MK774795)、浙江(NCBI登录号:KR535973)、云南(NCBI登录号:MT249019)]和日本(NCBI登录号:LC030361)、韩国(NCBI登录号:MK188479)、澳大利亚(NCBI登录号:AF516721)等群体存在单个独立分支。由于无法排除测序误差,将其分支用虚线表示;中接网络图显示,各个单倍型和地理分布之间无明显相关性(图6)。
3 讨论
根结线虫在中国各个猕猴桃产区普遍发生。林尤剑等[11]报道福建省猕猴桃上的根结线虫主要为爪哇根结线虫和南方根结线虫,其中爪哇根结线虫为优势种。姜凤丽等[10]发现,浙江省猕猴桃根结线虫主要为南方根结线虫、爪哇根结线虫和花生根结线虫,其中南方根结线虫为优势种。陈文等[9]对贵州猕猴桃产区进行调查,基于雌虫会阴花纹特征结合分子标记鉴定出所有分离群体均为南方根结线虫。
近年来,猕猴桃种植作为江苏部分地区农村振兴和农民脱贫致富的重要产业得到迅速发展。然而,由于大量引种和管理措施不当,根结线虫病逐渐成为制约当地猕猴桃安全生产的重要因素之一。笔者前期对江苏省多个猕猴桃种植基地进行了调查,发现部分猕猴桃果园根结线虫病发生较重,发病新根形成许多小珍珠般大小的根结,根结初与新根同色,后逐渐变为褐色,甚至坏死、腐烂;根际土壤虫口密度最高可达每100 g土壤25~30条二龄幼虫。通过SCAR分子标记进行检测,基于特异的电泳条带确定其主要为南方根结线虫,表明南方根结线虫是为害江苏猕猴桃的主要线虫种类。然而基于形态学观察和分子生物学数据,证实其中1个来自连云港的分离群体(CN43),为北方根结线虫——这是北方根结线虫侵染中国猕猴桃的首次报道。
本研究分离的CN43群体与其他北方根结线虫分离群体在形态特征上基本一致,例如雌虫会阴花纹存在刻点以及二龄幼虫尾部透明区界限不明显等。尽管如此,仍与其他分离群体的de-Man参数值存在一定差异。例如,与美国夏威夷咖啡分离群体相比,CN43群体雌虫、雄虫SPI值、二龄幼虫L值和W值较大,而雌虫MEV-HE值和二龄幼虫a值较小[20]。与国内记载的北方根结线虫特征相比,CN43群体的雄虫HH值、HW值和二龄幼虫L值比辽宁沈阳紫花地丁分离群体大,而二龄幼虫ST值、MEV-HE值和a值比辽宁沈阳紫花地丁分离群体小;雄虫的HH值和a值比山东威海花生和济南薄荷上的分离群体略小[21]。一般认为,北方根结线虫存在A、B 2个细胞遗传小种,其判定依据主要根据染色体数目和雄虫头部特征。尽管本次获得的CN43群体雄虫数目十分有限,然而这些雄虫的口针基杆与基球连接处略微变粗,与北方根结线虫A小种雄虫描述较为一致[22]。宋志强[23]曾从江苏连云港地区蔬菜上分离到北方根结线虫,但缺乏形态学描述和分子特征分析,尚无法确定CN43群体与侵染当地蔬菜的北方根结线虫为同一小种。
核糖體ITS和线粒体基因通常用于揭示根结线虫中间变异特征[24-25]。尽管有研究结果表明ITS序列在根结线虫属内识别率较低[26],然而本研究结果表明,ITS和COⅡ-16S序列能较好区分北方根结线虫和其他种类根结线虫。同时,序列比对和贝叶斯进化树结果表明,CN43群体与NCBI登录的北方根结线虫均有高度相似性。由于NCBI数据库中COⅡ数据十分有限,难以鉴别北方根结线虫种间变异特征。因此,本研究采用ITS序列研究北方根结线虫各个分离群体单倍型特征。基于中接网络,确定CN43与其他20个分离群体归为一类单倍型,然而由于潜在的测序错误,尚不能确定各分离群体在地理分布上的关联性。新型分子标记的开发和应用有望消除这些误差,以揭示其单倍型分布规律。
参考文献:
[1] 张计育. 21世纪以来世界猕猴桃产业发展以及我国猕猴桃贸易与国际竞争力分析[J]. 中国农学通报, 2014, 30(23):48-55.
[2] TAO Y, XU C, YUAN C, et al. Meloidogyne aberrans sp. nov.(Nematoda: Meloidogynidae), a new root-knot nematode parasitizing kiwifruit in China[J]. PLoS One, 2017, 12(8): e0182627.
[3] COFCEWICZ E, ALMEIDA M R, ABALLAY E, et al. Meloidogyne ethiopica, a major root-knot nematode parasitising Vitis vinifera and other crops in Chile[J]. Nematology, 2007, 9(5): 633-639.
[4] 范学科,党占平. 猕猴桃根结线虫病的病原鉴定及其防治[J]. 陕西农业科学, 2007(6): 71-72.
[5] 李淑君,喻 璋. 河南猕猴桃根结线虫新种[J]. 河南农业大学学报, 1991, 3(6): 71-72.
[6] XU J H, LIU P L, MENG Q P, et al. Characterisation of Meloidogyne species from China using isozyme phenotypes and amplified mitochondrial DNA restriction fragment length polymorphism[J]. European Journal of Plant Pathology, 2004, 110: 309-315.
[7] 杨清平,王立华,谢志斌,等. 湖北猕猴桃主要病害及其有机病害治理技术[J]. 湖北农业科学, 2014, 53(10): 2307-2311.
[8] 方炎祖,罗桂菊,朱晓香,等. 湖南猕猴桃根结线虫病害研究[J]. 湖南农业科学, 1991, 30(4): 40-42.
[9] 陈 文,孙燕芳,吴石平,等. 贵州修文猕猴桃根结线虫的发生种类与鉴定[J]. 西南农业学报, 2018, 31(1): 84-88.
[10]姜凤丽,邵桂英. 猕猴桃根结线虫病的初步研究[J]. 浙江林学院学报, 1990(1): 46-51.
[11]林尤剑,高日霞. 福建猕猴桃病害调查与鉴定[J]. 福建农业大学学报, 1995, 24(1): 49-53.
[12]张绍升,林尤剑,高日霞. 福建猕猴桃根结线虫病病原鉴定[J]. 福建农学院学报, 1993, 22(4): 433-435.
[13]刘维志. 植物病原线虫学[M]. 北京: 中国农业出版社, 2000: 384-400.
[14]冯 辉,魏利辉,陈怀谷,等. 细尖潜根线虫(Hirschmanniella mucronata)江苏分离群体形态学和分子特征描述[J]. 植物病理学报, 2016, 46(4): 474-484.
[15]MAAFI Z T, SUBBOTIN S A, MOENS M. Molecular identification of cyst-forming nematodes (Heteroderidae) from Iran and a phylogeny based on ITS-rDNA sequences[J]. Nematology, 2003, 5(1): 99-111.
[16]STANTON J, JUGALL A, MORITZ C. Nucleotide polymorphisms and an improved PCR-based mtDNA diagnostic for parthenogenetic root-knot nematodes (Meloidogyne spp.)[J]. Fundamental and Applied Nematology, 1997, 20(3): 261-268.
[17]MENG Q, LONG H, XU J. PCR assays for rapid and sensitive identification of three major root-knot nematodes, Meloidogyne incognita, M. javanica and M. arenaria[J]. Acta Phytopathologcia Sinica, 2004,34:204-210.
[18]ZIJLSTRA C. Identification of Meloidogyne chitwoodi, M. fallax and M. hapla based on SCAR-PCR: a powerful way of enabling reliable identification of populations or individuals that share common traits[J]. European Journal of Plant Pathology, 2000, 106: 283-290.
[19]BANDELT H J, FORSTER P, RHL A. Median-joining networks for inferring intraspecic phylogenies[J]. Molecular Biology and Evolution, 1999, 16(1): 37-48.
[20]HANDOO Z A, SKANTAR A M, CARTA L K, et al. Morphological and molecular evaluation of a Meloidogyne hapla population damaging coffee (Coffea arabica) in Maui, Hawaii[J]. Journal of Nematology, 2005, 37(2): 136-145.
[21]赵洪海. 中国部分地区根结线虫的种类鉴定和四种最常见种的种内形态变异研究 [D]. 沈阳:沈阳农业大学, 1999.
[22]刘维志. 植物线虫志[M]. 北京: 中国农业出版社,2004: 372-380.
[23]宋志强. 江苏省蔬菜根结线虫的分布调查、种类鉴定及定量检测技术研究 [D]. 南京:南京农业大学, 2013.
[24]POWERS T, MULLIN P G, HARRIS T S, et al. Incorporating molecular identication of Meloidogyne spp. into a large-scale regional nematode survey[J]. Journal of Nematology, 2005, 37: 226-235.
[25]POWERS T. Nematode molecular diagnostics: from bands to barcodes[J]. Annual Review of Phytopathology, 2004, 42: 367-383.
[26]林 宇,王金成,迟元凯,等. 基于GenBank分析28S(D2/D3)、18S和ITS序列作为根结线虫条形码标记的适用性[J]. 南京农业大学学报, 2013, 36(5): 71-76.
(责任编辑:陈海霞)
收稿日期:2020-06-20
基金项目:国家自然科学基金项目(31871943); 江苏省农业科技自主创新基金项目[CX(18)2005]; 江苏省农业科学院“小而特”学科建设项目[ZX(19)6005]
作者简介:范亚磊(1994-),男,江苏淮安人,硕士研究生,从事植物线虫病害防治研究。
通訊作者:冯 辉,(Tel)025-84390769;(E-mail)fenghui@jaas.ac.cn

