嗜烃乳化功能菌在多孔介质中的生长规律及驱油机理
李彩风,束青林,韩保锋,曹嫣镔,汪卫东,宋永亭,吏锋兵,张 勇
(1.中国石化胜利油田分公司石油工程技术研究院,山东东营 257000;2.中国石化胜利油田分公司,山东东营 257001;3.中国石化胜利油田分公司孤岛采油厂,山东东营 257231)
内源微生物采油技术是通过向油层注入激活剂,利用油藏条件下微生物的生长代谢活动提高原油采收率。该技术作为一项环保、低成本的可持续性发展技术,已在中外油田显示良好的应用前景[1-6]。前期研究发现中高温乳化微生物在中高温油藏驱油过程中起着举足轻重的作用[7-11]。由于油藏微生物生态系统及其生长代谢途径纷繁复杂,定向调控内源微生物中的乳化功能菌使其发挥驱油作用的难度大[12-14]。与内源菌相比,外源菌具有复杂度低、可控性强、稳定性好等优点,因此,向油藏注入外源乳化功能菌,调整油藏微生物种群结构使其朝着有利于驱油的方向发展,成为内源微生物采油技术发展的新思路。注入的外源菌必须适应油藏环境,并与油藏内源菌相兼容,形成油藏微生物群落中稳定的优势菌群,从而发挥内外源菌的协同驱油作用[15-16]。目前,乳化功能菌在油藏环境中生长繁殖情况、时空分布规律及其与油藏内源菌群之间的竞争关系尚不清楚,外源菌对生态系统中内源菌驱油影响的相关文献报道非常少[17],还未见外源乳化功能菌在内源菌群落驱油过程中的追踪生长变化报道,导致在油藏环境下对该类重要功能菌的激活调控针对性不强。
Geobacillus是高温油藏中一类具有嗜烃和产乳化剂功能的菌属[18-21],它是从Bacillus菌属中分离出来的一组在表型和系统发育上相似的嗜热菌群,该菌属中大多数细菌的生长温度高于55 ℃,并能降解烃类化合物。胜利油田石油工程技术研究院从油藏环境中筛选获得一株SL-1菌,该菌能以烃类为唯一碳源进行生长代谢,烃类乳化能力强,最适宜生长温度是65~70 ℃[22-23],且能产生一种以糖、蛋白和脂为主的生物乳化剂。本文将该乳化功能菌进行微观可视模型和岩心填砂模型的多孔介质驱油研究,首次探索研究了多孔介质中油藏内源菌生态系统影响下外源乳化功能菌的驱油机理及生长分布规律,为中高温油藏环境下利用外源菌强化内源菌驱油效果提供指导。
1 实验器材与方法
1.1 实验器材
实验仪器包括微观可视模型、微观驱替系统、物理模拟驱油装置、岩心填砂模型(尺寸:1 800 mm×38 mm,如图1 所示)、定量PCR 仪、分光光度计。油水样品取自胜利油田沾3 区块,原油黏度为230 mPa·s,地层水矿化度为1 890 mg/L;菌种采用SL-1菌,来自胜利油田石油工程技术研究院微生物中心菌种库。激活剂体系包括尿素,酵母粉,K2HPO4·3H2O,KH2PO4,MgSO4·7H2O和微量元素,其质量浓度分别为5,1,2.7,1.0,0.2和0.1 g/L,pH 值调至中性。
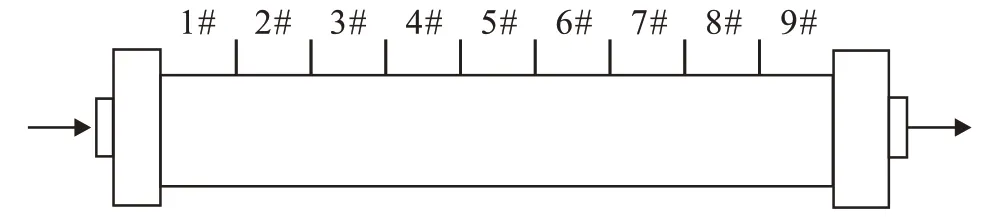
图1 岩心填砂模型分段取样Fig.1 Sectional sampling of core sand-packed model
1.2 实验方法
1.2.1 微观驱油实验方法
利用高温高压微观可视驱油系统,模拟油藏高温、高压环境,将SL-1 菌注入至微观可视模型中进行培养,研究剩余油变化[24],具体步骤包括:①将微观可视模型升温至65 ℃,抽真空,饱和含有激活剂的地层水。②饱和原油后,进行一次水驱至约1.5 PV,停止水驱。③注入0.8 PV 的SL-1 菌液,缓慢增压至10 MPa,培养不同时间,观察剩余油变化。④培养结束后,后续二次水驱1.5 PV,水驱后分析剩余油驱替情况。
1.2.2 岩心填砂模型驱油实验方法
利用岩心填砂模型驱油系统,模拟油藏高温、高压环境,将不同介质分批次注入岩心填砂模型中,激活培养,研究该菌的时间及空间变化规律,具体步骤包括:①将岩心填砂抽真空、饱和水,并饱和原油。②进行一次水驱,注入速度为1 mL/min,驱替3 PV 至含水率95%以上。③岩心中注入0.05 PV 的激活剂体系/SL-1 菌/SL-1 菌+激活剂体系,注入结束后继续以相同速度用注入水连续驱替。分别于一次水驱后的第1 d、第8 d、第15 d 和第22 d,共注入4轮次激活剂体系/SL-1菌/SL-1菌+激活剂体系。④对不同时间产出液进行驱替效率、微生物种群结构及SL-1 数量等指标检测。⑤实验结束后拆卸岩心,分析不同位点油砂内滞留的SL-1菌数量及残余油饱和度。以一直注水驱替的岩心作为空白对照。其中,仅注入激活剂体系是利用内源菌的生长代谢进行驱油,仅注入SL-1 菌是利用SL-1 菌的发酵代谢产物进行驱油,而同时注入SL-1菌和激活剂体系是利用SL-1 菌和内源菌共同繁殖代谢来发挥驱油作用。
1.2.3 SL-1菌定量检测
从NCBI 的GenBank 数据库中下载G.stearother⁃mophilus目的序列,根据功能基因中的保守区设计特异性引物,功能基因Geb-F 引物序列为5`-TAA GCG TGA GAT CGG TGG TTC-3`,功能基因Geb-R引物序列为5`-GCG CTC TCG GTT TCT TCC TT-3`。从油藏微生物中提取细菌总DNA 后,利用特异性引物进行基因扩增,扩增片段纯化后构建标准品质粒,制作SL-1菌标准曲线。
1.2.4 微生物种群结构分析
提取样品中微生物DNA,然后扩增获取16s DNA 基因文库克隆,送至深圳华大基因公司进行微生物高通量测试,确定样品中微生物种群结构组成。
1.2.5 油砂中原油测定
利用沾3 区块原油绘制原油含量标准曲线,对岩心中的油砂进行石油醚萃取,分离并收集原油萃取液,然后利用分光光度计对萃取液进行吸光度检测,明确样品中的原油含量,并通过岩心孔隙体积计算残余油饱和度。
2 实验结果
2.1 SL-1菌的微观驱油
一次水驱之后,微观可视模型中存在膜状、簇状、盲端等大量不同形态的剩余油,继续同时注入外源菌SL-1和激活剂体系作为实验组进行培养,以只添加激活剂体系作为空白对照。随着地层水中内源菌的激活,代谢产生的生物表面活性剂使膜状剩余油减少,但是壁面残余油及盲端剩余油的剥离能力有限(图2)。SL-1菌在油藏环境中生长繁殖产生生物表面活性剂,导致模型润湿性发生改变,孔隙壁面的膜状剩余油收缩,乳化成油滴从壁面剥离,盲端剩余油也被有效剥离驱出,原油乳化现象增强(图3)。
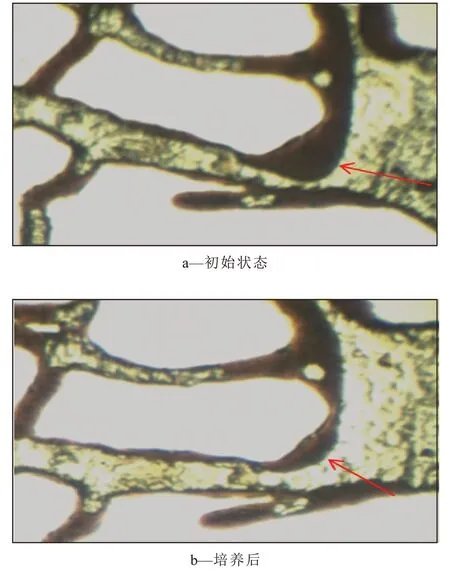
图2 空白培养期间剩余油变化Fig.2 Changes of residual oil in blank control group

图3 SL-1菌培养期间剩余油变化Fig.3 Changes of residual oil in test group with SL-1
油藏环境下,微生物与原油作用一段时间后,再进行二次水驱,剩余油明显减少,大部分簇状、柱状剩余油被驱替(图4,图5)。与空白对照相比,SL-1 菌作用后的油膜、盲端等剩余油被有效驱动,二次水驱后剩余油更少。由此可见,在高温、高压油藏环境下,加入SL-1菌可以有效提高剩余油驱替效率。
2.2 岩心填砂模型微生物驱油效果
从表1中可以看出,外源菌+内源菌体系提高原油采收率达13.5%。其次,内源菌提高原油采收率为8.8%,外源菌提高原油采收率为7.2%。由此可见,内、外源菌的生长繁殖,强化了单纯内源菌或单纯外源菌发酵液的驱油效果,从而进一步提高了原油采收率。
2.3 不同注入体系产出液中微生物数量变化
不同注入体系产出液中的微生物数量变化不同(图6)。仅注入外源菌的岩心产出液中微生物数量很低,基因拷贝数最高约为102copies/mL,说明微生物在地层水贫瘠的营养环境中难以有效生长,这时驱油效率的贡献来自发酵液中存在的生物表面活性剂产物,与外源菌繁殖代谢无关;仅注入激活剂体系的岩心产出液中微生物数量开始呈现波动变化,然后逐渐趋于稳定,约为107copies/mL,说明激活剂体系可以有效促进内源菌的生长,但是到后期,微生物增殖到一定程度,数量难以进一步增加;而同时注入外源菌和激活剂体系的岩心产出液中微生物总量呈上升变化趋势,基因拷贝数约为109copies/mL,微生物数量始终高于其余2种注入体系。由此可见,同时注入外源菌和激活剂可以进一步提高油藏微生物的数量,强化微生物代谢活性,有利于微生物驱油。
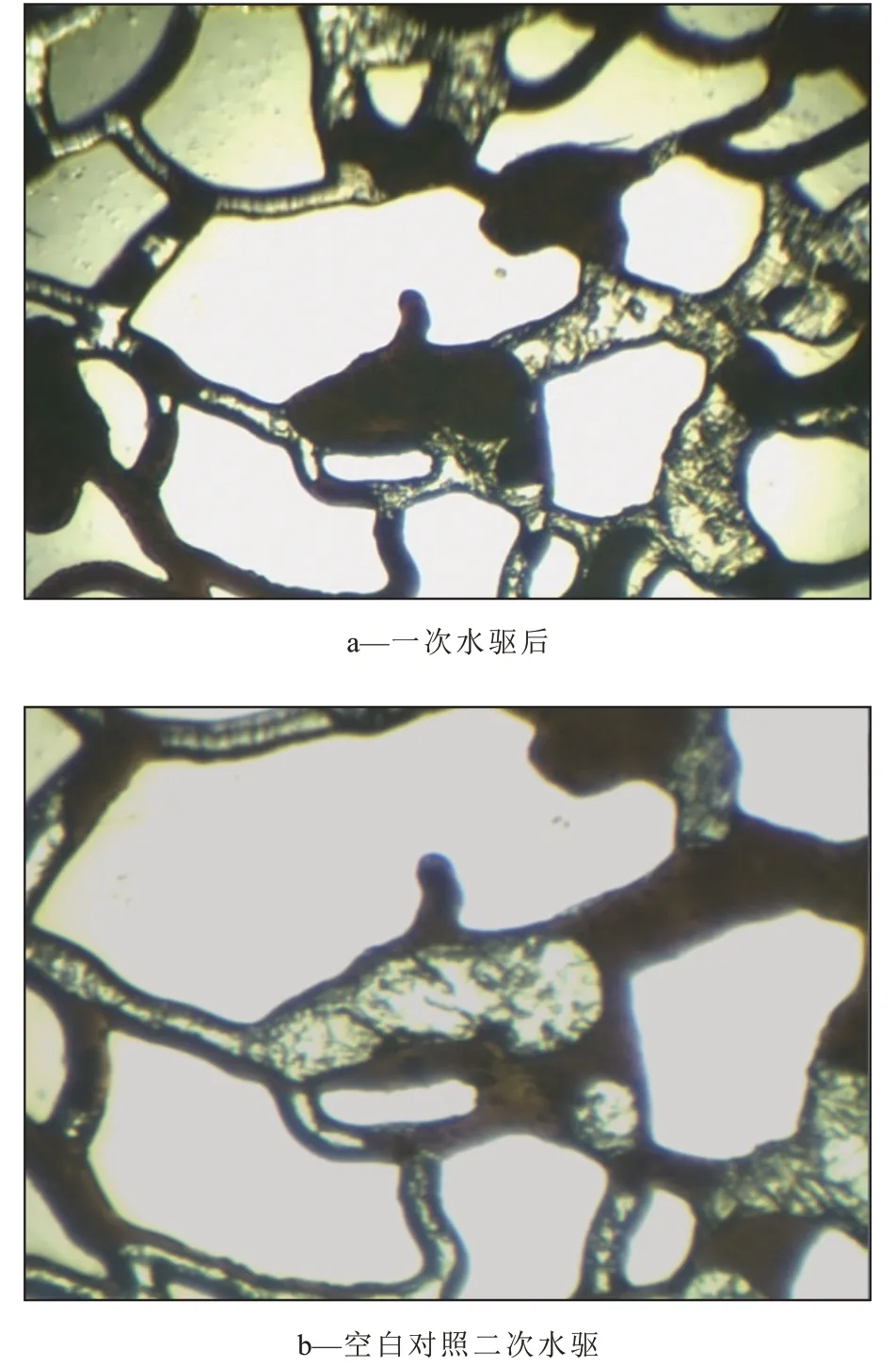
图4 空白对照作用前后剩余油分布Fig.4 Distribution of residual oil before and after blank control
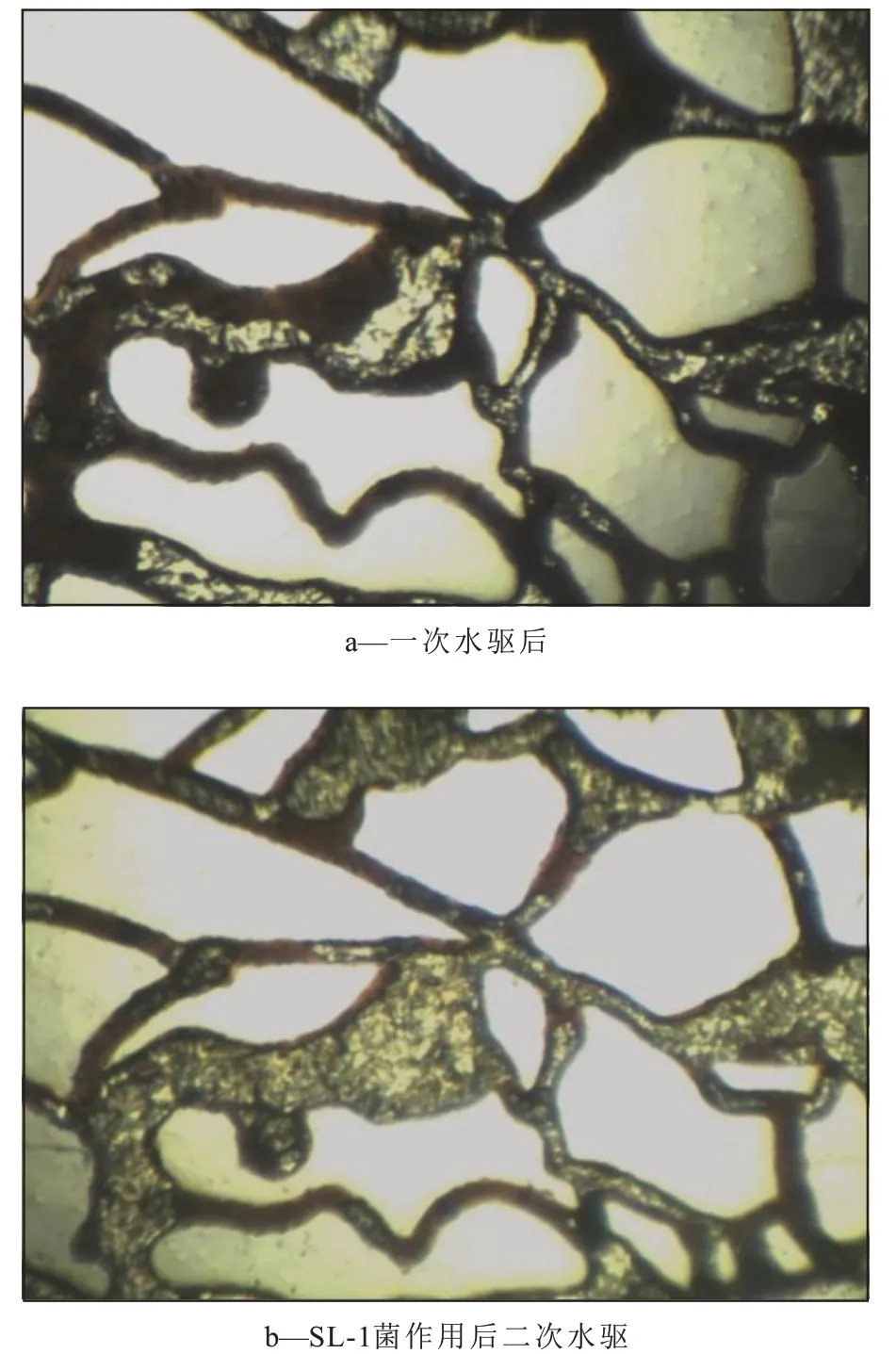
图5 SL-1菌作用前后剩余油分布Fig.5 Distribution of residual oil before and after addition of SL-1
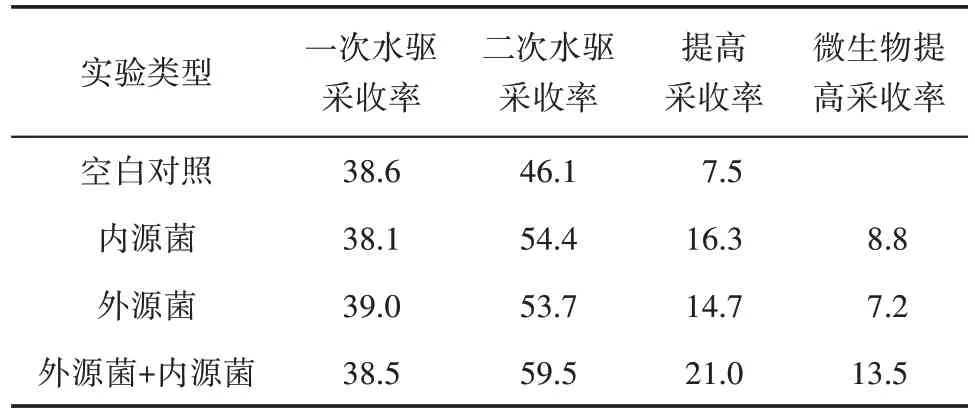
表1 不同微生物注入体系提高采收率情况Table1 Enhanced oil recovery in different microbial injection systems %
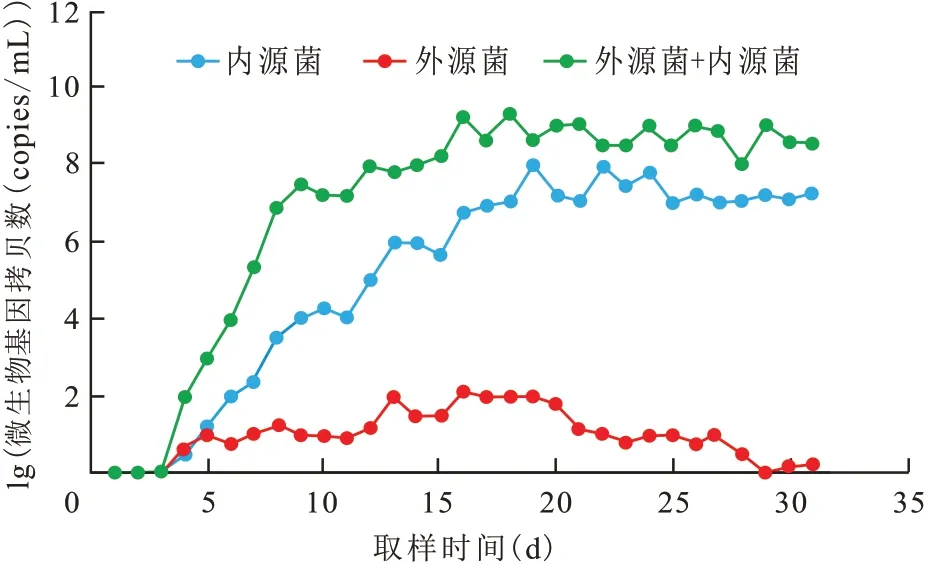
图6 不同注入体系驱替中微生物数量变化Fig.6 Changes in number of microorganisms during oil displacement in different injection systems
2.4 复合驱替中微生物群落结构
2.4.1 不同轮次微生物群落结构
微生物种群结构分析结果显示,同时注入外源菌SL-1 菌和激活剂体系的岩心产出液<中Geoba⁃cillus始终是产出液中微生物群落的优势菌之一,而其他优势菌在各轮次之间变化较大。但是整个微生物生态系统中的功能菌以烃降解菌为主,每轮次中占比均达70%以上,可能与注入的无机盐激活剂体系有关。由表2 可知,除Geobacillus菌之外,第1轮激活后主要是栖热孢菌(Thermotoga)、不动杆菌(Acinetobacter)、海杆菌(Marinobacter)和油杆菌(Petrobacter);第2 轮激活后主要包括脱硫杆菌(De⁃thiobacter)、不动杆菌(Acinetobacter)、吞菌弧菌(Pe⁃redibacter)、栖热孢菌(Thermotoga);第3 轮优势菌以纤维单孢菌属(Cellulomonas)、脱硫弧菌(Desulfovi⁃brio)、脱硫杆菌(Dethiobacter)、海杆菌(Marino⁃bacter)为主;第4 轮优势菌以假单胞菌(Pseudomo⁃nas)、脱硫弧菌(Desulfovibrio)、希瓦氏菌属(She⁃wanella)和海杆菌(Marinobacter)。
SL-1 菌能够适应沾3 油藏环境,在油藏微生物生态系统中具有一定竞争优势,多轮次外源菌的注入使该菌在内源群落中逐渐保持稳定,功能菌优势地位凸显。但是随着培养时间延长,Geobacillus菌在整个微生物生态系统中的占比有所下降,由开始21%降低至13%,推测随着激活剂体系消耗,代谢产物积累、内源菌的竞争繁殖等因素影响,油藏生态系统中微生物群落结构开始发生转变。
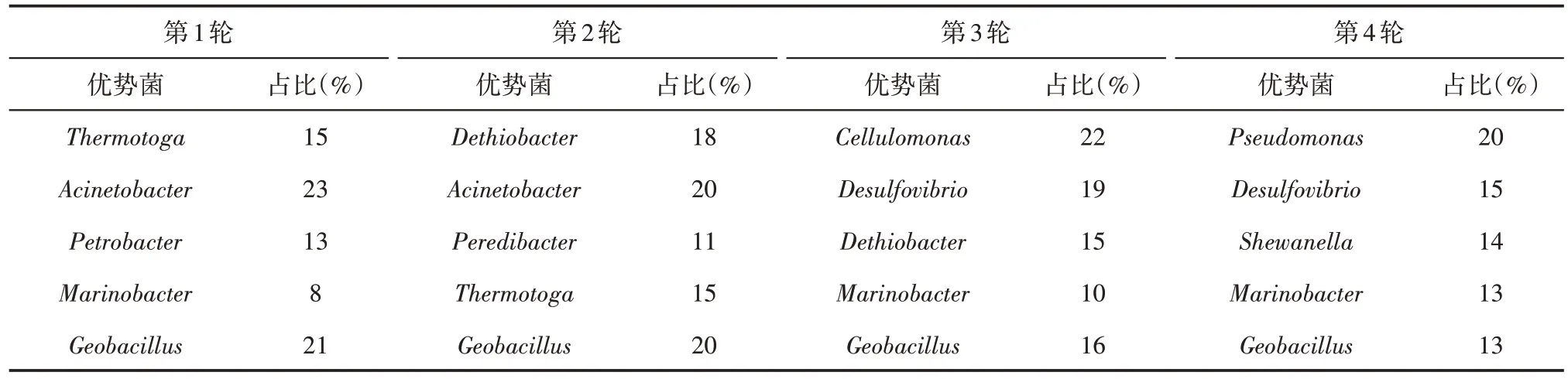
表2 4轮激活过程中驱出液的优势菌群Table2 Dominant bacterium in produced liquid during four rounds of activator injections
2.4.2 不同岩心位置微生物群落结构
对岩心不同部位油砂中微生物种群结构及SL-1 菌进行了分析,结果显示SL-1 菌在岩心入口处占比最高,可达55%,随着离入口端距离增加,该菌在菌群中的比例逐渐降低,出口端为12%(图7)。分析认为:一方面,该菌具备兼性厌氧的生理特性,可以在岩心不同位置进行生长繁殖;另一方面,激活剂体系注入后充分激活了地层水中内源菌,微生物多样性增强。同时,对不同位置的SL-1菌进行基因定量分析,结果显示(图8),该菌在岩心中前部数量较高,最高可达106copies/mL,随之缓慢下降,出口端数量约为103copies/mL,说明大部分外源菌依然滞留于岩心中,可以继续有效发挥驱油作用。此外,还可以看出SL-1菌在岩心不同位点的浓度与残余油饱和度存在一定负对应关系,该菌浓度高的位点对应的残余油饱和度比较低(残余油饱和度约为30%)。
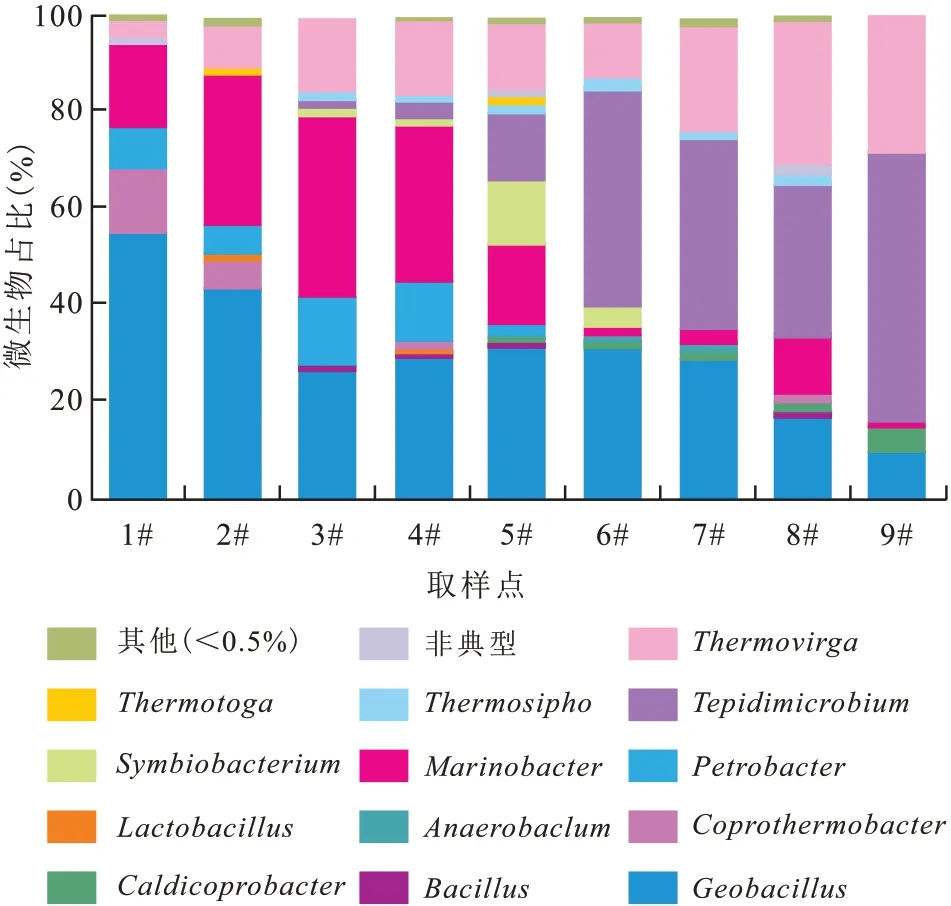
图7 油砂不同取样点的微生物种群结构Fig.7 Microbial community structure at different sampling points in oil sands
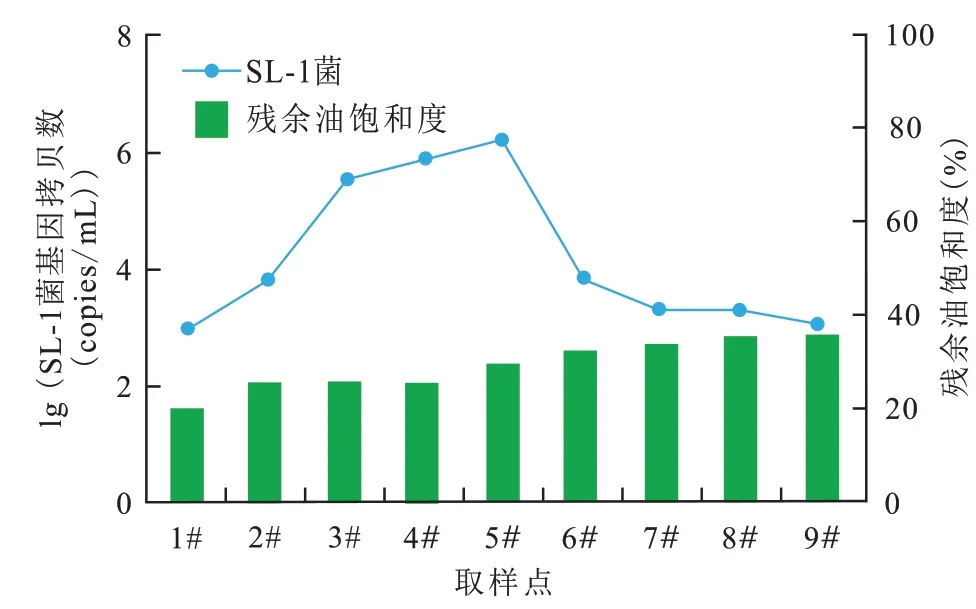
图8 SL-1菌在岩心中的空间分布Fig.8 Spatial distribution of SL-1 in core
3 结论
SL-1 菌能够在模拟油藏环境的微观可视模型中生长代谢,同单纯激活内源菌的空白对照相比,添加该菌后可以增强微生物与原油的相互作用,提高了微生物的原油驱替效率。岩心填砂模型实验中该菌始终是产出液微生物优势种群之一,其浓度与岩心残余油饱和度呈现负对应关系,表明该菌生长繁殖与岩心驱油密切相关,与微观模型驱油现象一致。随着注入时间延长,该菌在生态系统中占比有所下降。因此,要使该菌长期在油藏内源菌生态系统中维持稳定,还需要对SL-1 菌的注入方式、注入时间、激活剂体系种类等调控方式继续进行深入研究。
此外,内源菌驱油过程中油藏微生物数量随着时间延长逐渐趋于平稳,后期即使再注入激活剂体系,微生物数量也不会有显著的增殖变化,整个生态系统达到一个平衡状态。外源菌的注入可以刺激油藏微生物进一步生长繁殖,提高微生物驱油效果。因此,调控研究外源菌与内源菌之间的协同机制,充分发挥外源菌强化内源菌驱油的效果,将为微生物驱油技术的发展提供新思路。

